一種新型抗菌肽Hydramacin-1 在畢赤酵母中的重組表達、純化及其抗菌活性
孟德梅,石林,李文娟,孫雪晴,郭雅君,賈雪霞,樊振川
(省部共建食品營養(yǎng)與安全國家重點實驗室,食品營養(yǎng)與安全教育部重點實驗室,天津科技大學食品工程與生物技術學院,大健康生物技術國際科技合作基地,天津市大健康生物技術國際聯(lián)合研究中心,天津 300457)
抗菌肽(antimicrobial peptides,AMPs)是一種來源于動物、植物及真菌等先天免疫組織的有抑菌活性的小分子短肽[1],它可有效御防病原體入侵,大部分抗菌肽具有廣譜抗菌活性和抑制細菌、真菌、寄生蟲和病毒生長的功能,有些抗菌肽對腫瘤具有選擇性殺傷作用[2-4].抗菌肽與傳統(tǒng)抗生素相比,其作用機理獨特,不易產(chǎn)生耐藥性,因此成為了有望替代抗生素的理想藥物[5].目前,基因工程法是生產(chǎn)抗菌肽的主要方法之一[6],其中利用畢赤酵母表達體系生產(chǎn)抗菌肽是一種重要方式.該表達體系相比于原核表達體系具有諸多優(yōu)點[7-9],如可以將蛋白分泌到胞外,在蛋白質(zhì)的加工、折疊、翻譯后修飾等方面具有諸多優(yōu)勢,從而能較好地保持目的蛋白的生物活性.現(xiàn)在已有諸多來源的抗菌肽在畢赤酵母表達體系中成功表達,如人源抗菌肽human cathelicidin[10]、雞源抗菌肽Fowlicidin-3[11]和植物源抗菌肽PaDef[12]等.
抗菌肽Hydramacin-1 來源于大乳頭水螅的上皮防御組織,氨基酸序列與已發(fā)現(xiàn)的抗菌肽氨基酸序列具有極低的相似性,是一種新型抗菌肽[13].該抗菌肽含有60 個氨基酸殘基,凈電荷為+6,結構中具有一個二硫鍵橋.二硫鍵橋?qū)⒃撾闹械囊粋€α-螺旋和β-折疊連接在一起,形成一個結扣式的結構,有利于維持該結構的穩(wěn)定.疏水性氨基酸的比例為33%,分布在兩側,由于帶正電荷的殘基被夾在兩個疏水區(qū)域的中間,疏水區(qū)域的基團與細胞膜上的疏水基團相互作用插到磷脂雙分子層中,從而使得細胞聚集在一起,因此它的抑菌機制被描述為聚集效應模型.Jung等[13]鑒定了由大腸桿菌表達系統(tǒng)表達的重組抗菌肽Hydramacin-1 的抗菌活性,結果顯示Hydramacin-1具有廣譜抗菌特性,對革蘭氏陰性菌具有較好的抑制效果,但對革蘭氏陽性菌的抑制效果并不理想,其中對金黃色葡萄球菌的最小抑菌濃度高于100 μg/mL.因此,本文將抗菌肽Hydramacin-1 在畢赤酵母系統(tǒng)中表達,獲得重組抗菌肽Hydramacin-1,并檢測其表達產(chǎn)量和抗菌活性.
1 材料與方法
1.1 材料
1.1.1 菌株和質(zhì)粒
畢赤酵母(Pichia pastoris)GS115 和質(zhì)粒pPICZαA 購于Invitrogen 公司;大腸桿菌(Escherichia coli)O157 ATCC35150、大腸埃希氏菌(Escherichia coli)ATCC10305、單增李斯特氏菌(Listeria monocytogenes)ATCC21633 和金黃色葡萄球菌(Staphylococcus aureus)ATCC25923 均購于美國菌種保藏中心;枯草芽胞桿菌(Bacillus subtilis)LZZ-133 由中國農(nóng)業(yè)大學申琳教授惠贈.
1.1.2 主要試劑
博來霉素(Zeocin),Invitrogen 公司;慶大霉素(Gen)、超低分子質(zhì)量蛋白質(zhì)marker 和BCA Protein Assay Kit,北京索萊寶科技有限公司;限制性核酸內(nèi)切酶EcoRⅠ、KpnⅠ和Taq DNA 聚合酶,F(xiàn)ermentas公司;限制性核酸內(nèi)切酶SacⅠ、dNTPs、1 kbp DNA Ladder、100 bp DNA Ladder 和DNA marker Trans 2 K,全式金生物技術有限公司;其他試劑均為國產(chǎn)分析純.
1.2 方法
1.2.1 Hydramacin-1 重組表達載體的構建
依據(jù)畢赤酵母密碼子的偏好性[14]優(yōu)化抗菌肽Hydramacin-1 的DNA 序列,在Hydramacin-1 DNA序列的 5′端添加酶切位點 EcoRⅠ,起始密碼子ATG,3′端添加終止密碼子TAA,酶切位點KpnⅠ,最終順序為:EcoRⅠ-ATG-Hydramacin-1 目的基因-TAA-KpnⅠ.將以上設計好的目的基因送往蘇州金唯智生物科技有限公司進行全基因合成,并通過EcoRⅠ和KpnⅠ兩個酶切位點將合成的目的基因克隆至載體pPICZαA 上,最終得到含有重組表達質(zhì)粒pPICZαA-Hydramacin-1 的穿刺菌.
挑取含有重組表達質(zhì)粒pPICZαA-Hydramacin-1的穿刺菌接種于含有 Zeocin(終質(zhì)量濃度為25 μg/mL)的LB 培養(yǎng)基中,37 ℃、200 r/min 振蕩培養(yǎng)過夜.使用北京索萊寶生物科技有限公司的質(zhì)粒小提試劑盒提取質(zhì)粒.提取的質(zhì)粒用限制性核酸內(nèi)切酶EcoRⅠ和KpnⅠ對其進行雙酶切驗證,并送往北京奧科生物公司測序驗證.
1.2.2 重組抗菌肽Hydramacin-1 的誘導表達與鑒定
使用限制性核酸內(nèi)切酶SacⅠ對重組表達質(zhì)粒pPICZαA-Hydramacin-1 在37 ℃進行單酶切2 h,使其線性化.經(jīng)DNA 產(chǎn)物回收試劑盒收集的線性化質(zhì)粒與畢赤酵母GS115 感受態(tài)細胞混勻,置于預冷的2 mm 電轉杯中,以電壓1 500 V、電容25 μF、電阻200 ? 的條件進行電擊,最后將電轉化產(chǎn)物涂布于含有Zeocin(終質(zhì)量濃度為200 μg/mL)的YPD 平板上,30 ℃培養(yǎng)3~4 d,觀察轉化子的生長.
利用菌落PCR 驗證的方法[15]進行陽性轉化子的篩選.挑取不同酵母轉化子于0.2% SDS 溶液中,混勻,沸水浴 10 min,使菌體細胞膜破裂釋放出基因組DNA,12 000 r/min 離心10 min,取上清液作為實驗組的PCR 模板;用未轉入質(zhì)粒的畢赤酵母GS115 單克隆作陰性對照,同樣上述處理;用重組質(zhì)粒pPICZαA-Hydramacin-1 作陽性對照.利用軟件(Primer premier 5.0)設計的特異性引物 P1(5'-GAAGCTGTCATCGGTTACTCA-3')和 P2(5'-TCC GCACAAACGAAGGTC-3')進行PCR 驗證.PCR 反應結束后,取5 μL PCR 產(chǎn)物進行0.8%瓊脂糖凝膠電泳,檢測抗菌肽基因是否成功插入到畢赤酵母基因組中.
挑取不同陽性轉化子于5 mL BMGY 培養(yǎng)基中,28 ℃、220 r/min 培養(yǎng)18~24 h 后,按20%的比例轉接于25 mL BMGY 培養(yǎng)基中培養(yǎng);待A600達8.0~10.0 時,收集菌體,離心棄上清液,用甲醇體積分數(shù)為1.0%的25 mL BMMY 培養(yǎng)基重懸菌體,進行誘導表達;每隔24 h 補加甲醇,96 h 后,離心收集上清液進行Tricine-SDS-PAGE 凝膠電泳[16],檢測目的蛋白是否表達.
1.2.3 表達條件的優(yōu)化
將擴大培養(yǎng)后的重組酵母轉化子離心收集,重懸于甲醇體積分數(shù)分別為 0.5%、1%、1.5%、2%的BMMY 培養(yǎng)基中培養(yǎng),每隔24 h 取樣,并補加甲醇至各自的終濃度,144 h 后終止培養(yǎng),最后通過BCA Protein Assay Kit 測定發(fā)酵上清液中的總蛋白含量,同時進行Tricine-SDS-PAGE 凝膠電泳和銀染實驗檢測目的蛋白,并結合ImageJ 1.8.0 軟件對電泳結果進行灰度分析,比較不同發(fā)酵時間、不同甲醇體積分數(shù)對目的蛋白表達量的影響.
1.2.4 重組抗菌肽Hydramacin-1 的純化
通過離子交換層析的方法,使用1 mL HiTrap SP柱(GE Healthcare,USA)純化抗菌肽 Hydramacin-1.首先,將發(fā)酵上清液在4 ℃、8 000 g 的條件下離心10 min,去除菌體,并用0.22 μm 的水系濾器過濾發(fā)酵上清液;然后用3 個柱體積的50 mmol/L 磷酸鹽緩沖液(pH 7.0)對發(fā)酵上清液透析置換.HiTrap SP 柱先用5 倍柱體積的含有1 mol/L NaCl 的50 mmol/L磷酸鹽緩沖液(pH 7.0)洗滌,再用5 倍柱體積的50 mmol/L 磷酸鹽緩沖液(pH 7.0)平衡.用注射器將樣品以1 mL/min 的速度注入柱中,用5 倍柱體積的50 mmol/L 磷酸鹽緩沖液(pH 7.0)漂洗;最后用5 倍柱體積的含有150 mmol/L NaCl 的50 mmol/L 磷酸鹽緩沖液(pH 7.0)洗脫目的蛋白,通過Tricine-SDSPAGE 凝膠電泳和銀染實驗,結合ImageJ 1.8.0 軟件進行灰度分析,檢測純化后的抗菌肽純度.將純化后的抗菌肽真空冷凍干燥,保存.
1.2.5 重組抗菌肽Hydramacin-1 的抑菌活力測定
通過測定抗菌肽質(zhì)量濃度分別為30、60、80、100 μg/mL 時對各指示菌的抑制率,進而評價其抗菌活性的高低.挑取指示菌于1 mL LB 培養(yǎng)基中,培養(yǎng)至對數(shù)生長期,再用LB 培養(yǎng)基稀釋菌體至1×105mL-1左右,待用.用無菌的50 mmol/L 磷酸鹽緩沖液(pH 7.0)將抗菌肽溶解至所需濃度,將20 μL 的各濃度抗菌肽加入96 孔板中,再向每個孔中加入100 μL 稀釋完畢的菌液,每個樣品3 個平行,37 ℃過夜振蕩培養(yǎng)16 h,通過酶標儀在600 nm 下測定樣品的吸光度.實驗組 A600值記為 A,20 μL 無菌的50 mmol/L 磷酸鹽緩沖液(pH 7.0)和100 μL 的新鮮LB 培養(yǎng)基混合液吸光度為 A1,20 μL 無菌的50 mmol/L 磷酸鹽緩沖液(pH 7.0)與100 μL 的受試菌混合液吸光度為A0,按照式(1)計算抑制率.

2 結果與分析
2.1 Hydramacin-1重組表達載體的構建
抗菌肽 Hydramacin-1 的 DNA 序列全長為180 bp,具有60 個氨基酸,根據(jù)畢赤酵母密碼子的偏好性(http://www.kazusa.or.jp/codon/)對其基因序列進行優(yōu)化設計(圖1).
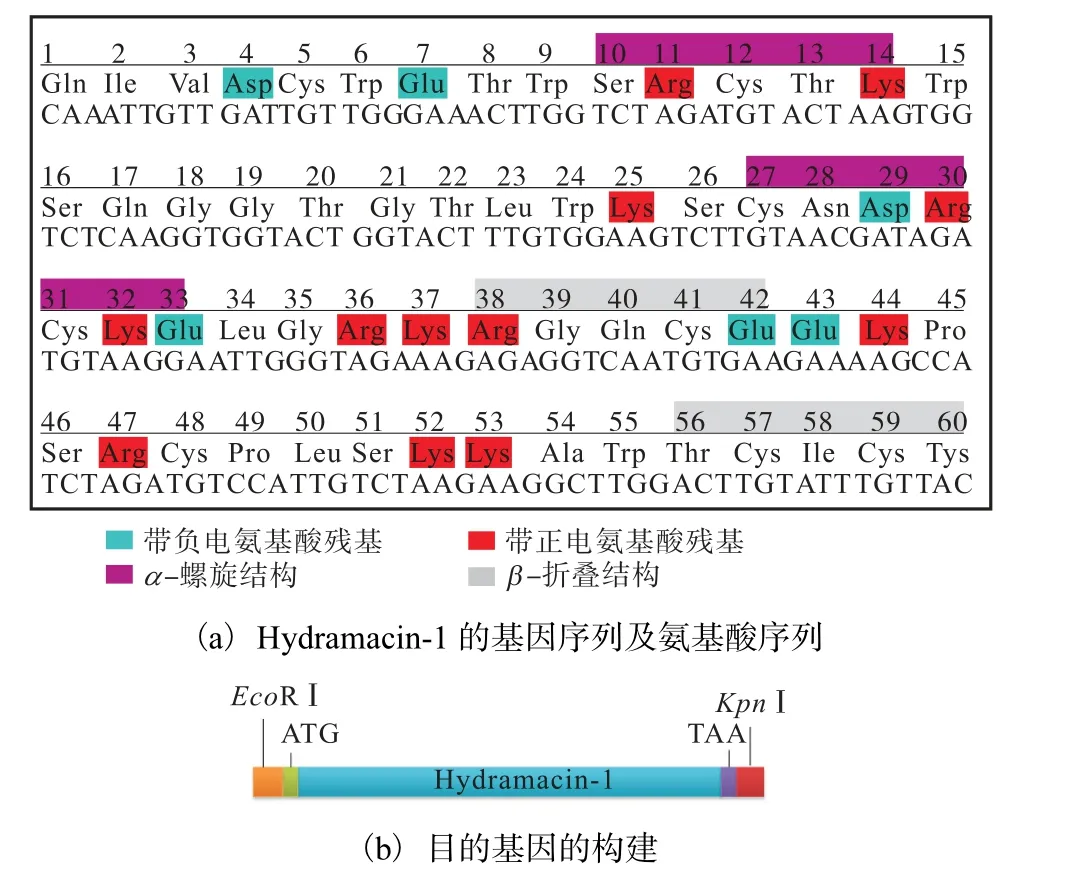
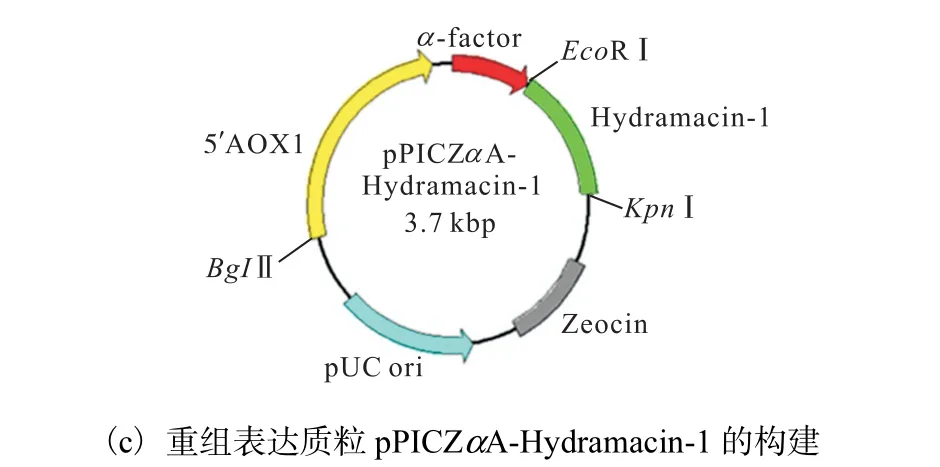
圖1 pPICZαA-Hydramacin-1重組表達載體的構建Fig.1 Construction of P.pastoris expression plasmid pPICZαA-Hydramacin-1
優(yōu)化后的DNA 序列如圖1(a)所示;在優(yōu)化后的DNA 序列前加上EcoRⅠ酶切位點和ATG 起始密碼子,序列后加上TAA 終止密碼子和KpnⅠ酶切位點,序列長度為198 bp,如圖1(b)所示;再將其連接至畢赤酵母外泌型表達載體pPICZαA 中,如圖1(c)所示.
用限制性核酸內(nèi)切酶EcoRⅠ和KpnⅠ對獲得的重組質(zhì)粒進行雙酶切,得到兩條大小分別約為200 bp和3 500 bp 的條帶,與理論上設計的載體長度一致(圖2).此后將質(zhì)粒送往北京奧科公司測序,測序結果同樣證明重組表達質(zhì)粒pPICZαA-Hydramacin-1 構建成功.
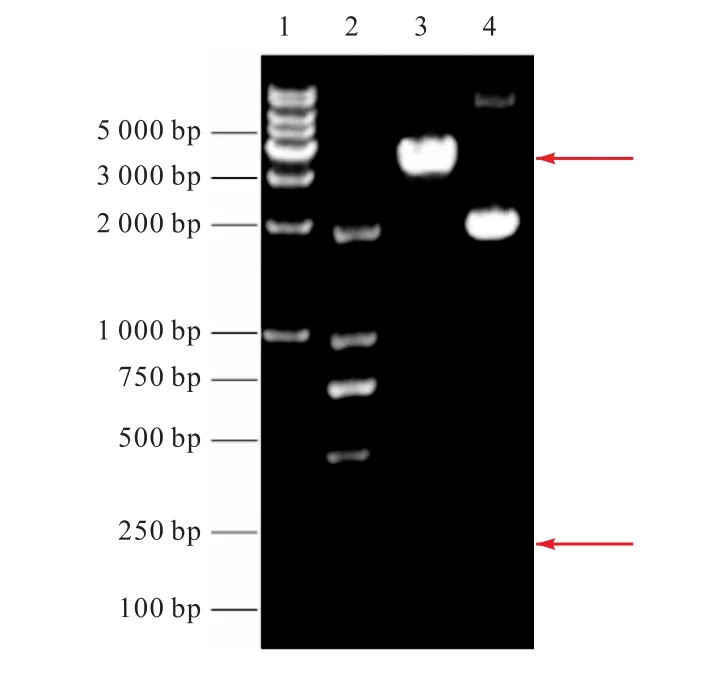
圖2 pPICZαA-Hydramacin-1的雙酶切驗證Fig.2 Restriction identification of pPICZαA-Hydramacin-1
2.2 高表達量轉化子的獲得
采用菌落PCR 的方法進行陽性轉化子的驗證,結果如圖3 所示.泳道1 為陰性對照,無條帶出現(xiàn),證明實驗的可靠性;泳道2 為陽性對照,重組質(zhì)粒作模板,擴增出750 bp 的單一目的條帶;泳道3—9 為驗證的7 個不同酵母轉化子,其所出現(xiàn)的條帶與陽性對照條帶相一致,說明Hydramacin-1 基因已整合到畢赤酵母基因組中,它們均為陽性轉化子.
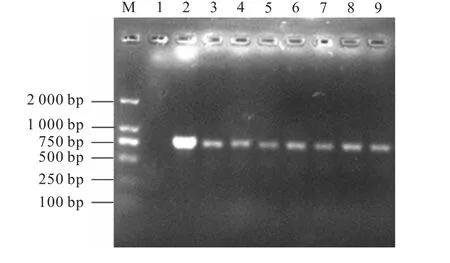
圖3 菌落PCR篩選陽性轉化子Fig.3 Positive transformant screening by colony-PCR
由于不同轉化子中插入的目的基因片段數(shù)目不相同,導致拷貝數(shù)不同;拷貝數(shù)越高,表達量越高,因此進一步篩選獲得的陽性轉化子.取等體積的不同陽性轉化子的發(fā)酵上清液進行Tricine-SDS-PAGE 凝膠電泳檢測,并對不同轉化子的目的蛋白條帶進行灰度分析比較,結果如圖4 所示.7 個陽性轉化子表達的目的蛋白大小均在7.0×103左右,證明其得到了準確表達;通過對目的條帶進行灰度分析比較,最終選取了蛋白表達量最高的6 號轉化子進行后續(xù)實驗研究.
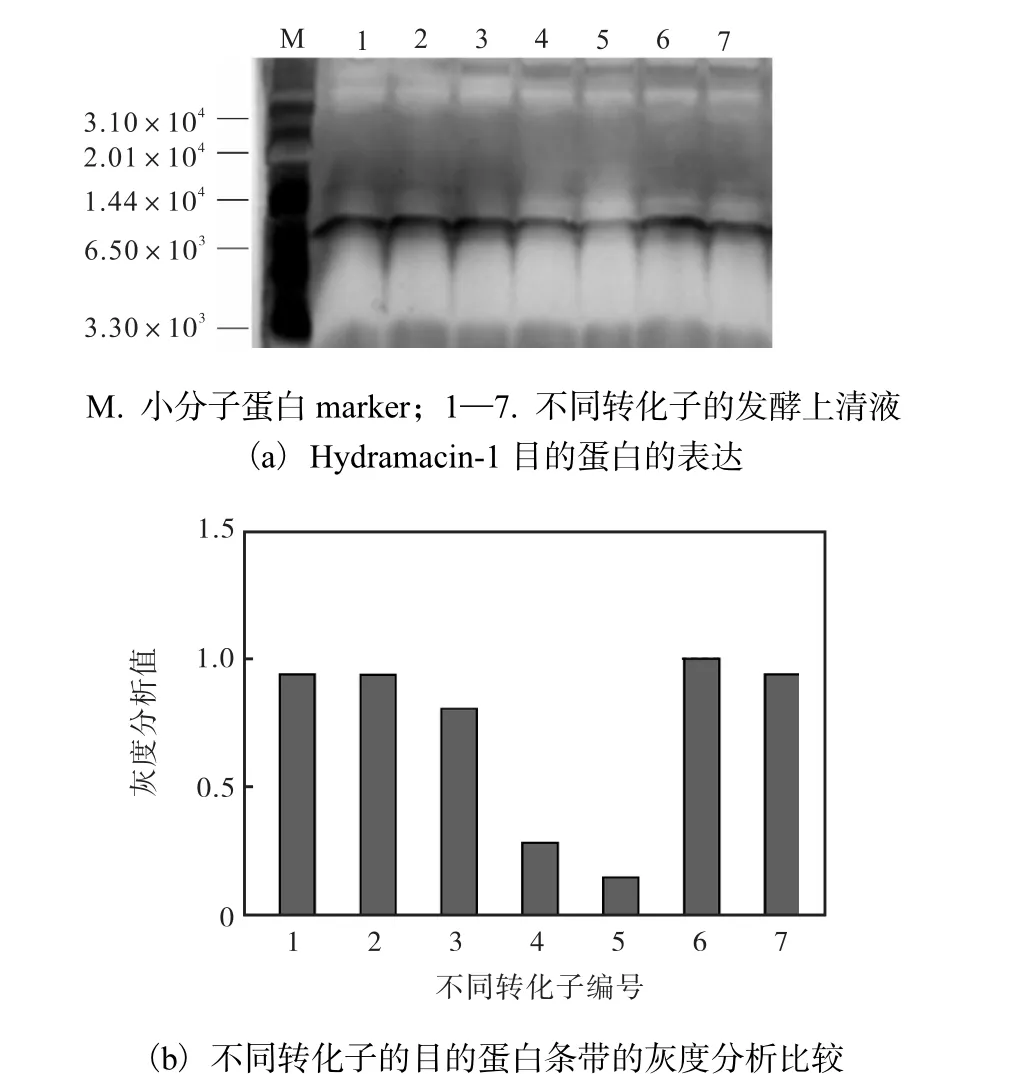
圖4 重組抗菌肽Hydramacin-1在畢赤酵母中的誘導表達Fig.4 Expressing recombinant Hydramacin-1 in P.pastoris
2.3 發(fā)酵時間和甲醇體積分數(shù)對蛋白表達的影響
2.3.1 誘導表達條件對總蛋白表達量的影響
由于實驗中所用載體為外泌型表達載體,蛋白主要富集在發(fā)酵上清液之中,并且GS115 菌株分泌的自身蛋白量很低[17],所以通過BCA 法測定上清液中總蛋白的表達量情況,也可在一定程度上反映目的蛋白的表達量情況.誘導表達條件對總蛋白表達量的影響如圖5 所示.由圖5 可知:轉化空白質(zhì)粒的畢赤酵母在不同體積分數(shù)甲醇的誘導下,總蛋白表達水平在72 h 后趨于穩(wěn)定,最高表達量小于100 μg/mL;而在4 個不同體積分數(shù)甲醇的誘導下,轉化重組表達載體的陽性轉化子的總蛋白表達水平均呈上升趨勢,并在144 h 時達到最高,在甲醇體積分數(shù)為1.5%時,陽性轉化子分泌的總蛋白量已達200 μg/mL,是轉化空質(zhì)粒畢赤酵母蛋白表達量的2 倍.

圖5 誘導表達條件對總蛋白表達量的影響Fig.5 Effect of expression conditions on total protein expression
2.3.2 誘導表達條件對目的蛋白表達量的影響
通過Tricine SDS-PAGE 凝膠電泳結合灰度分析,在甲醇體積分數(shù)為1.5%時,目的蛋白表達量隨誘導時間的延長而增加,在誘導時長為120 h 時,灰度分析值最大,目的蛋白表達量達到最高(圖6).
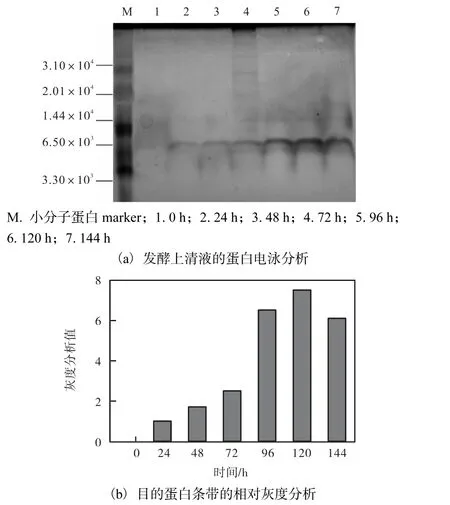
圖6 誘導表達時間對目的蛋白表達量的影響Fig.6 Expression of recombinant Hydramacin-1 at different induction time
在誘導表達時間為120 h 的條件下,目的蛋白表達量隨甲醇體積分數(shù)的提高而增加,在甲醇體積分數(shù)為1.5%時,目的蛋白表達量達到最高(圖7).
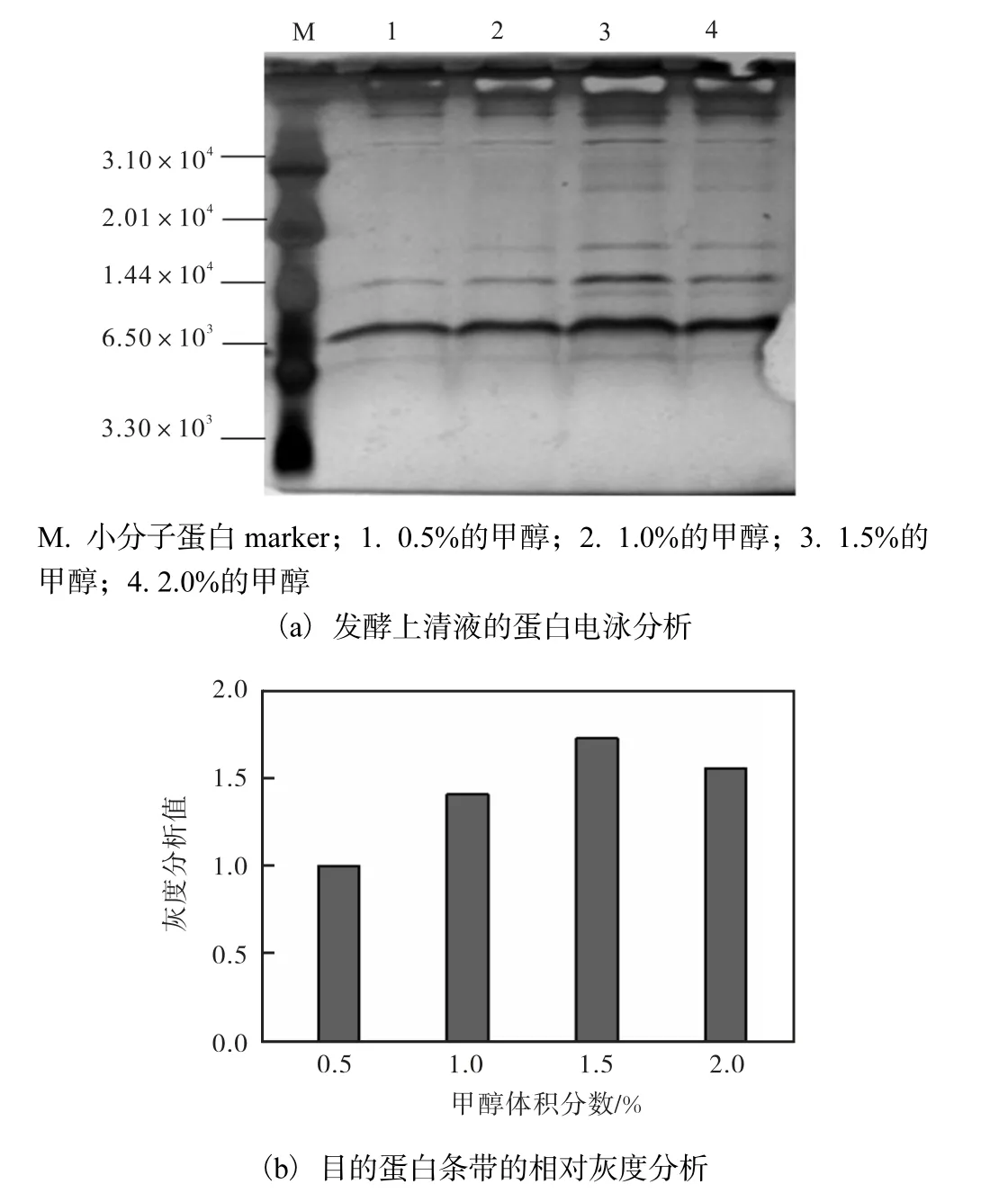
圖7 甲醇體積分數(shù)對目的蛋白表達量的影響Fig.7 Expression of recombinant Hydramacin-1 induced with different methanol concentrations
因此,甲醇體積分數(shù)為1.5%,發(fā)酵時間為120 h為發(fā)酵最優(yōu)條件,總蛋白表達量可達166 μg/mL.由灰度分析得知,目的蛋白表達量占總蛋白量的50%以上,由此可計算出目的蛋白的產(chǎn)量可達83 mg/L.
2.4 重組抗菌肽Hydramacin-1的純化
通過HiTrap SP 柱對發(fā)酵上清液進行純化,得到了純度較高的目的蛋白,如圖8 所示.
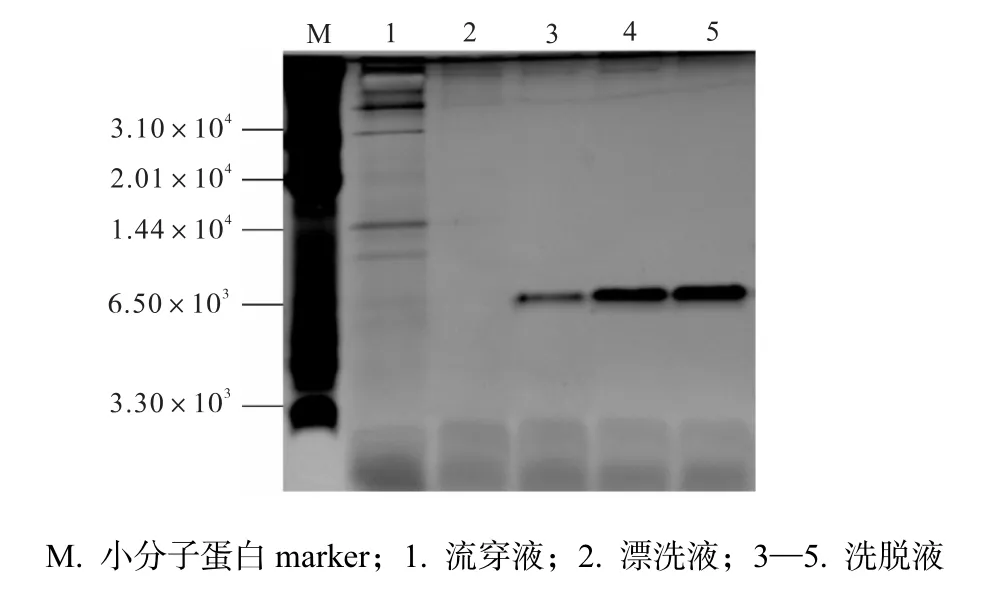
圖8 陽離子交換柱純化重組抗菌肽Hydramacin-1Fig.8 Cation exchange column purified recombinant Hydramacin-1
泳道1 為流穿液,雜蛋白流出,目的蛋白僅有微小損失;泳道2 為漂洗液,未見目的蛋白被洗下來,可見漂洗液的離子強度與pH 條件選擇正確;泳道3—5 為洗脫液對目的蛋白進行洗脫的結果,得到單一目的條帶,經(jīng)灰度分析,蛋白純度達90%以上.
2.5 重組抗菌肽Hydramacin-1的抑菌活力測定
使用純化后的目的蛋白進行抑菌活力測定,結果如圖9 所示.由圖9 可知:重組抗菌肽Hydramacin-1具有廣譜抗菌特性,8 0 μ g/m L 的重組抗菌肽Hydramacin-1 可將大腸桿菌O157 ATCC35150 全部抑制,抑制率達100%;100 μg/mL 的重組抗菌肽Hydramacin-1 對大腸埃希氏菌ATCC10305 的抑制率為100%,而對革蘭氏陽性菌單增李斯特氏菌ATCC 21633、金黃色葡萄球菌ATCC25923 和枯草芽胞桿菌LZZ-133 的抑制率僅分別為38%、72%和64%.由此可見,相比于革蘭氏陽性菌,重組抗菌肽Hydramacin-1 對革蘭氏陰性菌具有更好的抑制作用.
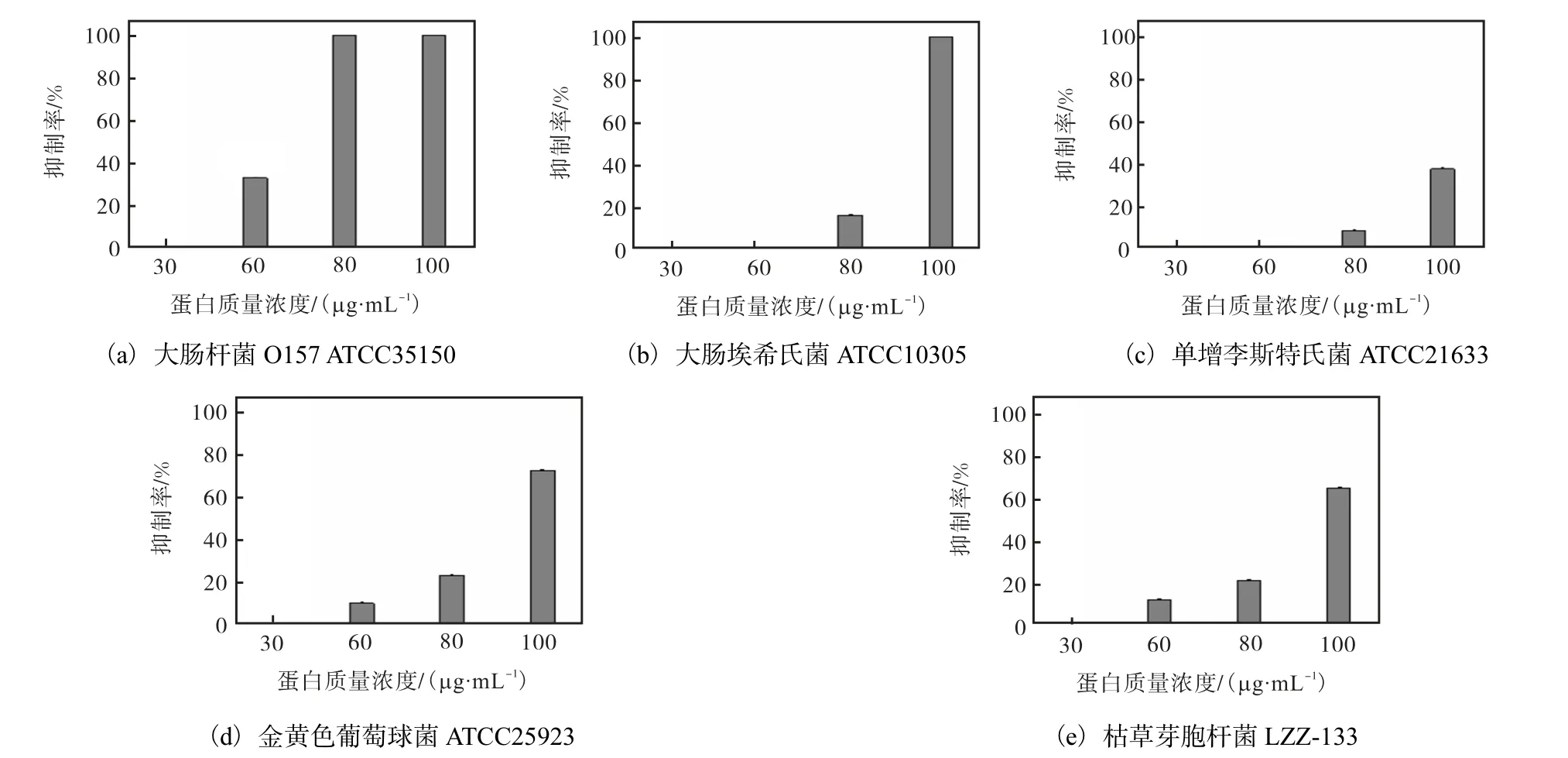
圖9 不同蛋白質(zhì)量濃度下的重組抗菌肽Hydramacin-1對指示菌的抑制率Fig.9 Inhibition rate of the purified recombinant Hydramacin-1 with different concentration against the tested bacterial strains
3 討 論
抗菌肽來源廣泛,穩(wěn)定性好,并且不易產(chǎn)生耐藥性,可應用于醫(yī)藥、食品、飼料等不同領域,因此抗菌肽成為了當前研究的熱點.例如,由于Nisin[18]可以很好地抑制單增李斯特菌和梭狀肉毒桿菌的生長,進而有效保證食品安全,延長貨架期,很多國家如美國、中國等均允許其應用到食品防腐保鮮上,尤其是應用于易被單增李斯特菌污染的乳制品上.本研究中的抗菌肽Hydramacin-1 若直接從生物體Hydra magnipapillata 中分離制備,存在著成本高、效率低、分離難度大等諸多問題.為解決這個問題,本實驗選用畢赤酵母表達系統(tǒng),制備了可高效表達重組抗菌肽Hydramacin-1 的基因工程菌株.通過多次實驗以及對總蛋白表達量和目的蛋白表達量進行分析,120 h為最佳誘導表達時間.超過120 h,目的蛋白表達量降低,分析原因可能為發(fā)酵時間過長,目的蛋白發(fā)生降解,雜蛋白增多所致.此外,誘導所使用的甲醇體積分數(shù)也不宜過高,這是因為甲醇體積分數(shù)過高會對細胞造成毒害作用.本實驗顯示重組抗菌肽Hydramacin-1 在畢赤酵母中的最優(yōu)表達條件是:培養(yǎng)溫度為28 ℃,甲醇體積分數(shù)為1.5%,發(fā)酵時間為120 h.在此條件下,目的蛋白表達量可達83 mg/L.許多其他類型的抗菌肽,如 Mytichitin-A[19]、Scygonadin[20]和VpDef[21]也已在畢赤酵母中成功表達,并且在最佳培養(yǎng)條件下,這些重組肽的產(chǎn)量分別可達到45.5、70、60 mg/L.以上結果均可表明,畢赤酵母表達系統(tǒng)有利于重組抗菌肽Hydramacin-1 的高效表達.后續(xù)可通過發(fā)酵及進一步優(yōu)化發(fā)酵條件的方式提高其產(chǎn)量.
重組抗菌肽Hydramacin-1 的高抗菌活力非常重要.本文測定了不同濃度下的重組抗菌肽Hydramacin-1 對5 株受試菌的抑制率,可知其具有廣譜抗菌活性,對革蘭氏陰性菌的抑菌效果明顯優(yōu)于革蘭氏陽性菌,大腸桿菌O157 對其最為敏感.這一特點與大腸桿菌體系所表達的Hydramacin-1[22]的抗菌特點相一致.本研究中的重組抗菌肽Hydramacin-1 相比于Defensing-TK[23](對金黃色葡萄球菌的 MIC 為3 μg/mL)和rMP1106[24](對金黃色葡萄球菌的MIC為0.06 μg/mL)等抗菌肽的抗菌活性,還需進一步提高.目前主要是通過分子設計與結構改造的方法來提高肽的生物活性[25-26],例如氨基酸的替換,將一個或多個氨基酸經(jīng)定點突變技術替換為精氨酸、賴氨酸等帶正電的氨基酸,增加抗菌肽的帶正電性,進而提高抗菌肽的生物活性.目前本實驗室也正在對抗菌肽進行定向改造,以期獲得活性更高的抗菌肽.
綜上所述,本研究首次成功制備了具有高效表達能力和較好生物活性的重組抗菌肽Hydramacin-1 的畢赤酵母表達菌株,為后續(xù)抗菌肽Hydramacin-1 更深入的科學研究和應用奠定了基礎.

