食品用蠟對大白鼠腸道黏膜及其相關淋巴組織的影響
王宣敬,楊妍梅,楊 彪,王玉桂,扎西英派
(西北民族大學生命科學與工程學院,甘肅 蘭州730030)
食品用蠟是一個廣泛的概念,它指的是直接或間接用于食品及相關材料中的一些天然動植物分泌物,其質地如蠟,而又與其他化工產品的蠟質物有本質上的不同[1]。食品用蠟作為一種涂被劑而廣泛用于水果和蔬菜表面,可以防止水分蒸發和細菌侵入,延長其保質期,從而達到果蔬保鮮的目的,常用做水果涂被劑的蠟有巴西棕櫚蠟、液體石蠟等[2]。無論何種形式的食品用蠟,都會對人和動物體的消化系統造成不同程度的損害。蠟制品在動物機體內很難被消化,有報道稱只有部分鳥類擁有消化蠟的能力[3],微量食品用蠟的攝入,一般不會對機體造成太大影響,但如果食用量過多或蠟制品在體內蓄積,會使得人體排毒和分解器官(肝臟、腎臟)負擔過重,影響機體健康[4]。目前,食品用蠟進入消化道后其黏膜免疫系統的反應情況未見報道,食品用蠟對動物機體的安全性有待再次評估。試驗以大白鼠為模型,選用食品用蠟中使用較多的巴西棕櫚蠟(植物蠟)和液體石蠟(工業蠟)為試驗材料,探究食品用蠟對大白鼠腸道黏膜及其相關淋巴組織的影響,對大白鼠腸道黏膜免疫系統有一個整體認識,為下一步研究食品用蠟對大白鼠黏膜免疫系統各項功能的影響奠定基礎。從而為食品用蠟的限量以及食品安全提供參考依據。
1 材料
1.1 試驗動物 健康的經檢疫合格且生長良好體重200 g 的SPF 級SD 大鼠24 只(雌雄各半),購自甘肅省蘭州市榆中縣動物市場。
1.2 藥品與試劑 食品用蠟(巴西棕櫚蠟、液體石蠟),上海新諾化工有限公司生產;甲醛溶液、乙醇、冰醋酸和二甲苯(均為分析純),天津市富宇精細化工有限公司生產;醇溶性伊紅(Eosin Y)、蘇木精(Hematoxylin),上海伯奧生物科技有限公司生產;石蠟,上海標本模型廠生產。
1.3 主要儀器 數碼照相機(型號為Nikoncoolpix 4500),日本尼康公司生產;鍍鉻游標卡尺(型號為0 ~200 mm,精確度0.02 mm),上海申韓量具有限公司生產;電子天平(型號為SL-N),上海民橋精密科學儀器有限公司生產;可調式電熱板(型號為ML-1.8-4),北京科偉永興儀器有限公司生產;恒溫干燥器(型號為KW-I),上海躍進醫療器械廠生產;石蠟切片機(型號為LEICA Histo stat 820)、光學顯微鏡(型號為LEICA-DM500),德國萊卡公司生產;攤片機(型號為HD-P)、烘片機(型號為HD-H),浙江省金華市科迪儀器設備有限公司生產;自動染色儀(型號為MICROM HMS70),德國MICROM 公司生產;光學顯微鏡及Pro-express 圖像采集系統(型號為OLYMPUS BX-UCB/BX61),日本奧林巴斯公司生產。
2 方法
2.1 試驗動物建立模型 所用試驗動物為年齡平均2-3 月齡雌雄各半的大白鼠24 只,前期飼喂營養飼料適應2 日。將24 只大白鼠分為3 組,對照組(生理鹽水灌胃)8 只,試驗組1(巴西棕櫚蠟灌胃)8只,試驗組2(液體石蠟灌胃)8 只,參照相關文獻每隔1 d 灌胃1 次[4],按等效劑量換算0.01 mL/100 g,灌胃15 d,灌胃期間按照大白鼠正常的采食量喂食鼠糧30 g。
2.2 樣本采集 對大白鼠進行急性失血處死,迅速剖檢,分離出消化道,結扎幽門口和回盲口,摘取完整的腸道,去除腸管周圍脂肪及結締組織,置于新配制的生理鹽水(37 ℃)中(注意不要損傷腸黏膜),待腸道內容物自行脫落,腸黏膜結構清晰可見,迅速置4%甲醛溶液(pH 值7.4)中固定12 h 后換液固定10 d[5]。
2.3 檢測指標
2.3.1 解剖學檢查 每組隨機選取4 只經急性失血處死的大白鼠完整腸道,去除腸管周圍脂肪及結締組織,沿腸系膜縱行剖開腸管,暴露黏膜面,觀察黏膜的形態并統計黏膜表面派伊爾淋巴集結(Peyer′s patch,PP)。按照解剖學特征標記出十二指腸、空腸、回腸、盲腸、結腸和直腸,記錄各腸段PP 的數量、形態特征和分布情況,并拍照采集各腸段黏膜及PP 的解剖學圖片。用作解剖學數據采集的腸道,因其黏膜已經受到損傷,因此不再用于組織學檢查。
2.3.2 組織學檢查 對4%甲醛溶液固定的小腸及大腸腸段以5 cm 為間隔進行樣本采集,樣本長度約1 cm,按試驗分組進行標記。對所采集樣本進行石蠟包埋,常規切片(厚度為6 μm),蘇木精-伊紅染色(H.E.染色)和PAS 染色[6],經光學顯微鏡觀察并用Pro-express 圖像采集系統采集照片。
2.4 數據的統計分析 根據所得解剖學數據對試驗組與對照組腸道PP 的形態特征、數量和分布情況進行對比分析。按照解剖學進行分段(十二指腸、空腸、回腸、盲腸、結腸和直腸),每個腸段隨機選取10 張組織切片,使用Image-Pro Plus 6.0 圖像測量分析系統,測算每10 mm2面積內固有層與黏膜下層內淋巴濾泡的數量,每張切片中選取3 根柱狀排列整齊且最長的腸絨毛統計杯狀細胞的數量[7]。采用SPSS 21.0 軟件對試驗數據進行統計分析,試驗數據以“平均值±標準誤”表示,P <0.05 表示差異顯著。
3 結果
3.1 解剖學檢查
3.1.1 腸黏膜變化及黏膜PP 形態特征 對試驗組和對照組大白鼠的腸道黏膜表面進行解剖觀察,各組僅在空腸、回腸、盲腸和結腸中發現結構明顯的派伊爾淋巴集結,對比發現試驗組與對照組大白鼠小腸的PP 均為結節狀,大腸為火山口狀和結節狀,其形態無明顯差異;且腸黏膜均無病理變化。解剖學檢查未發現食品用蠟對腸道造成形態學損傷。各組小腸及大腸黏膜表面PP 的對比見圖1、2、3、4。
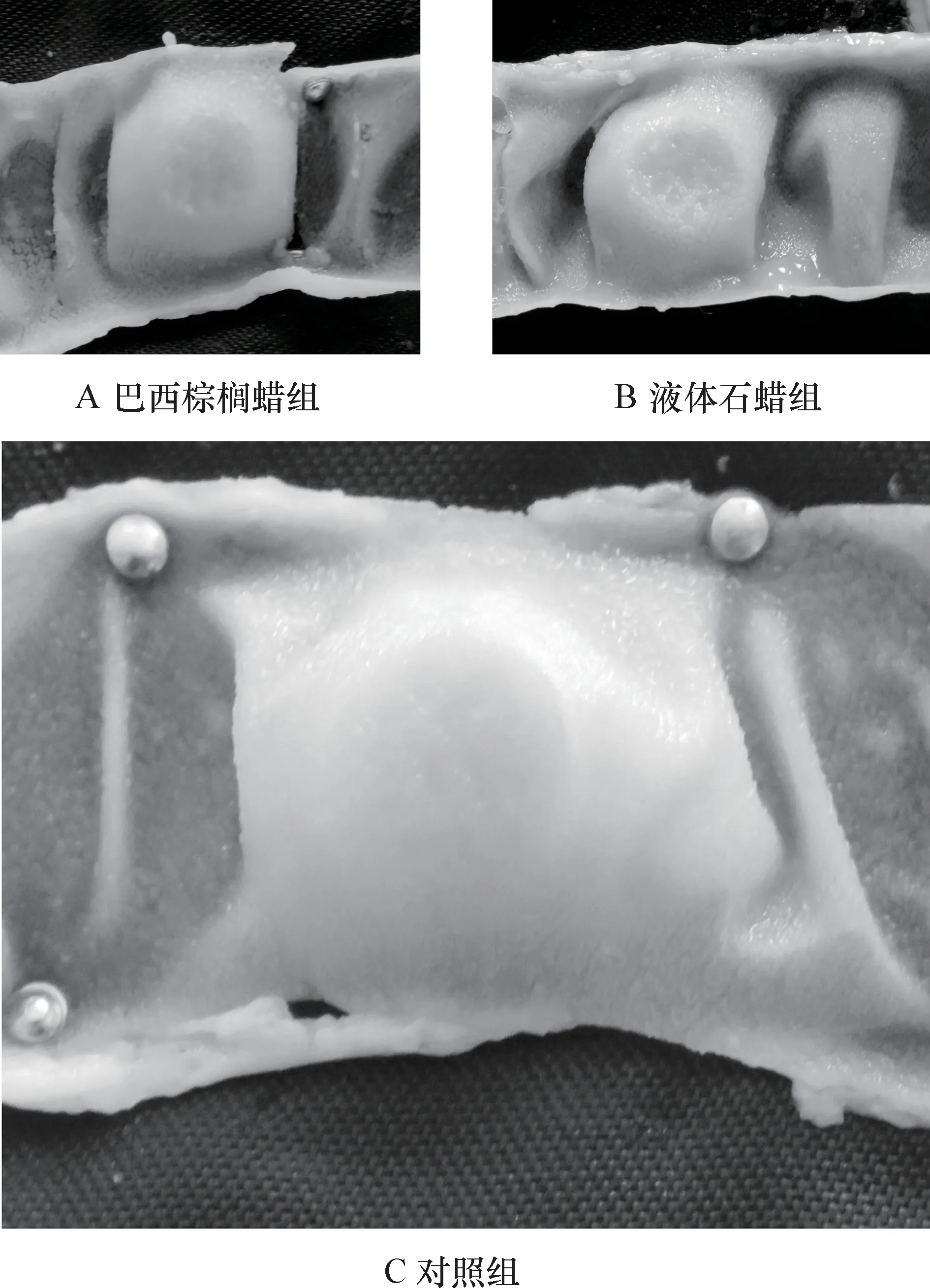
圖1 空腸黏膜表面PP 對比
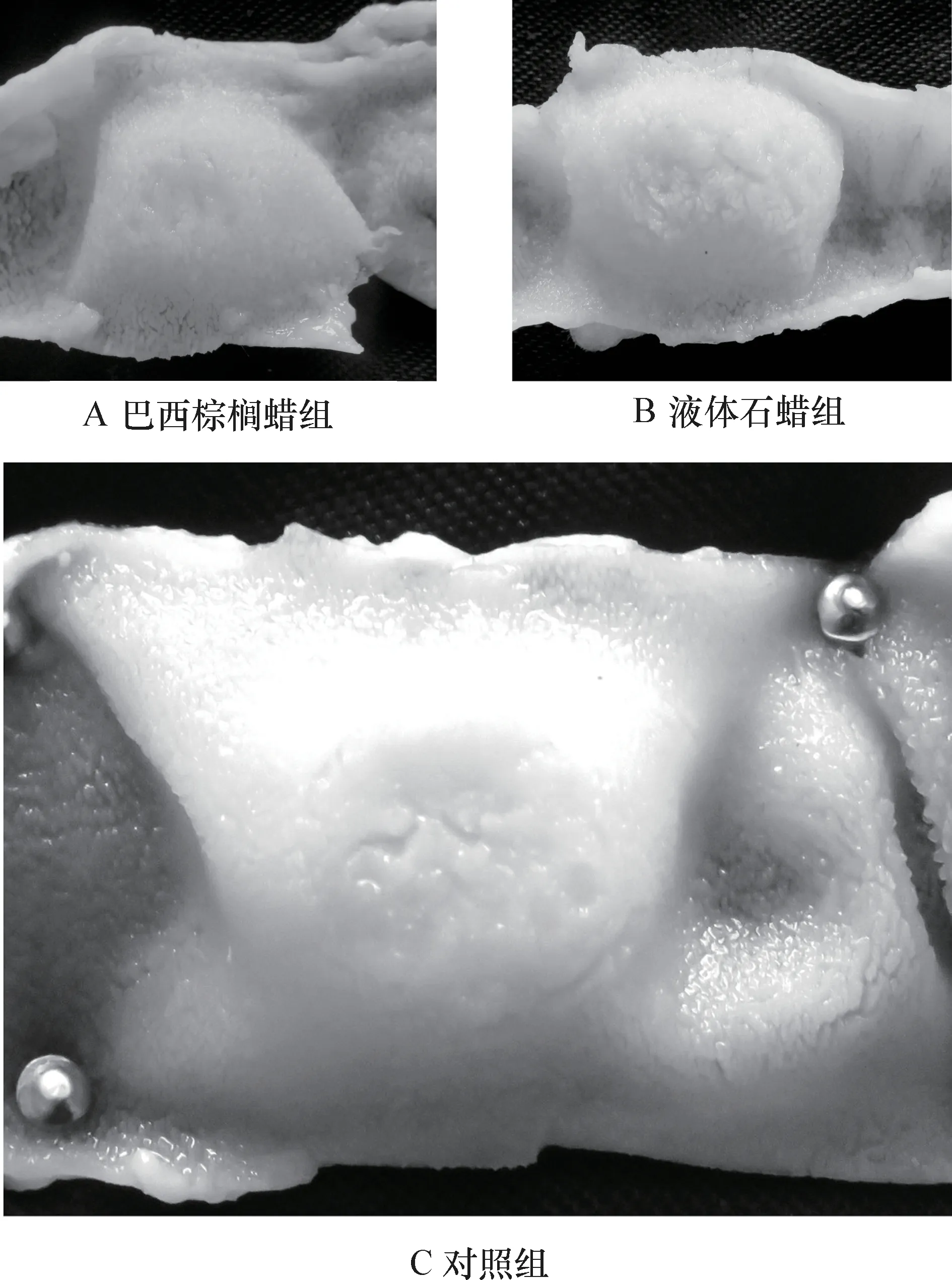
圖2 回腸黏膜表面PP 對比
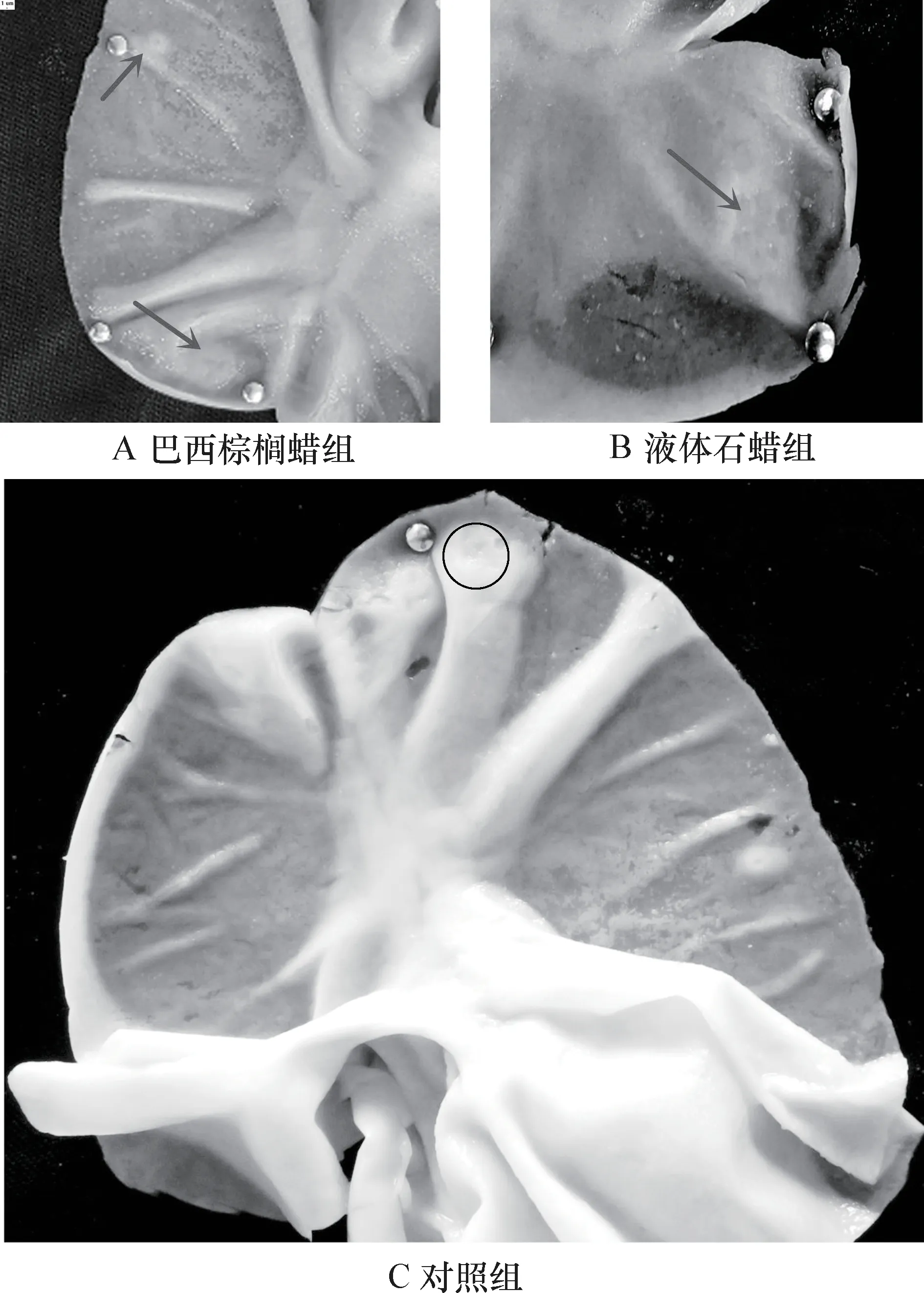
圖3 盲腸黏膜表面PP 對比
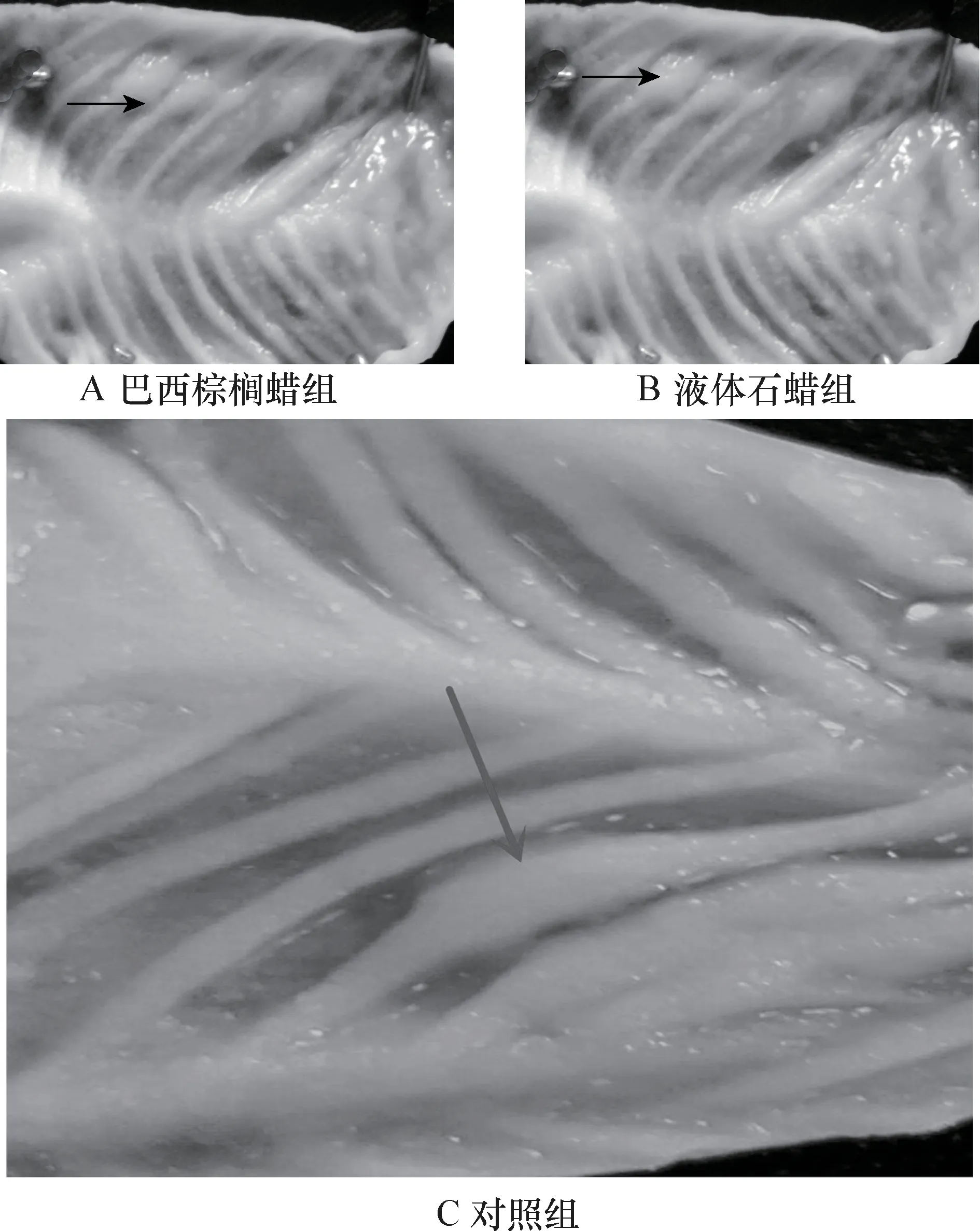
圖4 結腸黏膜表面PP 對比
3.1.2 腸黏膜PP 數量及分布 對試驗組和對照組大白鼠的腸道黏膜表面的PP 進行數量統計,小腸黏膜表面PP 主要分布于空腸和回腸;大腸黏膜表面PP 主要分布于盲腸和結腸。對比試驗組和對照組各腸段PP 數量分布,三組數量分布差異不顯著(P >0.05)。
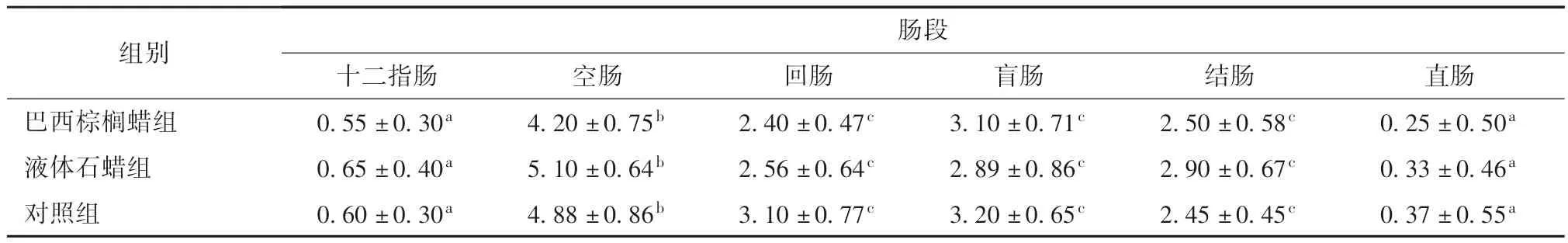
表1 各組腸道各段PP 分布數量分析
3.2 組織學檢查
3.2.1 腸黏膜組織學特征 組織學結果選取了黏膜形成環狀襞、內有密集腸絨毛、腸段最長的空腸,觀察發現試驗組腸黏膜完整性被破壞,腸黏膜部分脫落。 灌胃液體石蠟組較灌胃巴西棕櫚蠟組嚴重,對照組無明顯變化。 結果表明,食品用蠟對腸絨毛有損傷效果。 腸絨毛對比見中插彩版圖5。
3.2.2 腸黏膜表面相關淋巴組織的組織學分布 組織學觀察發現,腸道黏膜淋巴組織主要分布于腸黏膜固有層和黏膜下層,且在鏡下表現為由固有層向下延伸到達黏膜下層,主要以彌散的淋巴組織(Diffuse lymphoid tissue , DLT)、孤立的淋巴小結(ILF)和淋巴集結(ALN)的形式存在。對PP 單位面積內(每10 mm2內)淋巴濾泡數量計數并統計,結果發現,食品用蠟并未刺激腸道黏膜表面相關淋巴組織數量的顯著改變。腸黏膜表面PP 內淋巴濾泡的數量的測定結果見表2。
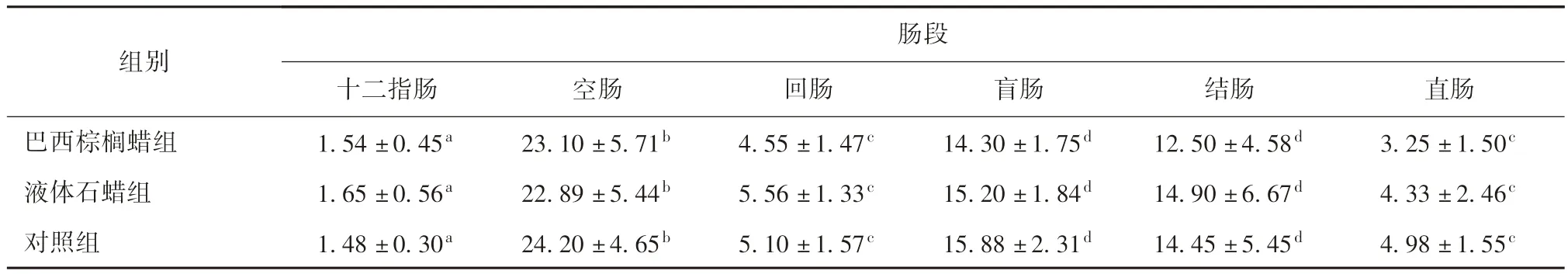
表2 各組腸道各段淋巴濾泡數量分析
3.2.3 腸黏膜表面杯狀細胞的數量 灌胃巴西棕櫚蠟組與對照組對比,杯狀細胞的數量無顯著差異(P >0.05);灌胃液體石蠟的試驗組與對照組對比,杯狀細胞的數量差異顯著(P <0.05),說明液體石蠟的存在使腸道黏膜表面的杯狀細胞數量增加。 腸黏膜表面杯狀細胞的數量的測定結果見表3。空腸懷狀細胞數量對比見中插彩版圖6。
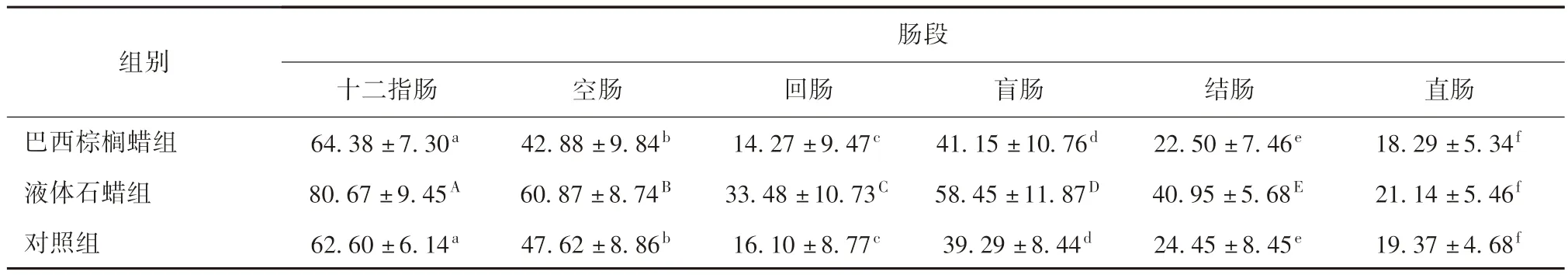
表3 各組腸道各段杯狀細胞數量分析
4 討論
4.1 食品用蠟對大白鼠腸道黏膜的影響 腸道是機體內消化與吸收營養物質的主要場所,食品用蠟被攝入后在腸道存在的時間最長,不同種類的食品用蠟對腸黏膜產生的效果也不相同,巴西棕櫚蠟為植物蠟,液體石蠟為工業蠟,組織學結果顯示,液體石蠟造成腸黏膜絨毛的脫落,其程度高于巴西棕櫚蠟,試驗結果未發現腸黏膜中存在試驗用蠟,從而不能確定腸道對試驗用蠟是否有吸收作用,但可以確定試驗用蠟可以對腸道黏膜造成不同程度的損傷。
杯狀細胞是一種典型的糖蛋白分泌細胞,其分泌的黏蛋白釋入管腔內成為潤滑性黏液涂布于黏膜表面,對腸黏膜表面有保護作用[8]。腸道上皮內杯狀細胞來源于腸腺內杯狀細胞分化,逐步向上遷移至絨毛,最后從絨毛頂端死亡脫落。Grant 等[9]研究發現,大鼠腸道的杯狀細胞位于結腸腺底部的干細胞在向表面遷移的過程中增殖、分化形成,而且在腸腺基底部增生速度最快,但其遷移速度比其他上皮細胞慢得多。結果顯示,液體石蠟可以刺激腸黏膜杯狀細胞數量的增加。原因可能是在大白鼠灌胃液體石蠟后,激活了機體腸道黏膜保護功能,在刺激因子作用下,杯狀細胞增生,細胞分泌功能增強,參與腸道內的石蠟乳糜的清除。杯狀細胞分泌的黏液潤滑了腸道,使得消化道內糞便軟化,從而排除消化道內不能被吸收的石蠟乳糜。而巴西棕櫚蠟對腸黏膜的刺激較小,杯狀細胞的數量變化不明顯。
4.2 食品用蠟對大白鼠腸黏膜相關淋巴組織的影響 通過試驗組和對照組數據的對比,未發現試驗用蠟對腸黏膜相關淋巴組織的形態和數量分布產生明顯的影響。試驗組與對照組腸黏膜表面PP 從十二指腸到直腸,形態結構均未發生明顯變化,與前面腸段相比在直腸的PP 有縮小退化的趨勢,因為直腸位于腸道的后段,消化吸收和免疫功能減弱,淋巴組織逐漸退化。在空腸處PP 為結節狀,在盲腸處為火山口狀,在結腸處為結節狀,火山口狀和結節狀的外觀可以達到既不影響正常的內容物運行,又能起到類似于“陷窩”的效果,在抗原物質沉積到該結構內部后,引起免疫誘導反應[10]。試驗組和對照組腸黏膜表面PP 和淋巴濾泡的數量差異不顯著(P >0.05)。從十二指腸到直腸的整個腸道,PP 和淋巴濾泡的數量分布呈空腸最多,其他腸段次之,這種分布特點是由于大白鼠的腸道內容物從十二指腸起始,根據腸段的長度不同,在各腸段停留時間不同,為了發揮更好的免疫效果,PP 和淋巴濾泡的數量分布也就不相同[11]。
綜上所述,試驗所用食品用蠟對腸道黏膜及其相關淋巴組織產生不同程度的影響,其影響主要表現在對腸黏膜表面絨毛的破壞和引起杯狀細胞數量的增加,但未發現食用蠟對黏膜相關淋巴組織的明顯損傷,在腸道是否引起免疫反應,有待于后續試驗和研究。巴西棕櫚蠟作為植物蠟應用于食品用蠟對腸道的損傷相對于液體石蠟小。試驗研究為進一步研究食品用蠟對動物機體消化與免疫系統的影響提供基礎。為食品用蠟的選擇、限量和食品安全提供了參考。

