營養狀況對中期結腸癌患者圍術期免疫功能的影響*
王 萍,江孟蝶,簡 文,莊 文,何 謙
(四川大學華西醫院,四川 成都 610041)
結腸癌是我國發病率居高不下的惡性腫瘤[1],患者就診時以進展期結腸癌為主[2]。其病因復雜,從免疫學發病機制來看,中晚期結腸癌患者多伴有免疫抑制及免疫功能紊亂,影響疾病進展和預后[3]。T細胞在機體抗腫瘤效應中起重要作用,T細胞亞群檢測是評價機體細胞免疫的重要方法[4]。T細胞的數量和功能發生異常時,宿主免疫能力降低,惡性腫瘤患者機體存在高消耗狀態,導致營養狀況受損并影響免疫功能,有可能增加患者術后恢復不良的風險[5-6]。本研究中對結腸癌患者進行了營養風險篩查及免疫功能檢測,探討了營養狀況對中期結腸癌患者圍術期免疫功能的影響。現報道如下。
1 資料與方法
1.1 一般資料
納入標準:年齡20~65歲;結腸癌確診并需行根治性手術治療,按美國腫瘤研究聯合委員會(AJCC)和國際抗癌聯盟TNM委員會共同制定的標準(2010年,第七版)術后病理分期為Ⅱ~Ⅲ期;營養風險篩查2002(NRS 2002)量表評分為1~5分。本研究經醫院醫學倫理委員會批準,患者簽署知情同意書。
排除標準:急性炎癥期或合并急性腸梗阻;術前合并嚴重心肺功能不全,不能手術。
病例選擇與分組:選取醫院2015年6月至2017年6月收治的結腸癌伴營養風險(NRS2002評分為3~5分)且需行根治性手術治療的30例結腸癌患者作為營養風險組(試驗組),將同期不伴營養風險(NRS 2002評分小于3分)且需行根治性手術治療的30例結腸癌患者作為非營養風險組(對照組)。兩組患者一般資料比較,差異無統計學意義(P>0.05),具有可比性。詳見表1。

表1 兩組患者一般資料比較(n=30)
1.2 方法
兩組患者均接受結腸癌根治術,并行術前臨床分期和術后病理分期,如兩分期不相符,排除后重新收集。
1.3 觀察指標
記錄患者年齡、體質量指數等一般情況。兩組患者均于術前1天和術后第3,7天采集外周空腹靜脈血3 mL,磷酸鹽緩沖液(PBS)稀釋1倍,分離淋巴細胞,PBS洗滌2次,吸取100 μL淋巴細胞懸液,加10 μL單克隆抗體于室溫孵育15 min,再加入1 mL PBS混勻后使用Epics流式細胞儀(美國Beckman Coulter公司)檢測T淋巴細胞總數及 CD4+T細胞、CD8+T細胞、CD45RA+T細胞、CD45RO+T細胞的百分率。觀察并統計兩組患者術后住院期間肺部感染、術后住院天數、肛門首次排氣時間等。
1.4 統計學處理
采用SPSS19.0統計學軟件分析。計量資料以表示,行t檢驗;計數資料以率(%)表示,行 χ2檢驗。P<0.05為差異有統計學意義。
2 結果
結果見表2和表3。
表2 兩組患者T淋巴細胞亞群檢測結果比較(±s,n=30)

表2 兩組患者T淋巴細胞亞群檢測結果比較(±s,n=30)
注:與對照組同時點比較,*P<0.05;與本組術后3 d比較,△P<0.05。
指標 術前1 d 術后3 d 術后7 d CD3+(% )CD4+(% )CD8+(% )CD4+/CD8+CD45RA+(% )CD45RO+(% )試驗組60.5±7.2 33.2±6.2 23.7±4.6 1.4±0.8 36.8±7.2 48.2±9.4對照組61.4±8.3 34.2±7.3 24.5±4.7 1.3±0.5 37.6±7.8 47.3±7.5試驗組52.6±5.5*26.5±6.8*22.8±4.3 1.0±0.6*32.8±6.8*46.2±9.5對照組58.1±7.3 29.6±6.7 24.1±5.2 1.3±0.8 37.4±7.6 45.4±8.7試驗組57.4±5.7△30.4±5.8△22.3±4.5 1.3±0.7△33.6±7.4△47.6±9.4對照組61.2±7.2 33.2±6.6 22.7±4.3 1.5±0.4 37.2±7.6 46.12±8.9
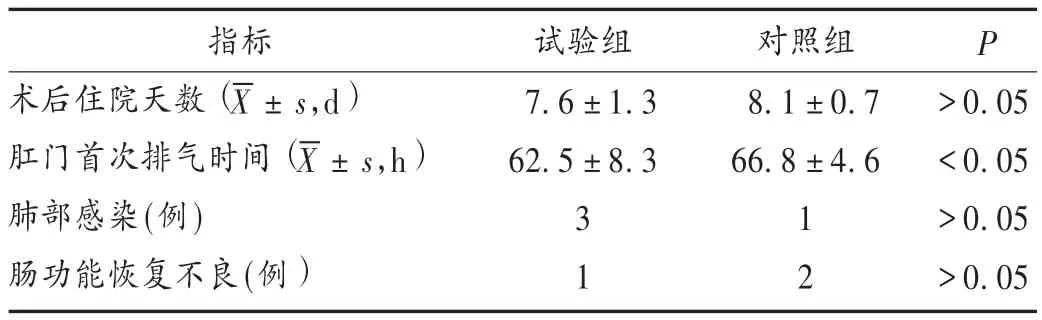
表3 兩組患者術后康復情況比較(n=30)
3 討論
機體良好的營養狀態是免疫功能正常發揮的重要基礎,對于維持和調節T淋巴細胞的免疫功能及機體受損免疫功能的恢復十分重要[7]。結腸癌伴營養風險的發生率明顯高于其他部位的惡性腫瘤。但臨床往往更關注胃癌患者的營養風險,而容易忽視結腸癌患者也有較高的營養風險。
T淋巴細胞是機體免疫系統內抗腫瘤免疫最重要的細胞免疫亞群,主要由輔助性及抑制性T淋巴細胞組成,對腫瘤增殖有重要抑制作用,也是衡量人體免疫功能的重要指標[8-9]。其中CD4+在腫瘤免疫中具有免疫記憶和直接殺傷腫瘤細胞的作用,CD8+為抑制性T淋巴細胞,具有抑制細胞免疫的作用,兩者共同參與機體免疫應答及宿主對機體內腫瘤組織的抵抗[10]。惡性腫瘤患者多存在機體免疫功能紊亂,T淋巴細胞亞群的數量和功能變化可間接反映機體細胞免疫功能狀態。CD4+/CD8+平衡一旦被破壞,將導致機體免疫反應紊亂,影響抗腫瘤作用的發揮[11]。
本研究結果顯示,伴有營養風險的Ⅱ~Ⅲ期結腸癌患者,其細胞免疫功能整體下降明顯,具體表現在CD3+,CD4+,CD4+/CD8+下降,這對早期篩查并及時營養干預有重要參考意義。CD3+,CD4+,CD4+/CD8+水平與結腸癌分期呈正相關,進展期結腸癌較早期結腸癌顯著降低。術后第3天,兩組即有顯著差異,這可能是因為營養狀態受損的機體在腫瘤負荷狀態下,腫瘤細胞產生了多種免疫抑制因子,抑制了CD4+細胞功能,而良好的營養狀態有利于T淋巴細胞整體功能及術后功能的快速恢復。
成熟的T細胞在未接收到抗原刺激時稱為初始T細胞(CD45RA+T細胞),接受抗原刺激后,一部分發育為殺傷性T細胞而發揮免疫殺傷作用,一部分發育為記憶 T 細胞(CD45RO+T 細胞)[12]。CD45RA+細胞和CD45RO+細胞的數量和比例需保持在一定范圍內,機體的細胞免疫功能才能處于平衡狀態[13]。本研究結果顯示,機體在腫瘤負荷和營養風險狀態下,CD45RA+T細胞明顯減少,與對照組相比,術后第3天試驗組患者CD45RA+T細胞明顯少于對照組。這可能是由于腫瘤細胞的存在,CD45RA+T細胞接受腫瘤抗原刺激后向CD45RO+T細胞轉化增多或補充不足所致[14]。
綜上所述,機體的免疫功能在一定程度上反映腫瘤患者機體的免疫功能狀態和腫瘤發生、發展的情況。良好的營養狀況可改善患者的免疫抑制狀態,維持T淋巴細胞的穩態,并提供患者術后免疫功能恢復的基礎。同時,T淋巴細胞的檢測對于分析該類患者的免疫狀態、腫瘤的發生和發展及療效判斷也有一定的參考意義。

