miR-98-5p與靶基因HMGA2相關調控機制抑制喉鱗癌的作用及臨床意義
張曉瑩 吳鋒
(江蘇省南通市第二人民醫院耳鼻咽喉科 南通 226002)
喉鱗癌是常見的頭頸部惡性腫瘤之一,惡性程度高,易出現轉移和復發。喉鱗癌的發病機制目前尚不明確,多數研究[1-4]認為惡性腫瘤的發生、發展是一個多因素、多基因、多步驟的復雜過程。非組蛋白染色體蛋白HMGA2在多種腫瘤中都呈現較高的表達水平,是新癌基因之一,在多種腫瘤的發生、侵襲和轉移過程中都有著調控功能。近年來關于高遷移率族蛋白HMGA2在腫瘤中的研究越來越多,其最早在胚胎組織中被發現,而在成熟分化的組織中幾乎檢測不到,但在許多惡性腫瘤中卻可以檢測出來。HMGA2雖然分子量小,卻可以作為“構筑轉錄因子”參與多種基因的調控表達,進而通過多條分子通路參與細胞的增殖、分化、侵襲與轉移,被認為具有癌基因的特征。因此,許多研究都認為HMGA2在喉鱗癌發生過程中起重要作用,可能成為喉鱗癌的治療靶點[5-6]。眾多研究也同時顯示,miRNAs在調控喉鱗癌發生、轉移的信號通路中也有至關重要的作用,并具有成為喉鱗癌診斷指標及治療靶點的潛力。本實驗研究miR-98-5p通過靶向調控HMGA2在喉鱗癌中的相關作用及意義,為診斷及治療喉鱗癌提供新的研究方向。
1 材料與方法
1.1 標本采集 本研究中納入120例喉鱗癌患者,均于2016年 1月~2017年12月在本科接受全喉或部分喉切除手術。患者之前均未經任何治療,平均年齡為(49.81±7.57)歲。喉鱗癌組織和癌旁組織(距癌組織邊緣2 cm內區域)在5 min內被切除,立即投入液氮內,并長期保存在-80 ℃冰箱。
1.2 外周血采集 針對納入研究的喉鱗癌患者,均于清晨空腹狀況下抽取外周靜脈血。具體操作如下:采用一次性血清分離膠管,抽取外周靜脈血約3 mL;待血清析出后以1 000 g離心10 min,取上層血清保存至-80 ℃冰箱待檢測。
1.3 定量反轉錄聚合酶鏈反應(qRT-PCR)檢測外周血miR-98-5p和HMGA2的表達 取0.5 mL血清標本,采用Trizol 法提取血清總RNA。實驗步驟按照Trizol試劑盒說明書中步驟進行。將提取到的總RNA按照反轉錄試劑盒的說明書進行RNA反轉錄,合成cDNA。按照qRT-PCR 試劑盒說明書進行PCR:采用50 μL反應體系,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 45 s,72 ℃ 2 min, 共40個循環。miR-98-5p計算采用U6作為內參,HMGA2采用GAPDH作為內參。
1.4 細胞培養和轉染
1.4.1 細胞培養 Hep-2細胞以含10%胎牛血清的培養基在37 ℃、5% CO2的培養箱中常規培養,再用2.5% 的胰蛋白酶每2 d進行消化,傳代,并取對數生長期細胞用于實驗。
1.4.2 細胞轉染 取對數生長期Hep-2細胞(1~1.5)×106個分板,接種于6孔板中,置于37 ℃、5% CO2的培養箱中培養至細胞密度60%~70%之后,再將細胞分為2組:miRNA對照轉染組以及miR-23過表達的miRNA轉染組,并將培養基換成每孔1 mL無血清無雙抗的培養基;miRNA及轉染試劑Lipofectamine 2000分別用100 μL OMEM稀釋后,依照說明書所需比例混勻后靜置20 min,逐滴加入并且輕晃混勻, 培養6 h后;再換為含完全培養基,待48 h后收集細胞進行下一步分析。
1.5 熒光素酶報告基因法檢測miR-98-5p與靶基因HMGA2的結合 構建HMGA2野生型3′-UTR熒光素酶報告基因質粒pMIR-HMGA2-wt,并以pMIR-HMGA2-wt質粒為模板,利用PCR搭橋法(overlapping PCR)構建其潛在結合位點突變型報告基因質粒pMIR-HMGA2-Mut。將miR-98-5p mimics、陰性對照組miRNA mimics(miR-NC)內參海腎熒光素酶以及pMIR-HMGA2-wt和pMIR-HMGA2-Mut報告基因質粒共轉染進Hep-2細胞中,在細胞培養箱中培養36 h后收取細胞液,使用雙熒光素酶報告基因試劑盒測定熒光素酶活性。
1.6 Western印跡 采用含50 mmol/L Tris-HCl (pH=7.4)、150 mmol/L NaCl、0.5%脫氧膽酸鈉、0.1% 十二烷基硫酸鈉(SDS)和蛋白酶抑制劑及1 mmol/L苯甲基磺酰氟的RIPA裂解液分離蛋白質,通過SDS-PAGE凝膠進行電泳,按說明書進行Western印跡實驗。
1.7 CCK8檢測細胞增殖 制備單細胞懸液:收集對數生長期的Hep-2細胞,以1×105/mL 接種于96孔培養板,每孔培養基200 μL。經過12 h后,分別用miR-NC和miR-98-5p轉染Hep-2細胞,每組6個復孔。在37 ℃條件下培養,經過48 h后每孔加入200 μL CCK-8 再持續培養2 h。使用酶標儀檢測各孔在450 nm處吸光度(optical density,OD)值。
1.8 流式細胞法檢測細胞周期 懸浮并收集不同時間點細胞,生理鹽水沖洗細胞2遍,70%乙醇固定細胞。加入碘化丙啶DNA熒光染色(propidium iodide,PI:50 mg/L,1% Triton X-100),4 ℃冰箱避光染色30 min,銅網過濾,使樣本成為合格的單細胞懸液,流式細胞儀檢測細胞周期。
1.9 鱗癌Hep-2細胞懸液制備 取對數生長期 Hep-2細胞,胰酶消化成單個細胞,RMPI-1640液洗滌,吹打成懸液,用磷酸鹽緩沖液(phosphate buffered saline,PBS)調整細胞數至 1×109備用。
1.10 構建裸鼠喉鱗癌皮下移植模型 在裸鼠右肩胛近腋窩處皮下接種喉鱗癌Hep-2細胞懸液0.2 mL,觀察接種部位液體吸收、腫瘤生長過程及裸鼠狀況。
1.11 統計學處理 采用SPSS 22.0統計軟件進行t檢驗和χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 miR-98-5p在喉鱗癌患者細胞中的表達 qRT-PCR檢測喉鱗癌組織和癌旁正常組織中miR-98-5p的表達水平,結果顯示,相比癌旁正常組織,喉鱗癌組織中miR-98-5p的表達水平明顯降低,差異具有統計學意義(P<0.01,圖1A);同時發現,出現轉移的喉鱗癌組織中miR-98-5p的表達水平明顯低于無轉移的腫瘤組織(圖1B)。結果顯示,miR-98-5p可能對喉鱗癌存在一定的調控作用。

圖1. miR-98-5p在喉鱗癌患者細胞中的表達 A.喉癌組織與癌旁正常組織比較;B.有轉移和無轉移組比較;*示P<0.01;**示P<0.05
2.2 臨床特征 對納入研究的喉癌患者組織進行檢測,結果顯示喉鱗癌組織中miR-98-5p的平均表達水平為0.69±0.17。以均數0.69為分界值,表達量≥0.69為miR-98-5p高表達,表達量<0.69為miR-98-5p低表達。將miR-98-5p的表達高低與患者臨床特征進行相關性分析,結果顯示,miR-98-5p與年齡、性別無明顯相關性(P>0.05)。miR-98-5p高表達患者的癌組織分化程度及臨床分期較低(P<0.05),無淋巴結轉移患者中miR-98-5p的表達水平明顯高于有淋巴結轉移患者(P<0.01,表1)。
2.3 miR-98-5p通過結合HMGA2的 3′-UTR來抑制HMGA2的表達 對microRNA靶基因數據庫進行篩選,預測HMGA2為miR-98-5p的潛在靶基因(圖2A)。構建了HMGA2野生型3′-UTR熒光素酶報告基因質粒pMIR-HMGA2-wt及突變型報告基因質粒pMIR-HMGA2-Mut。將miR-98-5pmimics,miR-NC、內參海腎熒光素酶以及pMIR-HMGA2-wt和pMIR-HMGA2-Mut報告基因質粒共轉染進Hep-2細胞中,雙熒光素酶檢測結果顯示,miR-98-5pmimics可明顯抑制pMIR-HMGA2-wt質粒熒光素酶活性;而對pMIR-HMGA2-Mut熒光素酶活性無明顯影響(圖2B)。表明miR-98-5p可以通過結合HMGA2的3′-UTR而抑制HMGA2的表達。為進一步驗證miR-98-5p對HMGA2的調控作用,通過qRT-PCR檢測發現,miR-98-5pmimics轉染組中HMGA2的mRNA表達水平明顯低于對照組(圖2C),并且Western印跡檢測結果顯示,相比對照組,miR-98-5pmimics轉染組中HMGA2表達量明顯降低(圖2D)。上述結果表明,miR-98-5p能夠抑制HMGA2的mRNA翻譯及其蛋白表達。
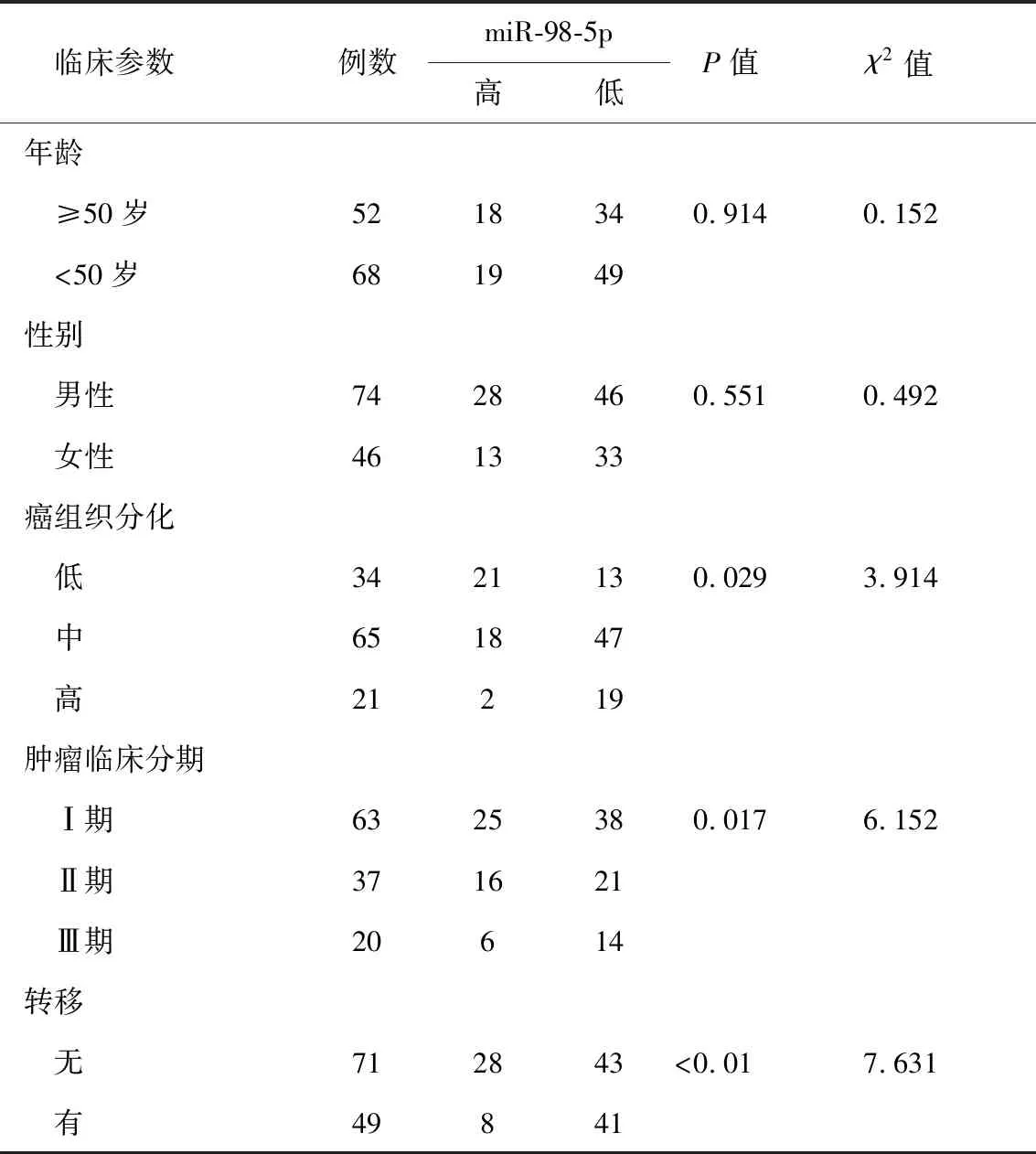
表1 miR-98-5p的表達水平與喉鱗癌患者臨床特征的相關性(n)
2.4HMGA2在喉鱗癌組織中mRNA的表達水平 qRT-PCR檢測結果顯示,喉鱗癌組織相比癌旁正常組織,HMGA2的mRNA表達量明顯升高(圖3)。
2.5 miR-98-5p和HMGA2與細胞增殖及周期的相關性 將miR-NC, miR-98-5pmimics和HMGA2轉染進Hep-2細胞,采用CCK8實驗檢測對照組、miR-98-5pmimics轉染組和miR-98-5pmimics+HMGA2轉染組發現,miR-98-5pmimics轉染組的OD值明顯低于對照組,而miR-98-5pmimics+HMGA2轉染組的OD值明顯高于miR-98-5pmimics轉染組(圖4A)。流式細胞法檢測結果顯示,miR-98-5pmimics轉染組S期細胞比值明顯低于對照組,而miR-98-5pmimics+HMGA2轉染組S期細胞比值明顯高于miR-98-5pmimics轉染組(圖4B)。以上結果表明,miR-98-5p可抑制喉鱗癌細胞Hep-2的增殖和細胞周期在S期聚集,而這些抑制效果可被HMGA2補回。

圖2. HMGA2是miR-98-5p的靶基因 *示P<0.01
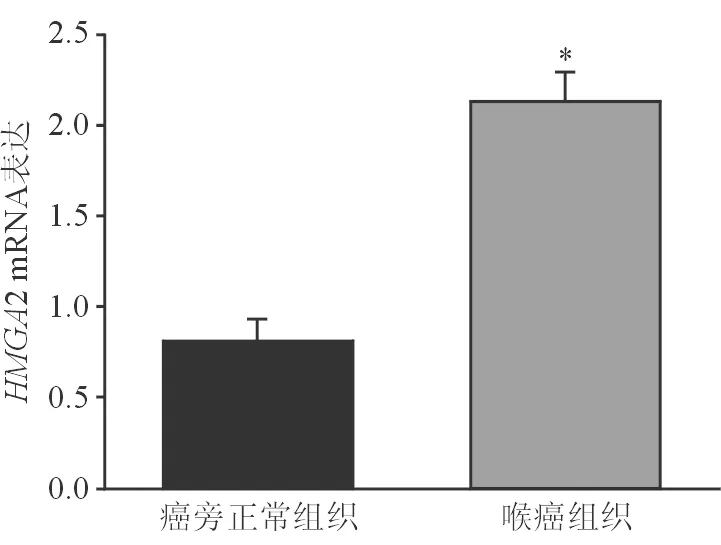
圖3. 靶基因HMGA2的mRNA的表達水平 *示P<0.01
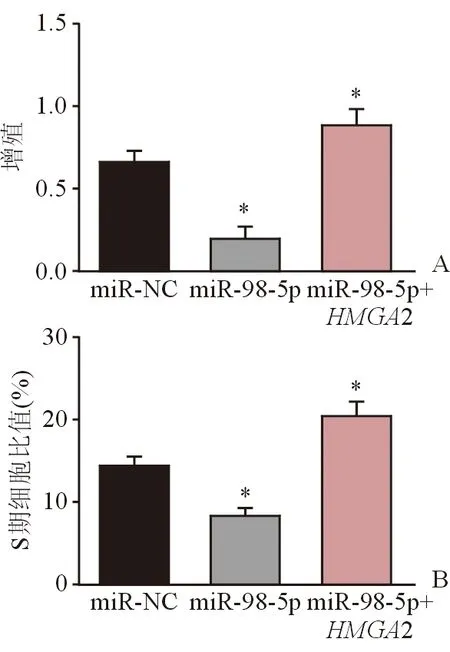
圖4. miR-98-5p和HMGA2對細胞增殖及周期的調控作用*示P<0.01
2.6 miR-98-5p抑制裸鼠體內腫瘤生長 21 d后發現,miR-98-5pmimics轉染組裸鼠腫瘤體積及重量均明顯低于對照組(圖5A、B),并且miR-98-5p在miR-98-5pmimics轉染組小鼠腫瘤組織中的表達水平明顯高于對照組(圖5C),表明在裸鼠體內,miR-98-5p過表達能夠抑制Hep-2細胞的增殖,抑制腫瘤的生長。
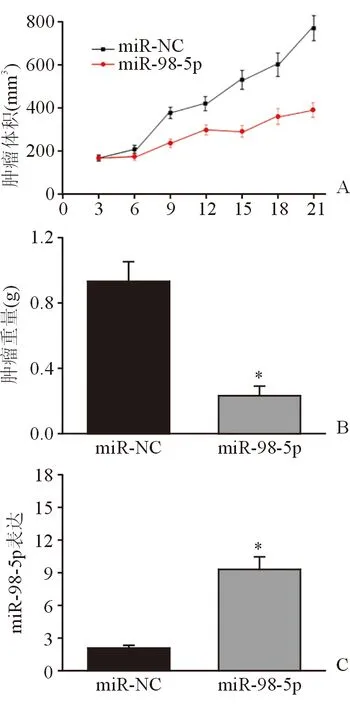
圖5. miR-98-5p抑制裸鼠體內腫瘤生長 *示P<0.01
3 討論
目前喉鱗癌患者確診時已發展至Ⅲ~Ⅳ期者占40%,因此喉鱗癌的早期診斷與治療顯得尤為重要,然而目前為止還未發現能早期預測喉鱗癌的分子標志物[7-9]。 miRNA是一段大約由19~25個核苷酸組成的非編碼小RNA,通過對其靶 mRNA的翻譯抑制或者降解在動、植物體內發揮重要的調節作用。miRNA按照其在腫瘤發生、發展中的調控作用可分為致癌miRNA和抑癌miRNA,調控癌細胞的增殖、侵襲、凋亡及血管生成情況[10]。
本研究采用qRT-PCR檢測喉鱗癌[11-13]組織和癌旁正常組織中miR-98-5p的表達水平,發現相比癌旁正常組織,喉鱗癌組織中miR-98-5p的表達水平明顯降低。在構建裸鼠喉鱗癌皮下移植模型中,證明miR-98-5p在miR-98-5pmimics轉染組裸鼠腫瘤組織中的表達水平明顯高于對照組,因此表明miR-98-5p對喉鱗癌有調控作用。
有研究[14]報道,通過雙向電泳在柯斯頓鼠肉瘤病毒(KiMSV)轉化鼠甲狀腺細胞株(FRTL5)中發現HMGA2與腫瘤表現型之間的聯系,當時在細胞轉化后共發現3種磷酸化的核蛋白質,標記為C、D、E,分別對應現在所指的HMGA2,HMGAla和HMGAlb。Berlingieri等[15]通過進一步的研究發現,以上這些磷酸化的蛋白質在反轉錄病毒轉染的無完全惡性表型的鼠甲狀腺細胞株中不表達,在有完全惡性表型的細胞株中則持續表達。Rice等[16]進一步證明了HMGA2的致癌活性。他們發現HMGA2表達增高的細胞系呈現出不依賴支持物生長的特性,而且在注入裸鼠體內后出現遠處轉移。
在本研究中,我們通過microRNA靶基因數據庫進行篩選,預測HMGA2為miR-98-5p的潛在靶基因,使用雙熒光素酶檢測發現miR-98-5p可以通過結合HMGA2的3′-UTR[17-18]進而抑制HMGA2的表達。通過qRT-PCR和Western印跡確定miR-98-5p可以抑制HMGA2的mRNA和蛋白表達水平,更加驗證了miR-98-5p對HMGA2的靶向調控作用。同時qRT-PCR檢測結果也顯示喉鱗癌組織相比癌旁正常組織,HMGA2的mRNA表達量明顯升高,因此說明HMGA2對喉鱗癌具有調控功能。然后采用CCK8實驗檢測對照組、miR-98-5pmimics轉染組和miR-98-5pmimics+HMGA2轉染組發現,miR-98-5pmimics轉染組的OD值明顯低于對照組,而miR-98-5pmimics+HMGA2轉染組的OD值明顯高于miR-98-5pmimics轉染組。同時流式細胞法檢測結果顯示,miR-98-5pmimics轉染組S期細胞比值明顯低于對照組,而miR-98-5pmimics+HMGA2轉染組S期細胞比值明顯高于miR-98-5pmimics轉染組。結果表明,miR-98-5p可抑制喉鱗癌Hep-2細胞的增殖和細胞周期在S期聚集,而這些抑制效果可被HMGA2補回。在裸鼠喉鱗癌皮下移植模型實驗中,我們發現miR-98-5pmimics轉染組裸鼠腫瘤體積及重量均明顯低于對照組,并且miR-98-5p在miR-98-5pmimics轉染組裸鼠喉鱗癌組織中的表達水平明顯高于對照組。通過本次研究,預示miR-98-5p能夠通過抑制HMAG2的表達抑制喉鱗癌。
綜上所述,miR-98-5p可抑制喉鱗癌Hep-2細胞的增殖和細胞周期在S期聚集,而這些抑制效果可被HMAG2補回,并且miR-98-5p能夠抑制HMAG2的表達水平并抑制喉鱗癌細胞的增殖,對喉鱗癌有抑制效果。此外,本研究納入150例患者中女性74例,考慮既往文獻報道喉癌女性發病率遠低于男性,因此本研究尚存在研究樣本量不足而產生偏倚的可能,多中心大樣本的臨床研究對本研究結論的驗證是必要的。本研究結果顯示,miR-98-5p可以結合HMAG2的3′-UTR并抑制HMAG2的表達,抑制喉鱗癌的發展。miR-98-5p可能成為喉鱗癌診斷及治療的新靶點,為診斷及治療喉鱗癌提供新的研究價值和臨床導向。

