PKA抑制劑在雌激素調控乳腺癌細胞纖連蛋白表達中的作用及機制*
王宏健, 劉曉紅, 董宇華, 郭陽, 王旭東
(貴州醫科大學 基礎醫學院 生理學教研室, 貴州 貴陽 550025)
calpain 2乳腺癌是女性常見的惡性腫瘤,其中約70%為雌激素(Estrogen, E2)依賴性[1]。E2不僅在女性生殖系統和乳腺生長發育等生理功能調節中發揮重要作用,在異常情況下,E2也是促進乳腺癌惡性進展的重要因素[2-4]。E2可以使乳腺癌細胞內環磷酸腺苷(cyclic adenosine monophosphate, cAMP)增多,從而激活蛋白激酶A(protein kinase A,PKA),激活的cAMP/ PKA途徑可抑制乳腺癌細胞的遷移[5-8]。有研究顯示,纖連蛋白(fibronectin, FN)的表達促進乳腺癌細胞的惡性行為[9],其機制尚未完全闡明。鈣激活中性蛋白酶(calcium-activated neutral protease,CANP)屬于Ca2+依賴性的半胱氨酸蛋白酶水解家族,據報道其活性在乳腺癌異常增高[10]。然而,關于PKA是否通過CANP參與調控E2信號分子機制,目前尚未完全闡明。本研究以MCF-7細胞和CANP2-shRNA轉染細胞為模型細胞,采用傷口愈合實驗和蛋白免疫印跡實驗等方法,觀察PKA抑制劑對E2誘導乳腺癌細胞的遷移和FN蛋白表達的影響,同時觀察其與CANP的關系,為研究E2促進乳腺癌惡性進展的機制提供理論依據。
1 材料和方法
1.1 材料
1.1.1細胞系及試劑 人乳腺癌細胞系MCF-7購自中國科學院昆明細胞庫,DMEM培養基、胰蛋白酶及青霉素/鏈霉素均購自美國HyClone公司,胎牛血清(fetal bovine serum,FBS) 購自Gibco公司。
1.1.2抗體及重要試劑17β-雌二醇(17β-estradiol,E2) 購于Sigma公司、H89(PKA抑制劑)購自碧云天生物技術公司,抗FN、calpain2單克隆抗體,抗GAPDH抗體由Santa cruz公司購買,羊抗小鼠IgG-HRP抗體購自武漢博士德公司,CANP2-shRNA設計、合成和構建由上海吉瑪制藥有限公司提供。
1.2 人乳腺癌MCF-7細胞
1.2.1細胞培養 人乳腺癌細胞MCF-7采用DMEM高糖培養基(含10% FBS、1%青霉素及1%鏈霉素),在37 ℃及5%CO2條件下常規培養,待細胞滿度達90%時進行傳代培養。
1.2.2細胞劃痕實驗 取對數生長期MCF-7細胞混懸液按每孔1 mL接種于12孔培養板中,細胞覆蓋率達90%后,換成無血清DMEM,用10 μL槍頭作“|”字劃痕,用無菌PBS洗滌3次,換無血清的DMEM,隨機分為4組,分別加入0.1% DMSO(對照組)、10 nmol/L(E2組)、10 mg/L(H89組)、10 nmol/L E2+10 mg/L H89(E2+H89聯合組)處理,置于培養箱內培養。分別于0 、12及24 h時用倒置顯微鏡下拍照。每孔隨機取3個位點,用Photoshop軟件標尺測量劃痕寬度,測算細胞劃痕部位“傷口”寬度,實驗重復3次。計算細胞遷移率=[(0 h傷口寬度-12或24 h傷口寬度)/0 h傷口寬度]×100%。
1.2.3Western blot檢測FN蛋白表達 培養MCF-7細胞滿度達50%~60%后,將培養基換為無血清DMEM,同時將細胞分為對照組(0.1%DMSO)、E2組(10 nmol/L E2)、H89組(10 mg/L)及E2+ H89組(10 nmol/L E2+10mg/L H89)。藥物作用48 h后,加入RIPA裂解液裂解細胞。4 ℃,12 000 r/min離心20 min后取樣品上清液留用,采用BCA法進行蛋白定量。每個泳道按30 μg蛋白質樣品進行上樣,按照Western blot實驗,采用自動凝膠成像系統(Syngene公司)成像,GeneSnap軟件分析蛋白印跡結果。
1.3 CANP2-shRNA轉染人乳腺癌MCF-7細胞
1.3.1CANP2-shRNA轉染MCF-7細胞與穩定表達細胞株的篩選 按照說明書要求進行CANP2-shRNA轉染并且篩選出穩定表達的細胞株,待細胞達到檢測所需滿度時,使用熒光顯微鏡觀察并且通過Western blot檢測轉染效率,獲得穩定表達的細胞株后繼續在CO2培養箱中37 ℃溫育24~48 h后,用嘌呤霉素處理篩選出穩定表達的細胞株。同時轉染與CANP2無同源性的序列作為陰性對照組(NC組)。
1.3.2細胞劃痕實驗 取對數生長期CANP2-shRNA穩定表達細胞株的MCF-7細胞株和NC(negative control)細胞按每孔1 mL接種于12孔培養板中,細胞覆蓋率達90%后,換成無血清DMEM,用10 μL槍頭作“|”字劃痕,用無菌PBS洗滌3次,換無血清的DMEM,均隨機分為4組,分別為對照組、E2組、H89組及E2與H89聯合組,其余處理同1.2.2。
1.3.3Western blot檢測FN蛋白表達 培養的CANP2-shRNA穩定表達細胞株MCF-7細胞和NC細胞覆蓋率達50%~60%后,將培養基換為無血清DMEM,同時將細胞分為對照組(0.1% DMSO)、E2組(10 nmol/L E2)、H89組(10 mg/L)及E2+ H89組(10 nmol/L E2+10 mg/L H89),其余處理同1.2.3。
1.4 統計學處理
采用軟件prism 6.2處理和分析數據,實驗結果以均數±標準差表示。組間比較采用單因素方法one-way ANOVA進行分析,P<0.05表示差異有統計學意義。
2 結果
2.1 H89對人乳腺癌MCF-7細胞的作用
2.1.1H89增強E2誘導的人乳腺癌MCF-7細胞遷移效應 與對照組比較,E2可明顯增加MCF-7細胞的12 h和24 h時的遷移率,分別增加(14.30±0.62)%和(28.74±3.89)%,差異有統計學意義(P<0.05)。H89組MCF-7細胞24 h時,可促進MCF-7細胞的遷移,與對照組比較,遷移率增加了(20.41±1.46)%,差異有統計學意義(P<0.05)。H89與E2組MCF-7細胞作用24 h后,細胞的遷移率增加了(31.71±2.13)% 。與E2組比較,H89與E2聯合作用后,MCF-7細胞的12 h和24 h的遷移率均明顯增加,差異有統計學意義(P<0.05)。見圖1。
2.1.2H89增加E2誘導的MCF-7細胞FN蛋白表達 與對照組比較,E2組FN蛋白表達增加(121.9±9.342)%;H89 FN蛋白的表達增加(115.4±8.89)%,差異有統計學意義(P<0.01);與E2組比較,H89+E2組MCF-7細胞FN蛋白表達增加(105.9±15.9)%,差異有統計學意義(P<0.01)。見圖2。
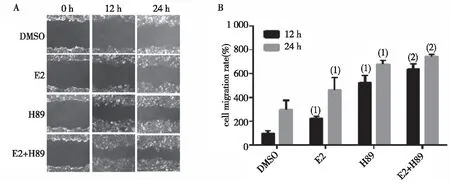
(1)與對照組比較, P<0.05 ;(2)與E2組比較, P<0.05圖1 H89對E2誘導的MCF-7細胞遷移的影響Fig.1 Effect of H89 on E2-induced migration of MCF-7 cells
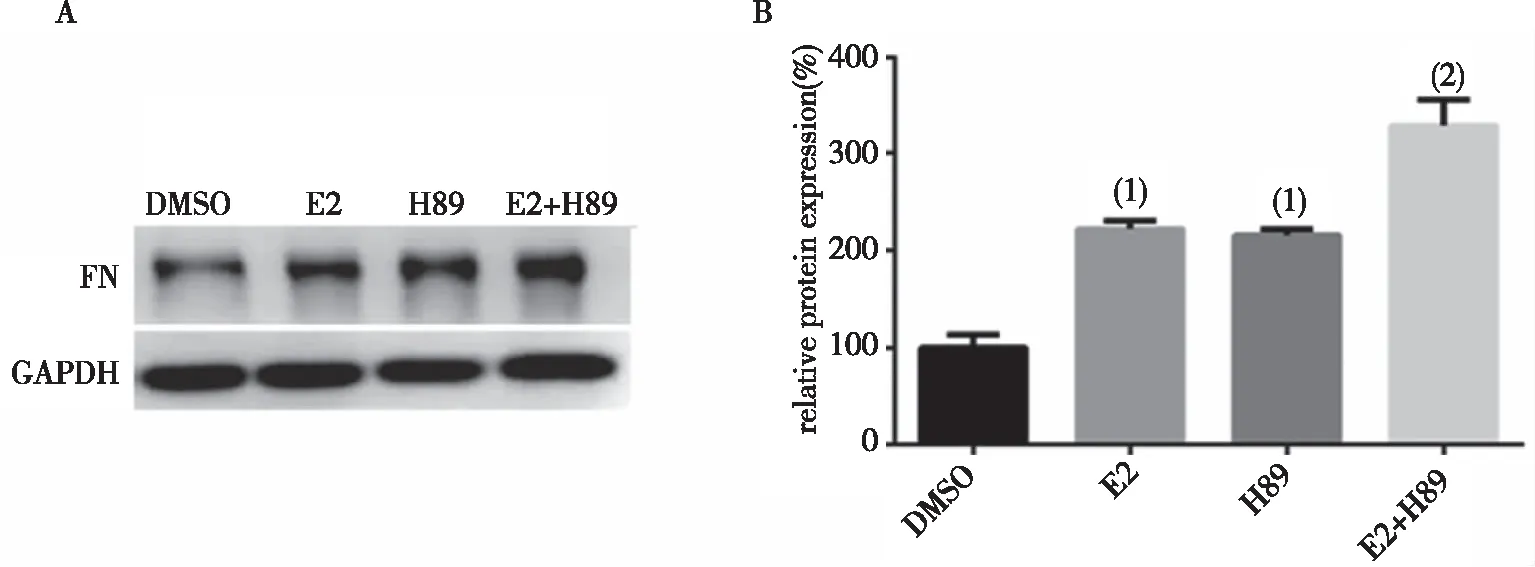
(1)與對照組比較, P<0.01;(2)與E2組比較,P<0.01圖2 H89對MCF-7細胞纖連蛋白表達的影響Fig.2 Effect of H89 treatment on the expression of FN in MCF-7
2.2 H89對CANP2-shRNA轉染MCF-7細胞的作用
2.2.1CANP2-shRNA轉染后MCF-7細胞中CANP2蛋白表達 與NC組比較,CANP2-shRNA轉染MCF-7乳腺癌細胞組CANP2蛋白表達量降低了(88.47±7.07)%,差異有統計學意義(P<0.01),見圖3。結果提示沉默CANP2基因后,篩選的穩定表達細胞株滿足實驗要求。
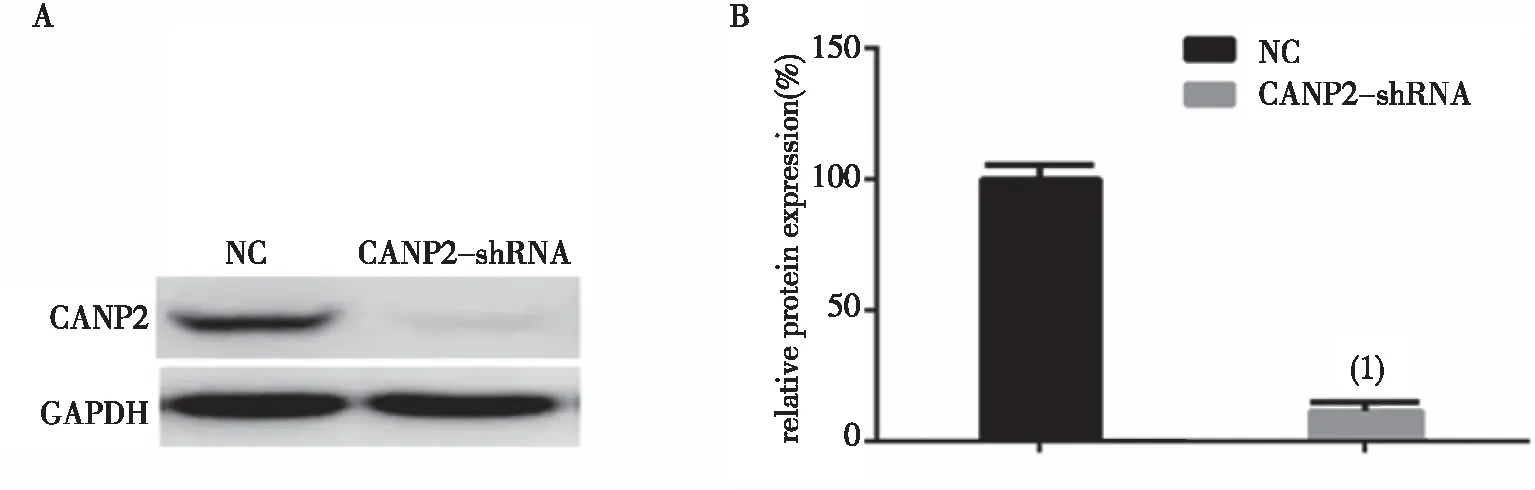
(1)與對照組比較 , P<0.01圖3 CANP2-shRNA轉染MCF-7細胞CANP2蛋白的表達Fig.3 Expression of CANP2 protein in CANP2-shRNA transfected cells
2.2.2CANP2-shRNA轉染MCF-7細胞中,H89的促細胞遷移效應 H89組明顯降低CANP2-shRNA轉染MCF-7細胞的遷移率,見圖4A;與NC組比較,H89組CANP2-shRNA轉染MCF-7細胞遷移率24 h和48 h時分別降低了(66.67±9.67)%和(123.04±20.54)%,差異有統計學意義(P<0.01),見圖4B。基因沉默CANP2后,與NC組比較,E2+H89聯合組CANP2-shRNA轉染MCF-7細胞的遷移率顯著降低,差異有統計學意義(P<0.01),見圖4C。E2+H89組細胞遷移率24和48 h的細胞遷移率分別降低(78.12±6.12)%和(115.35±12.09)%,見圖4D。
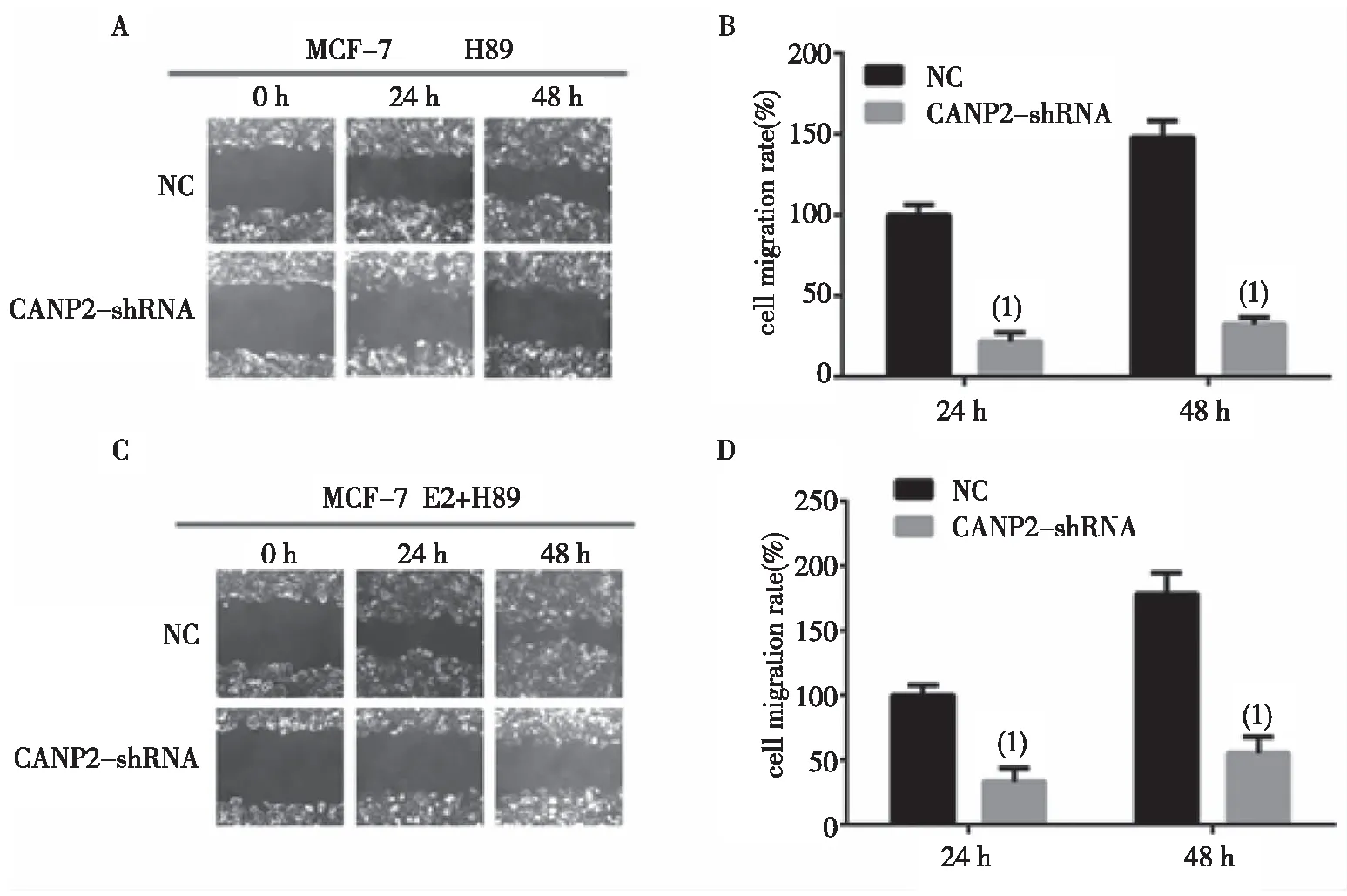
(1)與對照組比較 , P<0.01圖4 基因沉默CANP2逆轉H89的促細胞遷移的影響Fig.4 Transfection of shRNA CANP2 reversing the effect of H89 on cell migration
2.2.3H89抑制CANP2-shRNA轉染MCF-7細胞中FN蛋白表達 H89單獨作用于CANP2-shRNA轉染MCF-7細胞,與NC組比較,FN蛋白的表達明顯減少,相對蛋白表達量減少(60.52±4.99)% ,差異有統計學意義(P<0.01);H89與E2聯合使用時,與NC組比較,CANP2-shRNA轉染MCF-7細胞的FN蛋白表達減少(81.75±4.26)%,差異有統計學意義(P<0.01)。見圖5。
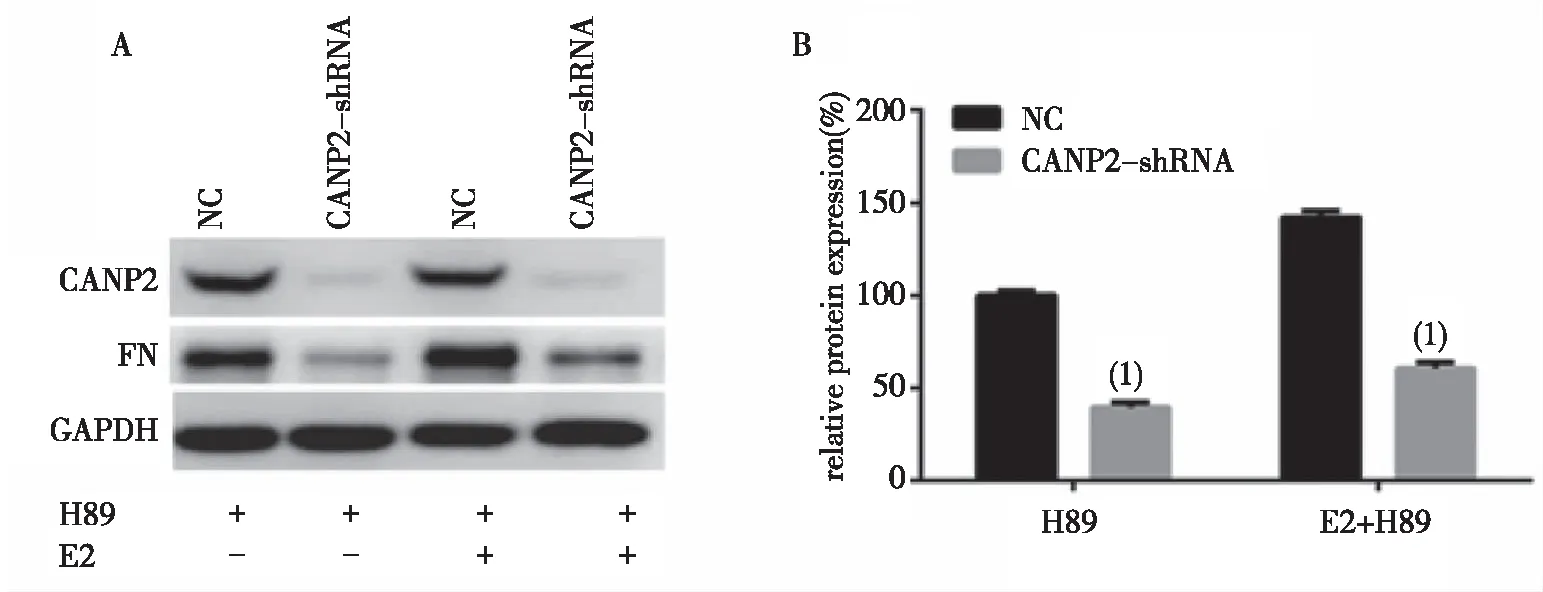
(1)與對照組比較, P<0.01圖5 H89對CANP2-shRNA轉染MCF-7細胞FN蛋白表達的影響Fig.5 Effect of H89 on the expression of fibronectin in cell line of CANP2 gene silencing
3 討論
近年來,乳腺癌的早期診斷和臨床治療取得了較大進展,但絕大多數病人仍死于腫瘤的轉移。大量研究表明,作為體內主要的性激素,E2能刺激乳腺腫瘤的生長并促進其轉移和侵襲[11],但其具體作用機制尚未完全闡明。cAMP/PKA 通路是一條經典的由 G 蛋白偶聯受體介導的細胞信號傳導通路,參與細胞的增殖、分化及凋亡、離子轉運、調節新陳代謝及基因轉錄相關[12-13]。Filardo等人[14]的研究顯示,在MCF-7和SKBR3細胞中,E2可以快速激活膜結合的腺苷酸環化酶 (adenylate cyclase, AC),進而在數分鐘內即引起細胞內cAMP濃度增高,并激活PKA,繼而引起細胞功能的改變。因此,闡明E2-PKA下游信號通路,有助于加深對E2促癌效應分子機制的認識。Clarysse等[15]報道,激活cAMP-PKA 途徑能降低人乳腺癌MDA-MB-435s的細胞遷移率。Lee等[16]的研究表明,cAMP-PKA也能調控宮頸癌細胞的遷移。在本研究中結果亦顯示單獨使用H89能夠增加細胞的遷移率。本研究發現,PKA選擇性抑制劑H89可明顯增強E2的促細胞遷移效應,提示cAMP/PKA途徑對E2促細胞遷移效應可能具有負性調控作用。國內外均有研究顯示,腫瘤中FN表達增加和表型改變可促進腫瘤的增殖,遷移和侵襲;而且還可以限制腫瘤細胞對治療的反應性[17-18]。同時本課題組的前期研究顯示E2可通過上調FN來促進MCF-7和MDA-MB-468乳腺癌細胞的遷移[19]。而本研究結果顯示H89能夠顯著增強E2對MCF-7細胞纖連蛋白FN表達的上調作用,表明cAMP/PKA途徑對E2的抑制效應可能也與纖連蛋白FN表達有關。有研究顯示,cAMP/PKA可通過CANP而調控細胞遷移活動[20]。本課題組亦曾報道,CANP抑制劑Calpeptin(Calp)能明顯抑制E2誘導的FN蛋白上調[19],但Calp對CANP1和CANP2均有抑制效應,不能明確何種CANP亞型參與對FN的上調作用。
為進一步查明E2-PKA下游是否通過CANP2分子來影響乳腺癌細胞的遷移及FN表達,本研究采用CANP2-shRNA轉染模型細胞并篩選穩定表達細胞株。結果發現,基因沉默CANP2后,H89對E2促細胞遷移效應的上調作用受到明顯抑制。同時,基因沉默CANP2后,H89對E2誘導的FN蛋白表達上調的作用也被逆轉。這些結果提示,PKA通過CANP2-FN通路對E2促癌效應發揮重要的負性調控作用。表明E2誘導乳腺癌細胞FN蛋白表達和細胞遷移與PKA-CANP2通路有關。

