KCNJ15誘導鈣離子內流促進T細胞分泌白介素17實驗研究*
朱 琳 陳 韜 徐大琴 寧 琴
華中科技大學同濟醫學院附屬同濟醫院感染科 (湖北 武漢, 430033)
乙型肝炎病毒(HBV)所致的慢加急性肝衰竭(HBV-ACLF)起病兇險,病情進展極為迅速,是臨床上最為嚴重、預后不良的疾病之一。目前,HBV-ACLF的發病機制仍未完全闡明,但公認為系免疫介導的肝損傷,尤其是病毒特異性細胞毒性T細胞(CTL)在HBV-ACLF發病過程中發揮重要作用[1, 2]。目前認為參與HBV-ACLF致病機制的多種因素,均直接或者間接調節T細胞免疫應答,從而導致乙型肝炎重癥化[3]。我們在鼠3型肝炎病毒(MHV-3)誘導的小鼠暴發性肝炎模型中發現,病毒感染后肝臟淋巴細胞上KCNJ15表達顯著增強,以CD4+T和CD8+T細胞最為顯著[4]。為了進一步研究KCNJ15基因在HBV感染誘導的肝衰竭肝損傷中的作用及其機制,本研究通過體外實驗,構建人KCNJ15表達質粒,利用電轉染技術使Jurkat細胞過表達KCNJ15,檢測Jurkat細胞的功能變化,初步探討KCNJ15在HBV-ACLF肝損傷中的可能作用和機制。
1 材料與方法
1.1 細胞和主要試劑 Jurkat細胞購于武漢大學細胞保藏中心(ATCC?TIB-152TM、Clone E6-1);1640培養基、胎牛血清、購自美國Gibco公司;Trizol Reagent購于上海英駿生物技術有限公司;逆轉錄試劑盒及BamHⅠ、HindⅢ限制性內切酶、T4連接酶、Ex Taq酶購于大連寶生物公司;質粒小量提取試劑盒、DNA凝膠回收試劑盒購于Omega公司;SYBR Green購于TOYOBO公司;鼠抗人KCNJ15抗體購于Sigma公司;抗β-actin抗體購于Fermantas公司;電轉染試劑盒(Lonza,VCA-1003)、電轉儀(Nucleofector I Device)訂購于武漢安特捷生物公司;檢測Human Th1/Th2/Th17 Cytokine Kit訂購于BD Biosciences公司;Human Soluble Protein Master Buffer Kit及Human IL-9 Flex Set購于BD Biosciences公司;流式細胞微球芯片捕獲技術(CBA)模板及其分析軟件來源于BD Biosciences公司;Fluo-3AM購于Calbiochem公司;鈣離子載體A23187購于Serva公司。
1.2 引物、載體和菌株 人KCNJ15擴增引物由本實驗室設計,由上海英駿生物技術有限公司合成。引物序列如下:F:5′-TGCGGAGTGAGTGACCAG-3′,R:5′-TGTTTGAAGGGAGTTCTG-3′。pMD-18T載體、DH5α感受態細菌購于大連寶生物公司;pcDNA3.1(+)購于美國Invitrogen公司;DNA測序由華大基因公司(武漢)完成。
1.3 人KCNJ15表達質粒的構建 以NCBI中KCNJ15基因變異體1編碼區序列為模板設計加入酶切位點BamHⅠ、HindⅢ的引物,擴增基因全長編碼區序列。從人PBMC的cDNA 中克隆 KCNJ15基因編碼區全長,經瓊脂糖凝膠電泳后切膠、進行純化。純化后產物與 PMD-18T克隆載體連接,再轉化大腸桿菌DH-5α。擴增后測序鑒定含有目的片段的樣本。對測序驗證正確的克隆提取質粒后行BamHⅠ、HindⅢ雙酶切處理,回收并純化,連入 pcDNA3.1(+) 表達載體。取測序正確的克隆擴大培養后提取質粒備用。
1.4 Jurkat細胞轉染及分組 轉染細胞前2天,按1∶5~1∶6的比例傳代細胞,以保證細胞處于對數生長期。轉染前,在12孔板中加入1640完全培養基,置于37℃、5%CO2培養箱中預平衡。取Jurkat細胞,吸出細胞懸液,900 rpm離心5min后計數。分別取出1×106細胞懸液,離心、吸出上清液,將其中兩管分別加入電轉液(solution V 82 μl和supplementⅠ18 μl)100 μl,重懸細胞,各加入不含內毒素的pcDNA3.1(+) 2 μg和pcDNA3.1(+)-hKCNJ15質粒 2 μg,吹打混勻。分別將上述液體轉入電轉杯,置于電轉儀上,選擇程序X-05(for high expression level)行電轉染。室溫下靜置10 min,取出預平衡的12孔板,分別取出培養基400 μl,加入到電轉杯中。然后,吸出轉染后的細胞至預平衡的培養基1 ml中。加入PcDNA 3.1(+)的Jurkat細胞稱為對照組,加入PcDNA3.1(+)-hKCNJ15質粒的Jurkat細胞稱為實驗組。在空白細胞組,先用預平衡的培養基500 μl重懸,加入到另一個預平衡的培養基1 ml。將12孔板置于37℃、5%CO2培養箱中培養48 h,取上清液,放置于-80℃冰箱凍存用于細胞因子檢測。轉染后細胞用Trizol處理提取RNA或制備蛋白樣本用于PCR或Western Blotting檢測。
1.5 細胞因子檢測 使用CBA試劑盒檢測,先對標準品系列稀釋。振蕩Th1/Th2/Th17試劑盒內的微珠3~5 sec,取適量至空的流式管中并振蕩混勻。取標準品50 μl,將稀釋液加入裝有微珠混合物的流式管中,吹打混勻。取轉染后細胞培養上清液(實驗組、對照組、空白細胞組)50 μl,加入裝有微珠混合物的流式管中,吹打混勻。分別加入試劑盒內熒光素標記的檢測試劑50 μl,吹打混勻。室溫避光孵育3 h。清洗后,離心、棄上清液,加入清洗液300 μl,上流式細胞儀檢測。將CBA檢測模板導入流式細胞儀后,調節FSC、SSC、及各檢測通道-參數。從試劑盒中取出setup管,按操作流程上機檢測。按照模板上的提示,調整各項參數,上機檢測標準管及各待測樣品管,導出數據,在CBA分析軟件上進行分析。
1.6 實時定量PCR檢測 KCNJ15在Jurkat細胞轉染質粒后48 h收集細胞,用 Trizol裂解,提取總RNA,逆轉錄cDNA,進行實時定量PCR檢測。引物序列如下: R:5’-AGGAAGATGGCATGAGGA-3’;F:5’-ACTTAGAACCCGGTGAGC-3’。PCR反應體系為 20 μl,反應條件為:94℃預變性5 min,94℃變性20 s,58℃退火10 s,72℃延伸10 s,主循環35個,72℃終延伸10 min。每一個樣本均設置GAPDH基因作為內參,并設置副孔。
1.7 Western blotting檢測 在Jurkat細胞轉染質粒后48 h收集細胞,制備蛋白樣品。將實驗各組蛋白樣品進行凝膠電泳后,轉印PVDF膜,洗膜后封閉3 h。所用一抗為小鼠抗人KCN15單克隆抗體,孵育過夜。二抗為HRP標記的兔抗鼠,室溫孵育1 h。洗膜后采用化學發光系統(USA)曝光,Image Lab軟件分析。
1.8 胞內鈣離子濃度檢測 收集轉染質粒后的Jurkat細胞,重懸于loading buffer(1×106個/ml),用Fluo-3AM(終濃度5μmol/L)染色細胞,37℃避光水浴30 min。用PBS清洗2次,再用Ca2+Estimation buffer 5 ml洗滌,以去除細胞外多余的熒光染料。隨后,以Ca2+Estimation buffer 1ml重懸細胞,取200 μl細胞懸液檢測靜息細胞鈣離子熒光強度,于流式細胞儀激發光波長488 nm通道,測平均熒光強度(MFI),記為F。將剩余細胞以Calcium Ionophore A23187負載(終濃度10 μmol/L),室溫孵育10 min,取200 μl細胞懸液檢測MFI,記為Fmax;在剩余細胞加入400 mmol/L EGTA螯合鈣離子(終濃度10 mmol/L),室溫孵育20 min,檢測MFI記為Fmin。胞內鈣離子濃度計算公式:【Ca2+】=Kd×(F-Fmin)/(Fmax-F),Kd=0.4 μmol/L。
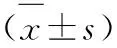
2 結果
2.1 人KCNJ15真核表達質粒轉染Jurkat細胞情況 Jurkat細胞共轉染pMAXGFP和pcDNA3.1(+)-hKCNJ15后48 h,在熒光顯微鏡下觀察,顯示轉染效率為80%~90%。采用Real-time PCR和Western blotting技術分別檢測,發現KCNJ15在基因水平實驗組細胞為105.51 ± 0.58,對照組細胞為101.41 ± 1.16,兩者比較,P=0.001。實驗組細胞蛋白表達亦明顯增強(見插頁圖1及圖2、圖3)。

圖2 3組質粒轉染Jurkat細胞KCNJ15基因表達圖

圖3 3組質粒轉染Jurkat細胞KCNJ15蛋白表達圖
2.2 質粒轉染并培養48 h 3組細胞培養液中各種細胞因子檢測結果 見表1。

表1 3組Jurkat細胞分泌細胞因子比較
2.3 質粒轉染后24 h、48 h 3組細胞胞內鈣離子檢測結果 見表2。

表2 3組細胞兩時段胞內鈣離子結果比較
3 討論
KCNJ15是內向整流鉀離子通道家族(KIR)的一員,也被稱為KIR4.2。KCNJ15基因編碼的是一個整合膜蛋白和內向整流型鉀通道,在人的腎臟、肺、胚胎纖維細胞、微血管內皮細胞以及正常小鼠肝臟均有表達[5~8],但其功能尚未完全明確。既往文獻報道,KCNJ15位于21號染色體,被認為與唐氏綜合癥的臨床表現有關[9]。
既往研究表明,鉀離子通道在T淋巴細胞的分化以及抗原介導的免疫反應中起調節作用。KCNJ15作為鉀離子通道基因,可能通過調節鉀離子流動、鈣內流從而影響人體免疫功能。本研究團隊前期研究結果顯示,KCNJ15在HBV-ACLF患者外周血單個核細胞中高表達,后續研究也發現在MHV-3感染的暴發性肝炎小鼠模型中,肝臟T淋巴細胞表達KCNJ15水平顯著升高,因而我們推測該分子可能通過影響T細胞的活化及功能從而參與免疫誘導的肝細胞損傷。結果顯示過表達KCNJ15的Jurkat細胞分泌IL17-A的水平明顯升高。
Th17細胞是具有獨特免疫學功能的CD4+T細胞亞群,其主要分泌的細胞因子IL-17A在宿主對病原體感染的免疫防御反應中發揮重要作用。同時,IL-17A的異常分泌又與自身免疫性疾病、腫瘤發生均密切相關[10]。目前研究認為Th17細胞在多種肝臟疾病如慢性乙型肝炎、慢性丙型肝炎(CHB)、酒精性肝病中發揮調節天然免疫、獲得性免疫及自身免疫的作用。研究報道,乙型重型肝炎患者和急性乙型肝炎患者外周血中Th17細胞比例顯著高于輕度CHB患者和健康對照人員,并且,升高的Th17細胞比例與患者血清ALT水平呈正相關[11,12]。此外,也有研究指出,Th17細胞在HBV誘導的肝硬化中也啟動一系列免疫介導的病理損傷,在肝硬化致病機制中起著重要作用[13,14]。這些研究表明Th17細胞可能與乙型肝炎疾病進展和肝臟損傷的病理過程緊密相關。在本研究中我們發現KCNJ15能促進T淋巴細胞分泌IL-17從而推測KCNJ15在HBV-ACLF中發揮免疫介導肝損傷作用。而KCNJ15如何促進T細胞分泌IL-17?基于目前對于鉀離子通道的認識,KCNJ15主要通過改變細胞膜電位從而影響細胞功能。另有研究報道,阻斷腸道T細胞上Ca2+活化的鈣通道可以抑制T細胞分泌細胞因子,包括IFN-γ、IL-2、IL-17等[15]。因此,我們推測,KCNJ15可能通過調節鈣離子水平而影響T細胞的功能。于是我們檢測了轉染KCNJ15表達質粒后Jurkat細胞胞內鈣離子濃度。結果顯示,過表達KCNJ15的Jurkat細胞,胞內鈣離子水平在轉染后24 h顯著升高。這與我們推測相符,KCNJ15可能通過調節鈣離子內流從而影響T細胞分泌細胞因子如IL-17的表達水平。但這一通路的具體機制有待更加深入的研究。綜上所述,本實驗觀察了過表達KCNJ15時Jurkat細胞分泌細胞因子及鈣內流的情況,通過體外實驗初步探討了KCNJ15分子對T細胞功能的影響及機制,為后續進一步研究KCNJ15參與HBV-ACLF的免疫學機制奠定了基礎。

