甘藍BoPINs家族基因的特征和表達分析
王玉奎 張賀翠 白曉璟 廉小平 施松梅 劉倩瑩 左同鴻 朱利泉,*
?
甘藍家族基因的特征和表達分析
王玉奎1,**張賀翠1,**白曉璟1廉小平2施松梅2劉倩瑩1左同鴻1朱利泉1,*
1西南大學農學與生物科技學院, 重慶 400715;2西南大學園藝園林學院, 重慶 400100
為了探索植物生長素極性運輸載體蛋白編碼基因家族參與甘藍自交不親和性的成員數目與參與方式, 本文通過轉錄組分析獲得家族在甘藍自花和異花授粉后的表達情況, 利用分子生物學技術和生物信息學方法對該家族的基因結構、蛋白進化親緣關系和表達模式等特征進行分析。結果表明, 甘藍基因家族包含8個成員, 含有5~9個外顯子和4~8個內含子; 其編碼的蛋白質的氨基酸殘基數在350~650之間, 相對分子質量為38~70 kD; 除了BoPIN5和BoPIN8不含中間親水區以外, 其余6個BoPINs家族成員都含有位于兩端的疏水區和中間親水環, 它們可能以膜錨定蛋白的形式發揮作用; 甘藍與蕪菁、擬南芥基因家族親緣關系較近; 染色體定位分析表明,、和與S位點之間發生不同程度的連鎖; 啟動子活性分析表明, BoPINs家族蛋白參與甘藍SI反應, 可能受IAA、ABA等激素相互交叉影響;、、、、、、、和在柱頭中表達量均較高; 數據表達譜和熒光定量分析表明, 8個家族成員中的6個基因在自花授粉后下調表達; 自花授粉后柱頭生長素含量降低, 與SI反應呈負相關。因此, 在甘藍家族的8個成員中有6個基因家族成員可能在膜上以負調節方式調控自交不親和反應。
甘藍; 生長素; 自花授粉;家族; 自交不親和
生長素是植物生長發育的重要調節劑, 在植物的胚胎發育、頂端分生組織和微管組織分化等過程中扮演重要角色, 尤其是在調控雌蕊發育、花粉萌發和花粉管生長方面發揮重要作用[1-2]。生長素在細胞之間呈不對稱分布-即存在生長素濃度梯度, 這種分布模式是生長素合成代謝及極性運輸的共同結果。主要以特定質膜結合極性運輸載體介導生長素在細胞間移動實現在組織中的不對稱分布[3]。外源生長素常常抑制花器官的發育, Okada等[4]研究發現生長素極性運輸抑制劑N-1-氨甲酰苯甲酸萘酯(N-1- naphthylphthalamic acid, NPA)處理會導致擬南芥原基分化和發育異常, 輸出載體PIN1(pin-formed 1)的弱突變體花發育異常、花柱缺失、雌蕊內沒有胚珠, 而強突變體將不能起始花發育, 形成針狀花序。花原基形成后, 生長素在花的發育和性別方面擔負著重要角色, 直接或間接地參與花粉與雌蕊之間的相互作用[5-7]。有研究表明, 通過改變可可樹中生長素濃度梯度可能會影響或控制自交不親和性(self-incompatibility)[8]。生長素反應因子(auxin response factor, ARF3)以非細胞自主調節方式抑制生長素應答報告基因表達, 從而促進十字花科植物自花花粉的排斥反應[9]。這是自交不親和途徑與生長素信號傳導途徑之間存在交叉的重大突破。迄今為止, 對于生長素相關基因是否參與甘藍自交不親和途徑鮮有報道。PINs家族作為生長素極性運輸載體調節生長素分布的重要家族蛋白, 通過調節生長素的時空分布影響器官發生、胚胎發育、根系發育和花系統形成[10]。擬南芥PINs家族蛋白的功能、定位以及基因缺失導致的生理表型除了PIN6外均已報道[11]。但該家族是否可能通過改變植物體內的生長素濃度梯度和生長素極性分布來影響自交不親和反應目前還不是十分清楚。本研究利用轉錄組測序技術分析甘藍親和授粉和不親和授粉后得到的家族基因的表達情況, 以確定該家族中某些生長素極性運輸載體基因是否可能參與自交不親和反應; 利用模式植物中功能已知的擬南芥AtPINs蛋白家族為參考序列, 對BoPIN蛋白家族的基因進行結構分析、進化分析、組織特異性表達分析和功能分析, 以期進一步明確家族基因的特征及其與自交不親和性之間的可能關系。
1 材料與方法
1.1 試驗材料及處理
甘藍高度自交不親和系A4和F1植株由西南大學十字花科研究所提供, 于2017年3月下旬在開花前1~2 d對長勢一致的A4植株人工去雄, 然后分別取A4和F1植株的花粉對A4植株的柱頭人工授粉, 稱為自花授粉(self-pollnation, SI)和異花授粉(cross-pollnation, CP)。授粉時間為0、15、30和60 min。授粉結束后快速掃去柱頭上的花粉, 立即置液氮中保存。分別提取上述處理的甘藍柱頭RNA, 并送北京百邁克生物科技有限公司進行轉錄組測序。
1.2 甘藍BoPIN家族基因序列的收集
通過擬南芥數據庫中獲得擬南芥AtPIN家族蛋白的氨基酸序列, 進行BLASTp檢索; 同時與轉錄組數據所獲得CDS序列比對, 獲取甘藍家族轉錄組號。
1.3 數字表達譜測序分析
基于轉錄組數據中家族的FPKM (Fragments Per Kilobase of transcript per Million fragments mapped)值結果, 采用Multiple Array Viewer軟件繪制熱圖, 進行表達聚類分析。
1.4 甘藍BoPIN家族成員的序列分析、在染色體上的分布分析和系統進化樹構建
用Editseq軟件進行ORF查詢, 利用ExPASy (http://Hwww.expasy.org/tools)中的proPram (http://web. expasy.org/protparam/)分析BoPINs蛋白的理化性質。使用WOLF PSORT (http://www.genscript.com/wolf-psort.html)分析亞細胞定位。采用Mapchart分析BoPINs家族成員在染色體上的分布。利用GSDS在線軟件(http://gsds1.cbi. pku.edu.cn/)分析基因結構。利用Smart (http://smart.embl- heidelberg.de/)和NCBI Conserved Domain Search對BoPINs家族成員進行蛋白結構域預測和保守序列分析。利用MEGA6.0軟件選用鄰接法(Neighbor-Joining, NJ)進行系統進化分析, 校驗參數為Bootstrap=1000。
1.5 差異表達基因的熒光定量PCR檢測
按照THUNDERBIRD SYBR Green Realtime PCR Master Mix試劑盒說明書, 利用Primer Premier 6.0軟件設計家族熒光定量PCR引物(附表)。反應體系包含1 μL濃度為100 ng μL-1cDNA模板、SYBR Green Realtime PCR Master Mix 10 μL、上下游引物各0.5 μL和無RNA酶水8 μL。qPCR程序為95℃預變性5 min; 95℃變性30 s, 58℃退火30 s, 72 ℃延伸30 s, 共40個循環, 以上反應每個樣品3次平行重復。選取作為內參基因, 按照2–ΔΔCT法計算家族的相對表達量[12]。
1.6 BoPINs家族啟動子活性分析
從NCBI甘藍基因組中下載基因轉錄起始位置上游1500 bp的序列, 并利用PlantCARE數據庫(http:// bioinformatics.psb.ugent.be/webtools/plantcare/html/)進行順式作用元件分析。
1.7 BoPINs家族的組織特異性表達分析
對自花授粉后的柱頭、花瓣、萼片、葉片、花蕾和花藥各個組織進行熒光定量PCR檢測, 分析在家族不同組織中的表達模式。利用熱圖軟件進行表達聚類分析。
2 結果與分析
2.1 BoPINs家族的基本特征分析
通過擬南芥數據庫家族的氨基酸序列進行BLASTp比對(取E-value≤1×10–20), 結合甘藍基因組數據庫序列, 從甘藍基因組數據庫中共鑒定出8個家族基因[13-15]。根據它們的染色體位置, 將、和的同源拷貝依次命名為、、、、和。其編碼多肽鏈的氨基酸殘基數在350~650之間, 相對分子質量為38~70 kD。編碼氨基酸鏈最長的是BoPIN2, 其相對分子質量為70.46 kD; 編碼氨基酸鏈最短的是BoPIN8, 其相對分子質量為38.22 kD。BoPINs蛋白的理論等電點(pI)在6~9之間。不穩定系數分析發現, 大部分BoPINs蛋白為穩定蛋白(不穩定系數小于40), 只有BoPIN1-1和BoPIN5屬于不穩定蛋白。根據親水性指數(GRAVY為負值表示親水性, 正值表示疏水性, 介于-0.5 ~ +0.5的為兩性蛋白)的原則, 發現BoPIN5和BoPIN8蛋白為疏水性蛋白, 其余BoPIN家族蛋白均為兩性蛋白[16]。亞細胞定位預測分析表明,BoPIN1-1、BoPIN1-2、BoPIN2、BoPIN3、BoPIN4、BoPIN7-1和BoPIN7-2定位于細胞膜; BoPIN5、BoPIN6和BoPIN8定位于內質網[17-18](表1)。SignalP在線工具分析顯示, BoPINs家族蛋白都不存在信號肽, 均為非分泌型蛋白。
2.2 甘藍BoPINs的基因結構和蛋白系統進化分析
根據轉錄組數據中的CDS序列, 結合NCBI數據庫中的甘藍基因組信息, 序列比對分析甘藍家族成員的基因結構特征。由圖1可知,、、和均具有6個外顯子和5個內含子;具有9個外顯子和8個內含子;具有7個外顯子和6個內含子;具有5個外顯子和4個內含子; 因此甘藍家族成員的基因均含有數目不等的外顯子和內含子, 且數目差別明顯, 甘藍BoPINs蛋白結構特征存在于其外顯子編碼的氨基酸序列變異中。以系數0.54為標準, BoPIN1-1、BoPIN3-1、BoPIN3-2、BoPIN4、BoPIN5、BoPIN7-1和BoPIN7-2的進化關系相近, BoPIN5和BoPIN8進化關系相近。

表1 甘藍BoPINs家族蛋白信息

圖1 甘藍BoPINs的進化樹和基因結構圖
左側為進化樹, 用MEGA6.0軟件構建; 右側為甘藍家族的基因結構圖。
The phylogenetic tree is constructed with MEGA6.0 software on the left and the gene structure map of thefamily on the right.
為了更好理解不同植物PIN蛋白之間的進化關系, 利用MEGA6.0軟件對十字花科植物(甘藍、擬南芥、蕪菁、蘿卜)、單子葉植物(玉米、水稻) 6種植物共55個PIN蛋白構建系統進化樹。表明甘藍BoPINs與蕪菁BrPINs、擬南芥AtPINs和蘿卜親緣關系最近, 與玉米ZmPINs、水稻OsPINs親緣關系較遠。以水稻OsPIN9為外群, 按照親緣關系遠近的原則分為6組, 第I組是14個十字花科特異性組, BoPIN3和BoPIN7在進化過程中發生基因復制事件; 第II、III組均有單子葉植物和十字花科植物聚類在一起, 表明PIN1、PIN2在物種進化過程中未發生基因丟失事件; 第IV組包括4個十字花科物種, 表明PIN6只存在于十字花科植物中, 而不存在于以玉米、水稻為代表的單子葉植物中; 第V、VI組中AtPIN5和AtPIN8的直系同源物分別對應甘藍BoPIN8和BoPIN5 (圖2)。
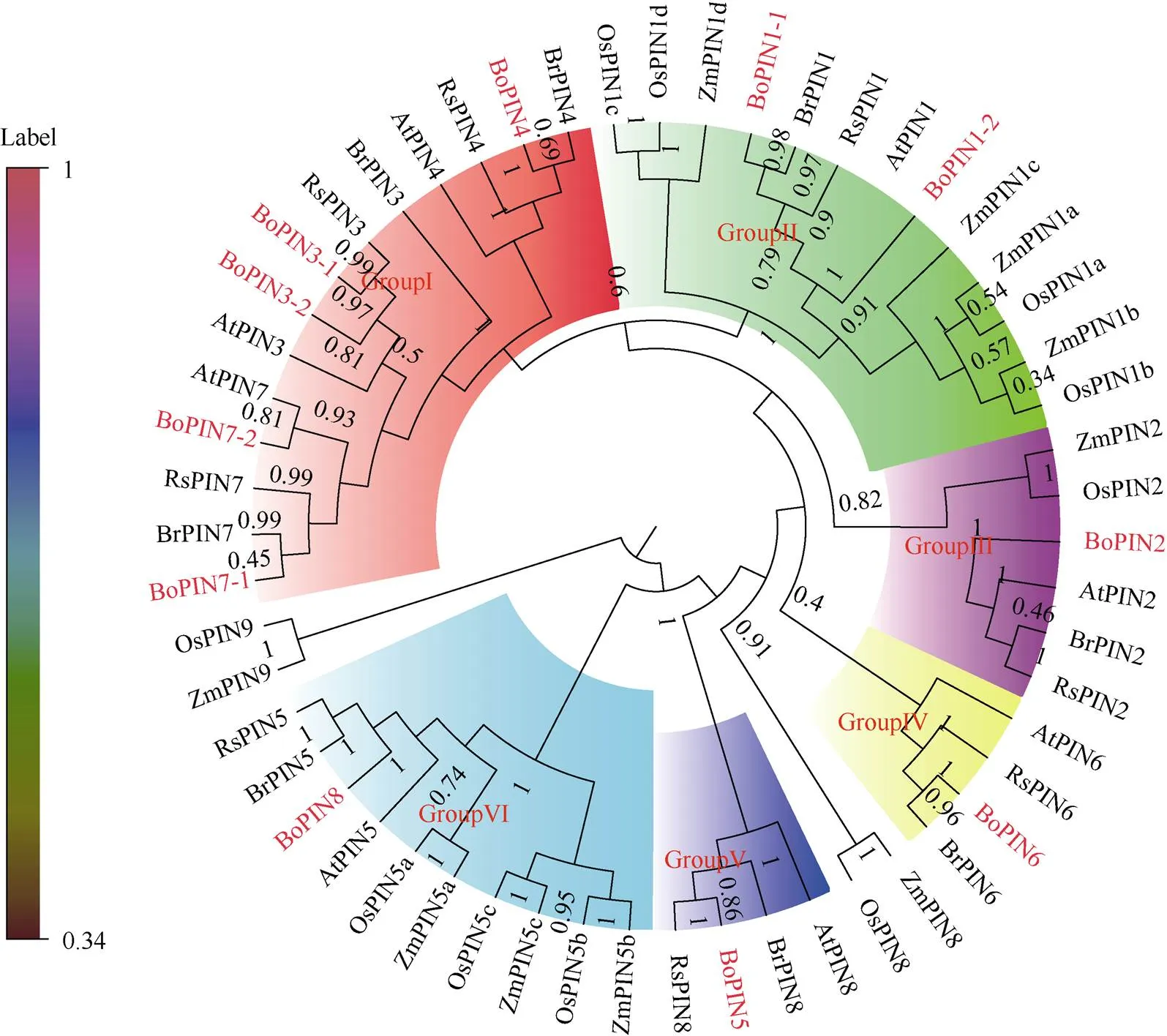
圖2 甘藍家族BoPINs的系統進化樹
2.3 甘藍BoPINs家族基因成員的染色體定位
、、、、有1個拷貝;、和有2個同源拷貝,、、、、和分布在不同染色體上。從圖3可以看出, 甘藍自交不親和關鍵元件S位點糖蛋白(S-locus glycoprotein, SLG)、S半胱氨酸富集蛋白(S-locus cystine-rich protein, SCR)以及S位點受體激酶(S-locus receptor kinase, SRK)和家族成員主要集中在第6染色體上, 蕓薹屬自交不親和反應受多態性S位點復等位基因控制。在第6染色體上存在一個多態性S位點, 而該基因家族成員、、和都位于該多態性位點附近。按照1,000,000 nt為1 cM計算, 遺傳圖距分別是13.8、4.21、11.37和31.1 cM。這不同程度地連鎖反映了該家族基因與S位點的遺傳距離, 遺傳距離近的可能存在順式作用, 遺傳距離遠的可能存在反式作用。
2.4 BoPINs家族自花授粉和異花授粉后的授粉依賴性表達
從轉錄組數據得到基因家族在自花和異花授粉0、15、30和60 min的表達模式。將家族基因的FPKM值均一化, 采用Multiple Array Viewer 軟件繪制熱圖(圖4)。在自花授粉后下調, 在異花授粉后表達量變化不明顯。在自花授粉15~60 min劇烈下調, 在60 min后表達量達到最低。在自花授粉0~60 min過程中下調, 而異花授粉后15~60 min表達量上調, 在異花授粉60 min時,達到了在未授粉時的表達量。、與表達模式一致。和在自花授粉0~60 min過程表達量下調, 而異花授粉后15~60 min表達量上調, 而后急劇下調。綜上所述, 在自花授粉0~60 min過程中,、、、、和處于下調狀態, 這與自交不親和關鍵元件SRK (Bo6g101190)在自花授粉0~60 min的表達模式是一致的。
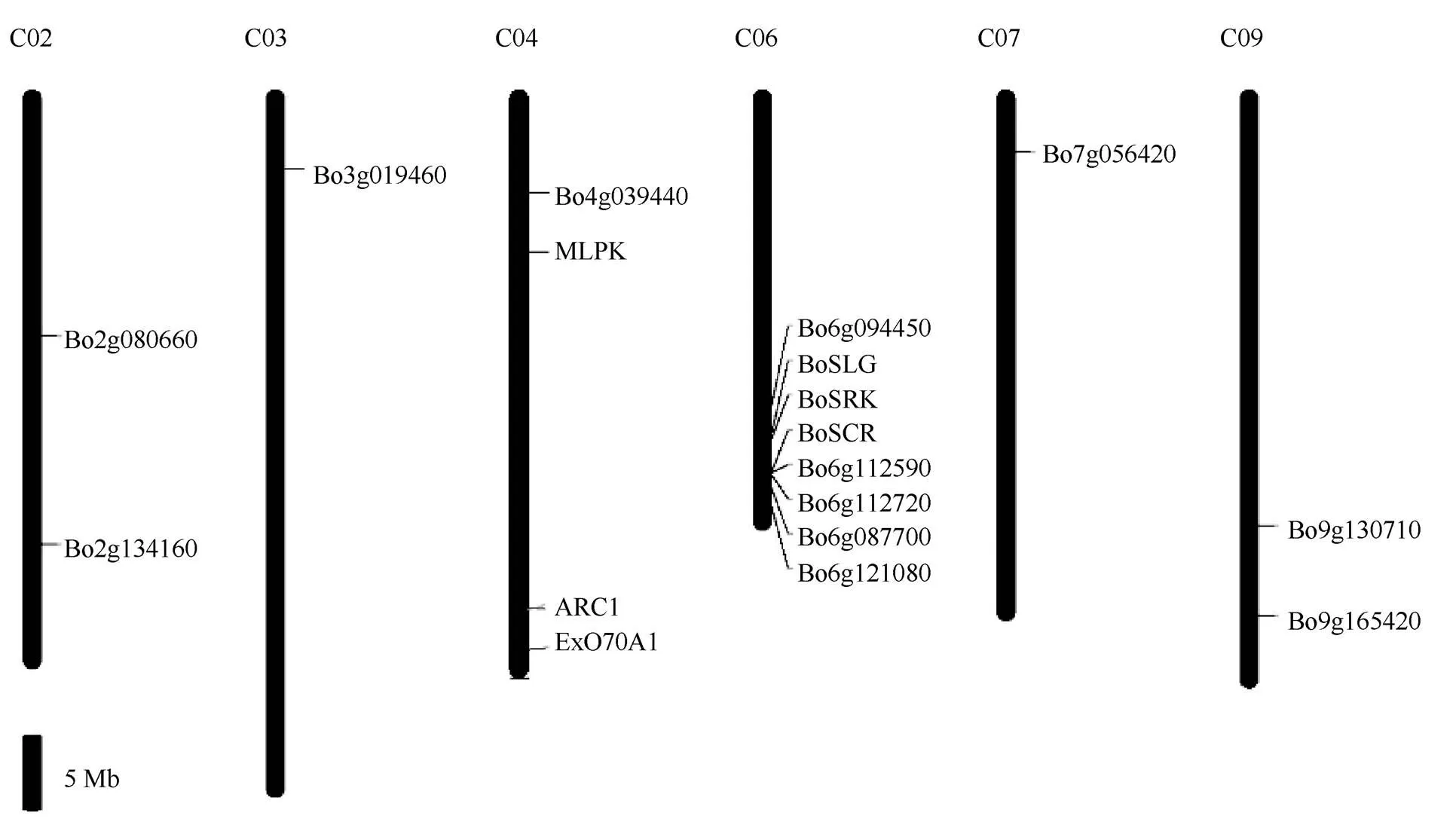
圖3 BoPINs家族在甘藍染色體的分布

圖4 BoPINs基因家族在自花授粉和異花授粉后的表達模式
為了進一步確定甘藍家族在自花授粉和異花授粉處理后的表達模式, 利用熒光定量PCR對該基因家族進行表達分析。、、、、和在自花授粉后顯著下調表達, 在60 min后達到最低, 而在異花授粉后表達差異不大。在自花授粉后下調表達, 在異花授粉后顯著上調表達。在自花授粉后的表達模式與異花授粉后的表達模式呈現出相反的趨勢。在自花授粉后顯著上調表達, 在30 min達到最高而后急劇下調表達, 異花授粉后表達量差異不顯著(圖5), 說明、、、、、和的表達受到SI的抑制, 而基因的表達既受到SI抑制還受到CP促進,基因的表達受到與相反的調控,基因受SI抑制具有先期時限性。
2.5 BoPINs家族的啟動子順式作用元件分析
利用NCBI數據庫選取轉錄起始位點上游1500 bp的序列, 結合PlantCARE在線軟件分析該家族啟動子的順式作用元件研究是否受自花授粉顯著誘導。由表2可知,包含光、ABA、IAA、水楊酸、脫落酸、赤霉素、脅迫響應相關的順式作用元件。其中、、和含有生長素響應相關元件, 除了其余基因家族成員都含有脅迫響應相關元件。表明BoPINs家族蛋白可能受IAA、ABA等激素相互交叉影響參與甘藍SI反應[19-20]。
2.6 BoPINs家族的組織特異性表達分析
為了探究在自花授粉后甘藍基因家族在不同組織中的表達量, 利用qRT-PCR技術對甘藍基因家族在花蕾、花藥、萼片、花瓣、葉片和柱頭6種組織進行特異性表達分析, 將熒光定量所得數據均一化進行數據表達譜分析。在萼片中表達量最高, 在花瓣中表達量最低;在花藥中表達量最高, 在花瓣中表達量最低;在柱頭的表達量最高, 在花粉和花瓣的表達量較低;和在柱頭的表達量最高, 花粉次之, 在花瓣的表達量最低;在花蕾和萼片的表達量最高, 在柱頭和花瓣的表達量最低。、、、、、、和在柱頭的表達量高于其他組織(圖6)。結合該家族在授粉后各個時期的表達模式表明該家族部分成員可能參與自交不親和反應。
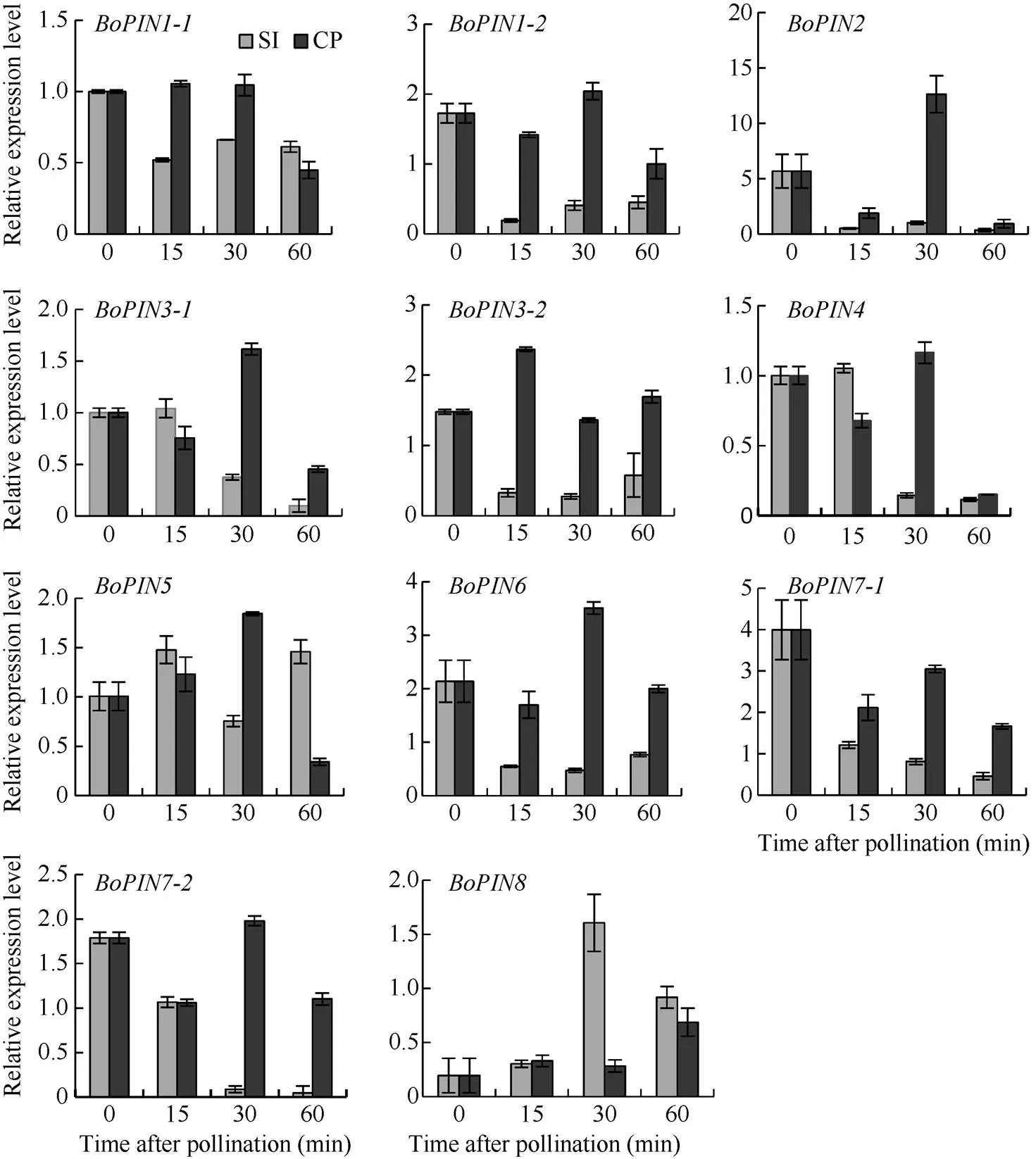
圖5 甘藍BoPINs家族在自花和異花授粉后的表達分析
SI: self-pollination; CP: cross-pollination.

表2 BoPINs基因啟動子的順式作用元件

圖6 BoPINs基因家族成員在自花授粉后不同組織中的表達量分析
2.7 甘藍柱頭授粉后生長素含量的變化
色氨酸氨基轉移酶(Tryptophan aminotransferase, TAA1)通過吲哚丙酮酸途徑(indole-3-pyruvate, IPA)參與生長素的合成, 它將Trp轉化成IPA, 從而參與生長素生物合成。TAA1的mRNA的含量與生長素含量成正比關系[21-22]。本研究利用轉錄組數據庫中的TAA1的mRNA來表征柱頭授粉后的生長素含量變化。結果表明(圖7), 在自花授粉后TAA1的mRNA含量一直降低, 異花授粉后mRNA含量變化不明顯, 說明甘藍柱頭在自花授粉后生長素含量降低, 與SI反應呈負相關。
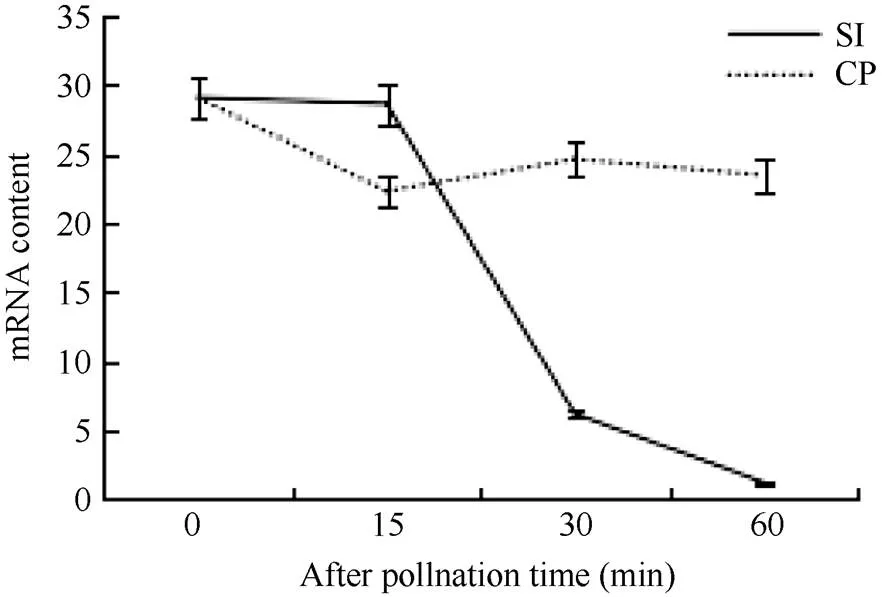
圖7 柱頭授粉后生長素生物合成關鍵酶TAA1的mRNA含量變化
3 討論
本研究在自花授粉的轉錄組數據中首次獲得甘藍生長素輸出載體基因家族8個成員。在其他植物中, 研究發現生長素在花粉發育、花粉管生長和花序維管組織發育等生物過程起著關鍵作用, 已有研究表明, 梨自花授粉后柱頭內的IAA含量變化較顯著, 在可可樹自花授粉后生長素含量減少, 乙烯含量增加, 可可樹自交不親和性受生長素調節控制[23-24]。IAA在煙草自交不親和的花粉與柱頭的識別過程中出現了相似的顯著變化[25], 在本文中首次發現,、、、、等成員的表達量與自交不親和性之間存在負相關, 從表達量和功能研究兩方面印證了柱頭表面細胞內未知的生長素響應元件的抑制促進了柱頭對自身花粉的抑制作用[26]。
生長素輸出載體基因編碼一類生長素極性運輸跨膜蛋白, 它是細胞內IAA運輸到胞外的關鍵載體因子。PINs家族作為生長素信號傳導通路中主要的輸出載體蛋白, 通過對生長素濃度梯度極性分布調節, 參與包括SI在內的諸多植物生理過程。本研究通過轉錄組分析, 獲得了8個甘藍的家族成員。除了BoPIN5和BoPIN8蛋白缺失了中間親水區, 其他蛋白均含有兩端疏水結合區和中間親水環。進化分析表明, 除BoPIN5與AtPIN8親緣關系最近、BoPIN8和AtPIN5親緣關系最為密切之外, 其他BoPINs家族都與AtPINs家族同屬同一進化分支, 也存在較近的親緣關系。啟動子活性分析表明基因家族受多種植物激素相互交叉影響參與自交不親和反應。染色體定位分析表明,主要定位于第2、第4、第6和第9染色體上, 其中、和定位于第6染色體上, 而自交不親和關鍵元件、、均位于第6染色體上, 與S位點基因存在緊密連鎖性。可能參與自花授粉響應, 調節柱頭乳突細胞的生長素濃度梯度和花器官內生長素的時空分布。PINs家族蛋白在自花授粉后下調表達可能是胞內生長素的濃度反饋調節基因表達引起[27]。生長素對基因表達調節可能與(plethora)基因有關, PLT蛋白是一類含有AP2結構域的轉錄因子, 是根尖干細胞發生、發育主要決定因子。在雙突變體中, 根尖干細胞缺失, 根系發育異常, PIN1、PIN4和PIN7的蛋白表達量明顯降低。這種反饋模式對于維持植物細胞生長素梯度平衡至關重要[28]。PIN蛋白表達量受諸多因素影響, 如生長素的反饋調節、生長素自身分布和生長素信號[29-30]。PIN蛋白作為ARF和Aux/IAA蛋白下游信號元件, ARF直接或間接地促進PIN蛋白的表達, Aux/IAA蛋白通過泛素蛋白降解途徑抑制PINs蛋白表達[31]。有研究表明ARF3 (ETTIN)和ARF5 (MONOPTEOS) 可以直接靶向激活、和的表達, 特別是ARF3作為增強SI反應的雌蕊發育調節因子,、和可能作為靶向基因下調生長素反應促進自花花粉的抑制[32-33]。PIN蛋白的極性定位與囊泡運輸密切相關, 當用囊泡運輸抑制劑BFA (brefeldin)處理時, 膜定位的PIN1、PIN3等可逆地在胞質內聚集, 用生長素抑制劑(NPA)處理會導致PIN1的持續內在化[34]。擬南芥GNOM/EMB30缺失突變體中定位異常, 表現出極性運輸缺失相似的表型, 例如胚胎發育異常、器官融合等。GNOM介導下游的SNX1 (sorting nexin 1)調節VPS29 (vaculolar protein sorting 29)蛋白, 從而調節PIN1在胞內的極性定位, 影響生長素的極性運輸[35-36]。通過酵母雙雜技術篩選出SNX1能與SRK發生相互作用, 進一步研究證明了PIN1可能作為自交不親和關鍵元件SRK的下游信號元件抑制生長素反應增強SI[37-38]。PID (PINOID)過表達植株中PIN蛋白極性定位發生變化, 植物體內生長素濃度梯度紊亂, 胚胎和幼苗根發育嚴重缺陷, 與磷酸酶PP2A (protein phosphatase 2A)功能缺失突變體表型類似。PID蛋白激酶與磷酸酶PP2A以相反的方式調節PIN蛋白的磷酸化與去磷酸化, 改變PIN親水環磷酸化位點的氨基酸序列, 可以破壞PIN蛋白的極性定位, 從而影響生長素的極性運輸[39]。總而言之, 植物體內生長素極性運輸的調節可通過調控PIN蛋白的量或定位實現對生長素濃度分布的精細調控。
、、、、、、、和在自花授粉后柱頭中表達量較高, 且在自花授粉后顯著下調表達, 表明在自花授粉后未知生長素信號反應蛋白反饋抑制家族極性運輸生長素, 導致柱頭乳突細胞內生長素含量降低, 生長素含量與自交不親和性呈負相關, 最終激活SRK下游未知信號通路導致自交不親和反應。
[1] Vieten A, Sauer M, Brewer P B, Friml J. Molecular and cellular aspects of auxin-transport-mediated development., 2007, 12: 160–168.
[2] Petrá?ek J, Friml J. Auxin transport routes in plant development., 2009, 136: 2675–2688.
[3] Reinhardt D, Pesce E R, Stieger P, Mandel T, Baltensperger K, Bennett M, Traas J, Friml J. Regulation of phyllotaxis by polar auxin transport., 2003, 426: 255–260.
[4] Okada K, Ueda J, Komaki M K, Bell C J, Shimura Y. Requirement of the auxin polar transport system in early stages of Arabidopsis floral bud formation., 1991, 3: 677–684.
[5] Hall I V, Forsyth F R. Production of ethylene by flowers following pollination and treatments with water and auxin., 1967, 45: 1163–1166.
[6] Safavian D, Zayed Y, Indriolo E, Chapman L, Ahmed A, Goring D R. RNA silencing of exocyst genes in the stigma impairs the acceptance of compatible pollen in Arabidopsis., 2015, 169: 2526–2538.
[7] Zhang C, Li G, Chen T, Feng B, Fu W, Yan J, Islam M R. Heat stress induces spikelet sterility in rice at anthesis through inhibition of pollen tube elongation interfering with auxin homeostasis in pollinated pistils., 2018, 11: 14, doi: 10.1186/s12284- 018-0206-5.
[8] Hasenstein K H, Zavada M S. Auxin modification of the incompatibility response in., 2001, 112: 113–118.
[9] Tantikanjana T, Nasrallah J B. Non-cell-autonomous regulation of crucifer self-incompatibility by Auxin Response Factor ARF3., 2012, 109: 19468–19473.
[10] Vanneste S, Friml J. Auxin: a trigger for change in plant deve-lopment., 2009, 136: 1005–1016.
[11] Benkova E, Michniewicz M, Sauer M, Teichmann T, Seifertova D, Jurgens G, Friml J. Local, efflux-dependent auxin gradients as a common module for plant organ formation., 2003, 115: 591–602.
[12] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2?ΔΔCTmethod., 2001, 25: 402–408.
[13] 王占軍, 楊立偉, 徐忠東, 歐祖藍, 袁華玲, 任意飛. 麻瘋樹基因家族的鑒定與生物信息學分析. 分子植物育種, 2015, 13: 1111–1122. Wang Z J, Yang L W, Xu Z D, Ou Z L, Yuan H L, Ren Y F. Identification and bioinformatics analysis of thegene family of., 2015, 13: 1111–1122 (in Chinese with English abstract).
[14] Liu Y, Wei H. Genome-wide identification and evolution of the PIN-FORMED (PIN) gene family in., 2017, 60: 564–571.
[15] K?e?ek P, Sk?pa P, Libus J, Naramoto S, Tejos R, Friml J. The PIN-FORMED (PIN) protein family of auxin transporters., 2009, 10: 249, doi: 10.1186/gb-2009-10-12-249.
[16] Bendtsen J D, Jensen L J, Blom N, Heijne G, Brunak S. Feature-based prediction of non-classical and leaderless protein secretion., 2004, 17: 349–356.
[17] Mravec J, Sk?pa P, Bailly A, Hoyerova K, Krecek P, Bielach A, Petrasek J, Zhang J, Gaykova V, Stierhof Y D, Rolcik J, Stierhof D, Luschnig C,Benkova E, Zazimalova E, Geisler M, Friml J. Subcellular homeostasis of phytohormone auxin is mediated by the ER-localized PIN5 transporter., 2009, 459: 1136–1140.
[18] Friml J. Subcellular trafficking of PIN auxin efflux carriers in auxin transport., 2010, 89: 231–235.
[19] Baker R P, Hasenstein K H, Zavada M S. Hormonal changes after compatible and incompatible pollination inL., 1997, 32: 1231–1234.
[20] Ono K, Morimoto T, Akagi T, Wunsch A, Tao R. Genome re-sequencing of diverse sweet cherry () individuals reveals a modifier gene mutation conferring pollen-part self- compatibility., 2018, 59: 1265–1275.
[21] Zhou Z Y, Zhang C G, Wu L, Zhang C G, Chai J, Wang M, Jha A, Jia P F, Cui S J, Yang M, Chen R. Functional characterization of thegene and dissection of hormonal actions in the Arabidopsis root., 2011, 66: 516–527.
[22] Kakei Y, Nakamura A, Yamamoto M, Ishida Y, Yamazaki C, Sato A, Nara M N, Soeno K, Shimada Y. Biochemical and chemical biology study of rice OsTAR1 revealed that tryptophan aminotransferase is involved in auxin biosynthesis: identification of a potent OsTAR1 inhibitor, pyruvamine 2031., 2017, 58: 598–606.
[23] Cazzonelli C I, Vanstraelen M, Simon S, Yin K, Arthur A, Nisar N, Tarle G, Cuttriss A J, Searle L R, Mathesius U, Masle J, Friml J, Pogson B J. Role of the Arabidopsis PIN6 auxin transporter in auxin homeostasis and auxin-mediated development., 2013, 8: e70069.
[24] 齊國輝, 徐繼忠, 張玉星. 鴨梨自交不親和性與花柱內源激素關系的研究. 河北農業大學學報, 2007, 30(1): 31–34. Qi G H, Xu J Z, Zhang Y X. Study on the relationship between self-incompatibility and the endogenous hormones in style of Yali., 2007, 30(1): 31–34 (in Chinese with English abstract).
[25] Bavrina T V, Milyaeva E L, Machác?ková I, Pustovoitova T N, Gurko N A, Kasumova I V, Zhdanova N E. Effect of phytohormone biosynthesis genes (ipt and iaaM+ iaaH) on the sexual reproduction of transgenic tobacco plants., 2002, 49: 484–491.
[26] Chen D, Zhao J. Free IAA in stigmas and styles during pollen germination and pollen tube growth of., 2008, 134: 202–215.
[27] Vieten A, Vanneste S, Wi?niewska J, Benkova E, Benjamins R, Beeckman T, Luschnig C, Friml J. Functional redundancy of PIN proteins is accompanied by auxin-dependent cross-regulation of PIN expression., 2005, 132: 4521–4531.
[28] Blilou I, Xu J, Wildwater M, Willemsen V, Paponov I, Friml J, Heidstra R, Aida M, Palme K, Scheres B. The PIN auxin efflux facilitator network controls growth and patterning in Arabidopsis roots., 2005, 433: 39–44.
[29] Aida M, Beis D, Heidstra R, Willemsen V, Blilou I, Galinha C, Nussaume L, Noh Y S, Amasino R, Scheres B. Thegenes mediate patterning of the Arabidopsis root stem cell niche., 2004, 119: 109–120.
[30] Geisler M, Blakeslee J J, Bouchard R, Lee O R, Vincenzetti V, Bandyopadhyay A, Titapiwatanakun B, Peer W A, Bailly A, Richard E L, Ejendal K F K, Smith A P, Baroux C, Grossniklaus U, Muller A, Hrycyna C A, Dudler R, Murphy A S, Murphy A S. Cellular efflux of auxin catalyzed by the Arabidopsis MDR/PGP transporter AtPGP1., 2005, 44: 179–194.
[31] Petrasek J, Mravec J, Bouchard R, Blakeslee J J, Abas M, Seifertova D, Wisniewska J, Tadele Z, Kubes M, Covanova M, Dhonukshe P, Skupa P, Benkova E, Perry L, Krecek P, Lee O R, Fink G R, Geisler M, Murphy A S, Luschnig C, Zazimalova E, Friml J. PIN proteins perform a rate-limiting function in cellular auxin efflux., 2006, 312: 914–918.
[32] Lavenus J, Guyomarc’h S, Laplaze L. PIN transcriptional regulation shapes root system architecture., 2016, 21: 175–177.
[33] Simonini S, Bencivenga S, Trick M. Auxin-induced modulation of ETTIN activity orchestrates gene expression in Arabidopsis., 2017, 29: 1864–1882.
[34] Geldner N, Friml J, Stierhof Y D, Jurgens G, Palme K. Auxin transport inhibitors block PIN1 cycling and vesicle trafficking., 2001, 413: 425–428.
[35] Geldner N, Anders N, Wolters H, Keicher J, Kornberger W, Muller P, Delbarre A, Ueda T, Nakano A, Jurgens G. The Arabidopsis GNOM ARF-GEF mediates endosomal recycling, auxin transport, and auxin-dependent plant growth., 2003, 112: 219–230.
[36] Jaillais Y, Fobis-Loisy I, Miege C, Rollin C, Gaude T. AtSNX1 defines an endosome for auxin-carrier trafficking in Arabidopsis., 2006, 443: 106–109.
[37] Vanoosthuyse V, Tichtinsky G, Dumas C, Gaude T, Cock J M. Interaction of calmodulin, a sorting nexin and kinase-associated protein phosphatase with thelocus receptor kinase., 2003, 133: 919–929.
[38] Roux M, Zipfel C. Receptor kinase interactions: complexity of signaling. In: Receptor-like Kinases in Plants.Springer, 2012. pp 145–172.
[39] Michniewicz M, Zago M K, Abas L, Weijers D, Schweighofer A, Meskiene M G, Ohno C, Zhang J, Huang F, Schwab R, Weigel D, Meyerowitz E M, Luschnig C, Offringa R, Friml J. Antagonistic regulation of PIN phosphorylation by PP2A and PINOID directs auxin flux., 2007, 130: 1044–1056.
Characteristics and expression analysis offamily genes in
WANG Yu-Kui1,**, ZHANG He-Cui1,**, BAI Xiao-Jing1, LIAN Xiao-Ping2, SHI Song-Mei2, LIU Qian-Ying1, ZUO Tong-Hong1, and ZHU Li-Quan1,*
1College of Agriculture and Biotechnology, Southwest University, Chongqing 400715, China;2College of Horticulture and Gardening, Southwest University, Chongqing 400100, China
In order to explore the number and expression of thegene family participating in self-incompatibilty of, their expression after self-pollination and cross-pollination were detected by transcriptome analysis, and the corresponding gene structure, phylogenetic tree and expression patterns of the family were further analyzed by bioinformatics. This gene family contained 5-9 exons and 4-8 introns. The amino acid of the encoding protein residues were between 350 and 650 and had molecular weights ranging from 38 kD to 70 kD. Except that BoPIN5 and BoPIN8 did not contain internal hydrophilic cytoplasmic regions, the remaining six BoPINs proteins contained a hydrophobic region at both ends and an internal hydrophilic ring, showing they located on membrane. The evolutionary analysis indicated thatwere closely related to theand thegene family. Chromosome localization analysis indicated that,,, andmembers of the family were linked to S-loucs to different degrees. Tissue-specific expression analysis indicated that,,,,,,,, andhad higher expression levels in the stigma. Data expression profiling and fluorescence quantitative analysis indicated that six of the eightgenes were down-regulated after self-pollination. All these results indicate that six members of the eightgene family members on the membrane may participate in the self-incompatibility response ofin a negative regulatory manner.
; auxin; self-pollination; BoPINs family; self-incompatibility
2018-10-15;
2019-04-15;
2019-04-26.
10.3724/SP.J.1006.2019.84129
朱利泉, E-mail: zhuliquan@swu.edu.cn, Tel: 023-68250794
**同等貢獻(Contributed equally to this work)
E-mail: wangyuk0808@163.com
本研究由國家自然科學基金項目(31572127)和中央高校基本科研業務費(XDJK2017C023)項目資助。
This study was supported by the National Natural Science Foundation of China (31572127) and the Basic Research Fund of the Central University (XDJK2017C023).
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20190426.0914.002.html

