甘藍(lán)型油菜AVP1、VHA-a2和VHA-a3基因的鑒定及功能性研究
姚珺玥 華營鵬 周 婷 王 濤 宋海星 官春云張振華,*
?
甘藍(lán)型油菜和基因的鑒定及功能性研究
姚珺玥1,2華營鵬1,2周 婷1,2王 濤1,2宋海星1,2官春云3張振華1,2,*
1湖南農(nóng)業(yè)大學(xué)資源環(huán)境學(xué)院, 湖南長沙 410128;2南方糧油作物協(xié)同創(chuàng)新中心, 湖南長沙 410128;3國家油料作物改良中心湖南分中心, 湖南長沙 410128
液泡是調(diào)控植物細(xì)胞分化、生長發(fā)育的重要部位,和基因調(diào)控植物液泡內(nèi)外離子平衡、離子運(yùn)輸以及能量供應(yīng)。本研究利用功能已知的擬南芥和基因為參考序列在甘藍(lán)型油菜全基因組數(shù)據(jù)庫、NCBI植物基因組注釋數(shù)據(jù)庫等鑒定并篩選出9個3個和4個, 并分析基因拷貝數(shù)變異、分子特征、跨膜結(jié)構(gòu)域、保守基序、染色體定位、系統(tǒng)進(jìn)化樹構(gòu)建、蛋白二級結(jié)構(gòu)及三維結(jié)構(gòu)預(yù)測、高通量轉(zhuǎn)錄組測序等。發(fā)現(xiàn)甘藍(lán)型油菜和的基因數(shù)量明顯多于甘藍(lán)和白菜; 甘藍(lán)型油菜AVP1、VHA-a2和VHA-a3蛋白屬于由酸性氨基酸組成的穩(wěn)定蛋白; 系統(tǒng)進(jìn)化選擇能力的分析表明, 甘藍(lán)型油菜、和家族基因與甘藍(lán)、白菜關(guān)系相近。轉(zhuǎn)錄組測序表明, 低氮處理后,基因主要在地上部表達(dá), 且低氮3 h后地上部表達(dá)下調(diào), 低氮處理72 h根中表達(dá)量上調(diào);s和s基因在地上部和根中均有表達(dá),在低氮處理72 h后表達(dá)量基本呈上調(diào)趨勢,在低氮3 h后基本呈下調(diào)趨勢。低磷處理后,s根中大部分基因表達(dá)上調(diào), 地上部表達(dá)基本無差異;s表達(dá)基本無差異;地上部和根中均基本為上調(diào)趨勢。該結(jié)果為進(jìn)一步研究甘藍(lán)型油菜和基因生物學(xué)功能及AVP1、VHA-a2和VHA-a3蛋白水解ATP提供能量供植物代謝的分子機(jī)制奠定基礎(chǔ), 為已知大量數(shù)據(jù)的其他物種家族基因生物信息學(xué)研究提供參考。
甘藍(lán)型油菜;基因;基因; 生物信息學(xué)
植物的生長和發(fā)育離不開對必需營養(yǎng)元素的吸收及代謝產(chǎn)物的轉(zhuǎn)運(yùn), 植物通過調(diào)控轉(zhuǎn)運(yùn)蛋白的活性來感知并應(yīng)對不斷變化的營養(yǎng)水平和環(huán)境壓力[1]。這一基本調(diào)節(jié)過程需要大量的能量來維持平衡, 而ATP水解所形成的能量在這一過程中起著重要的作用, 如果沒有主要的質(zhì)子動力來激活耦合的載體或離子通道, 所有的運(yùn)輸和代謝活動會受到抑制甚至停止。
在植物體中存在著3種不同的質(zhì)子泵, 即定位在細(xì)胞質(zhì)膜上的P型質(zhì)子泵(H+-ATPase)、液泡膜上利用焦磷酸水解釋放能量驅(qū)動的H+-PPase (V-H+-PPase)和廣泛存在于內(nèi)膜系統(tǒng)的液泡型質(zhì)子泵(V-H+-ATPase), 3種類型的質(zhì)子泵協(xié)同調(diào)控著細(xì)胞內(nèi)各區(qū)室間pH的動態(tài)平衡, 對細(xì)胞內(nèi)的物質(zhì)代謝及維持其他轉(zhuǎn)運(yùn)蛋白的正常運(yùn)轉(zhuǎn)等具有重要的作用[1]。H+-PPase和H+-ATPase是作用于細(xì)胞液泡膜上進(jìn)行H+代謝的主要作用酶, 兩者都是將細(xì)胞質(zhì)內(nèi)的H+轉(zhuǎn)運(yùn)到液泡內(nèi), 酸化液泡內(nèi)的許多離子(如Ca2+等), 為代謝物的生成提供能量, 由此產(chǎn)生的離子梯度形成滲透勢差, 影響多種細(xì)胞功能[2]。液泡H+-ATP酶(V-H+-ATPase)和液泡H+-PPase (V-H+-PPase)都是高度豐富的液泡蛋白, 所有液泡功能都需要穿過液泡膜, 處理代謝過程中產(chǎn)生的大量質(zhì)子, 這一過程被認(rèn)為是由這2個質(zhì)子泵組合活動形成的質(zhì)子梯度和膜電位效應(yīng)調(diào)控[3]。1992年, 在擬南芥中克隆出完整的H+-PPase的cDNA序列, 命名為, 目前已經(jīng)確定了3個基因編碼H+-PPase的同源物()[4]。2002年, 在擬南芥基因組中, 鑒定出至少26個編碼液泡型H+-ATPase亞單位的基因, 并命名這些基因為, X代表每個亞單位的字母代碼, 定位于膜上的為小寫字母。參與植物主要活性運(yùn)輸?shù)幕虮幻麨? 其中和定位于液泡膜上[1]。到目前為止, 在很多植物中已經(jīng)克隆出完整的H+-PPase cDNA序列[5], 但是在甘藍(lán)型油菜中卻少見報道。V-ATPase定位于分泌系統(tǒng)的液泡膜、內(nèi)質(zhì)網(wǎng)(ER)膜、高爾基體膜、小囊泡以及質(zhì)膜, 且V-ATPase復(fù)合物在所有真核生物中都是保守的[3]。3種質(zhì)子泵中, 液泡型H+-ATP酶功能和結(jié)構(gòu)最為復(fù)雜。
甘藍(lán)型油菜(L.)是由白菜()和甘藍(lán)()遠(yuǎn)緣雜交形成的異源四倍體作物, 全基因組的編碼基因數(shù)量龐大, 其進(jìn)化、遺傳的復(fù)雜性在一定程度上影響了各種功能基因在甘藍(lán)型油菜生長和發(fā)育中的作用[6]。本研究利用擬南芥、和基因序列, 在甘藍(lán)型油菜全基因組數(shù)據(jù)中鑒定其基因序列, 通過生物信息學(xué)方法研究甘藍(lán)型油菜和基因的分子特征、序列信息、保守基序特征、染色體定位、系統(tǒng)進(jìn)化關(guān)系、蛋白質(zhì)的結(jié)構(gòu), 旨在系統(tǒng)研究甘藍(lán)型油菜和基因的遺傳信息、編碼的蛋白結(jié)構(gòu), 為進(jìn)一步研究該家族基因的生物學(xué)功能奠定理論基礎(chǔ)。
1 材料與方法
1.1 試驗材料
擬南芥AVP1、VHA-a2和VHA-a3蛋白氨基酸序列下載自美國國立生物信息中心(NCBI)數(shù)據(jù)庫, 以、和為比對序列, 對NCBI收錄的甘藍(lán)型油菜基因組數(shù)據(jù)庫進(jìn)行BLASTN[7]搜索, 下載篩選到和基因編碼的氨基酸序列。
水培實驗所用的甘藍(lán)型油菜品種為湘油15。
1.2 試驗方法
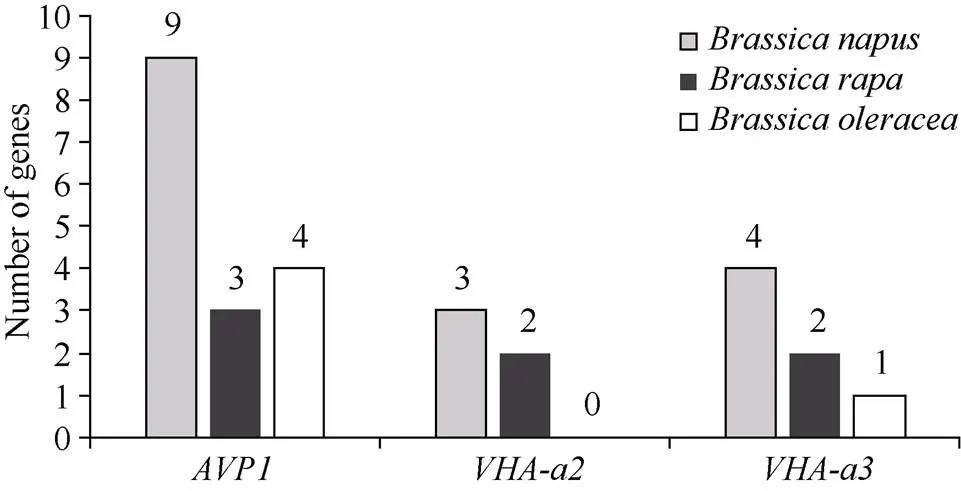
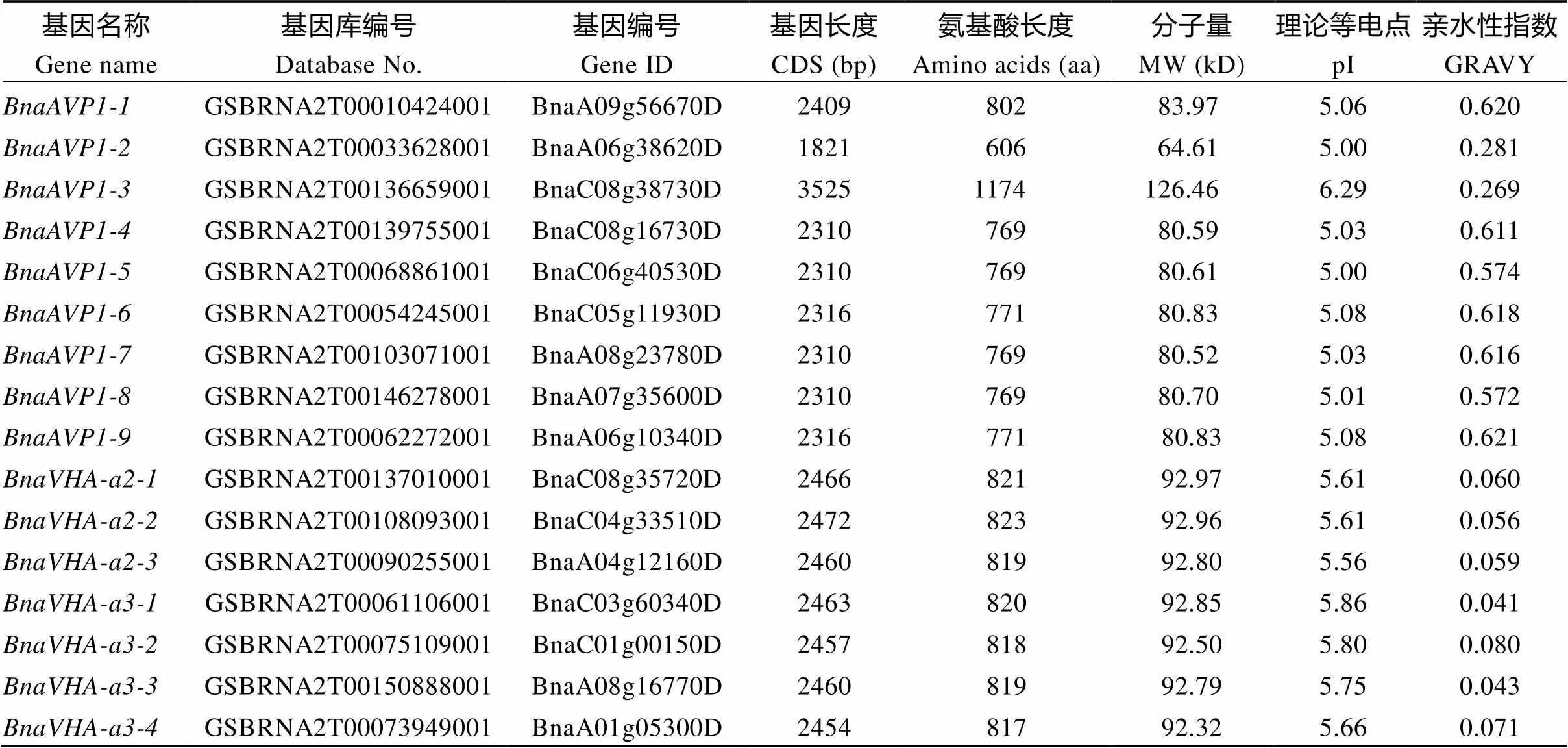
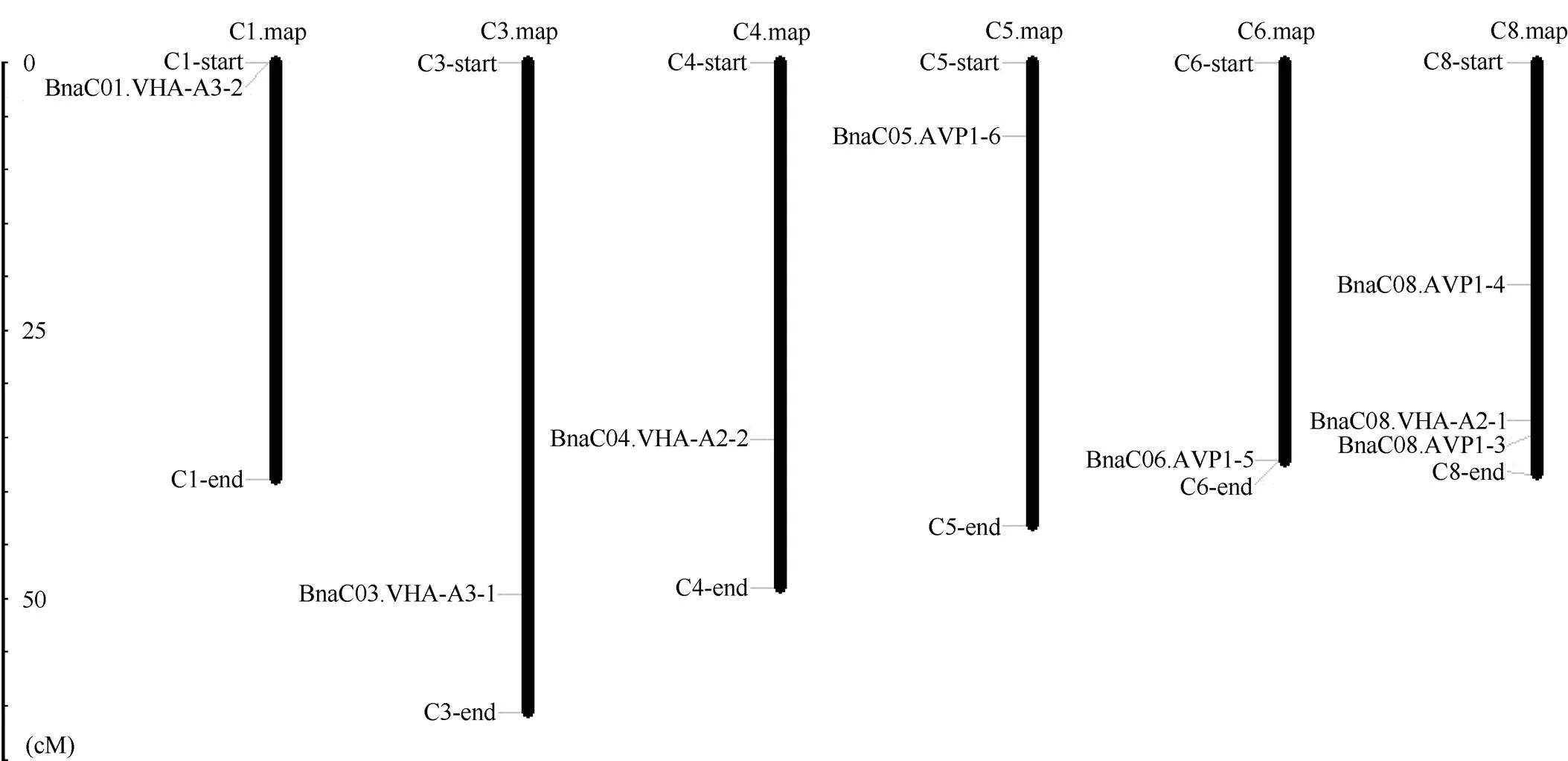
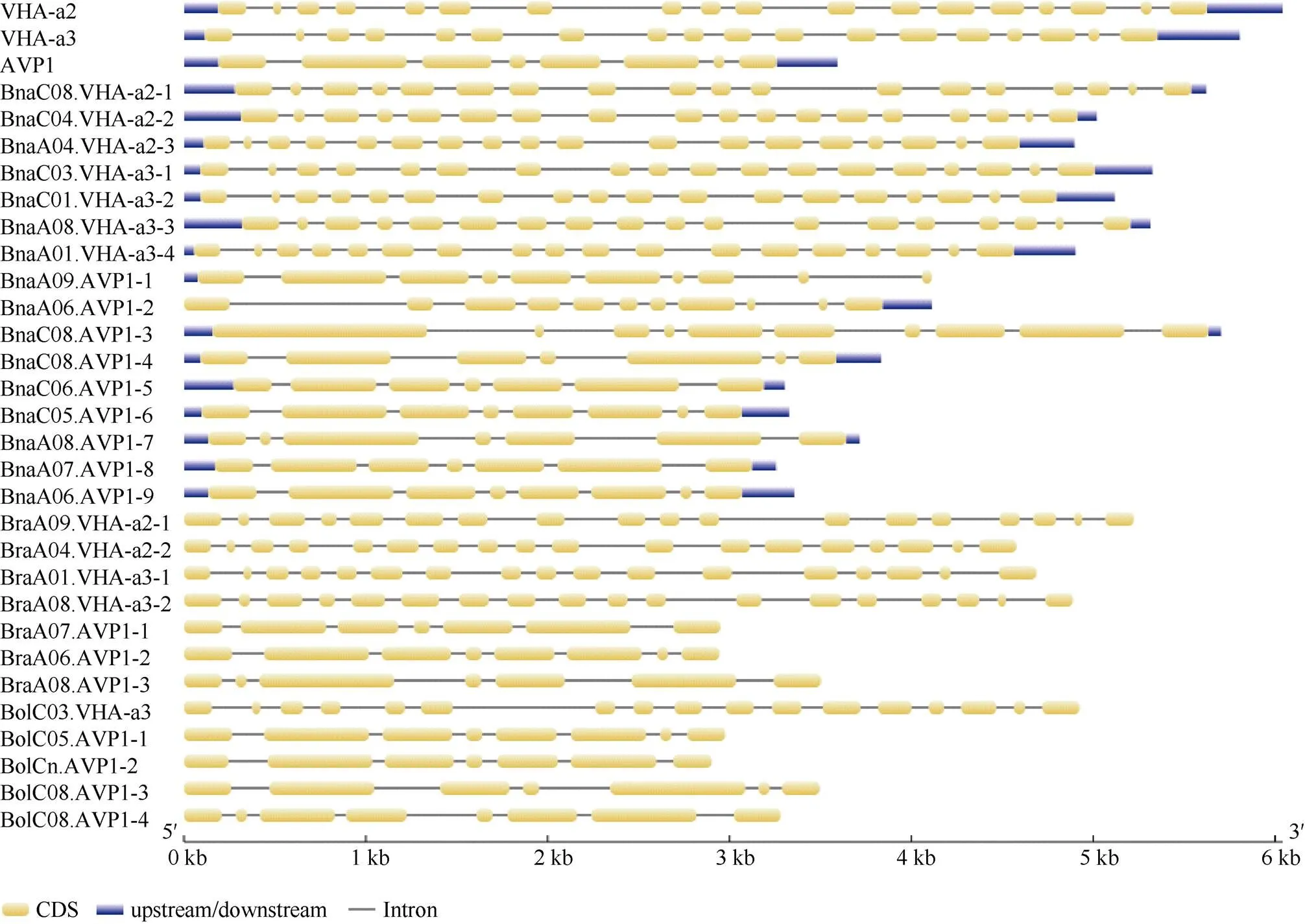
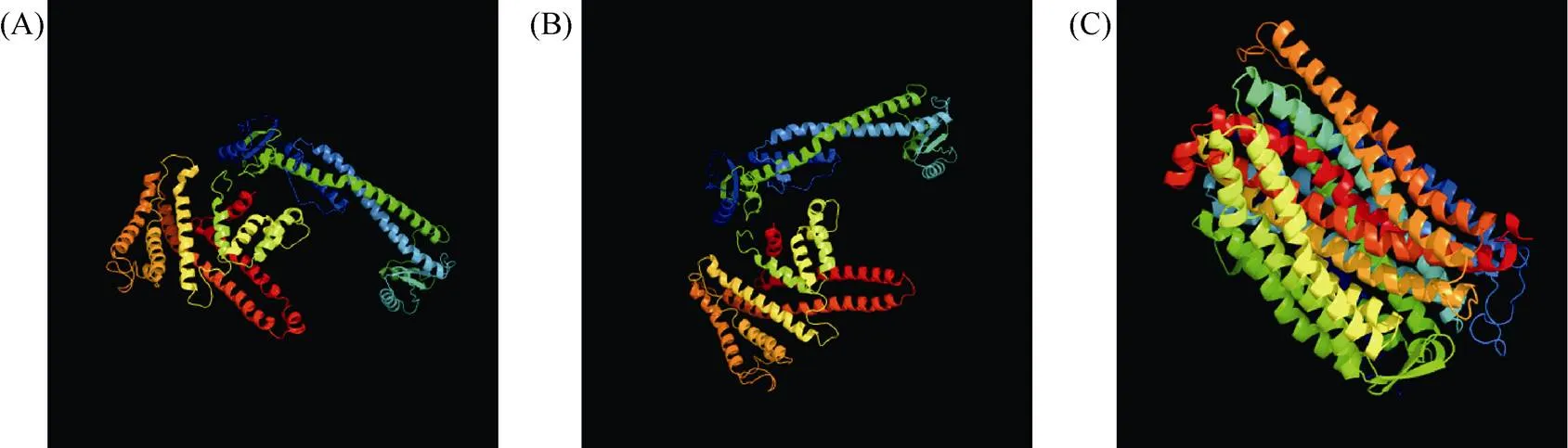
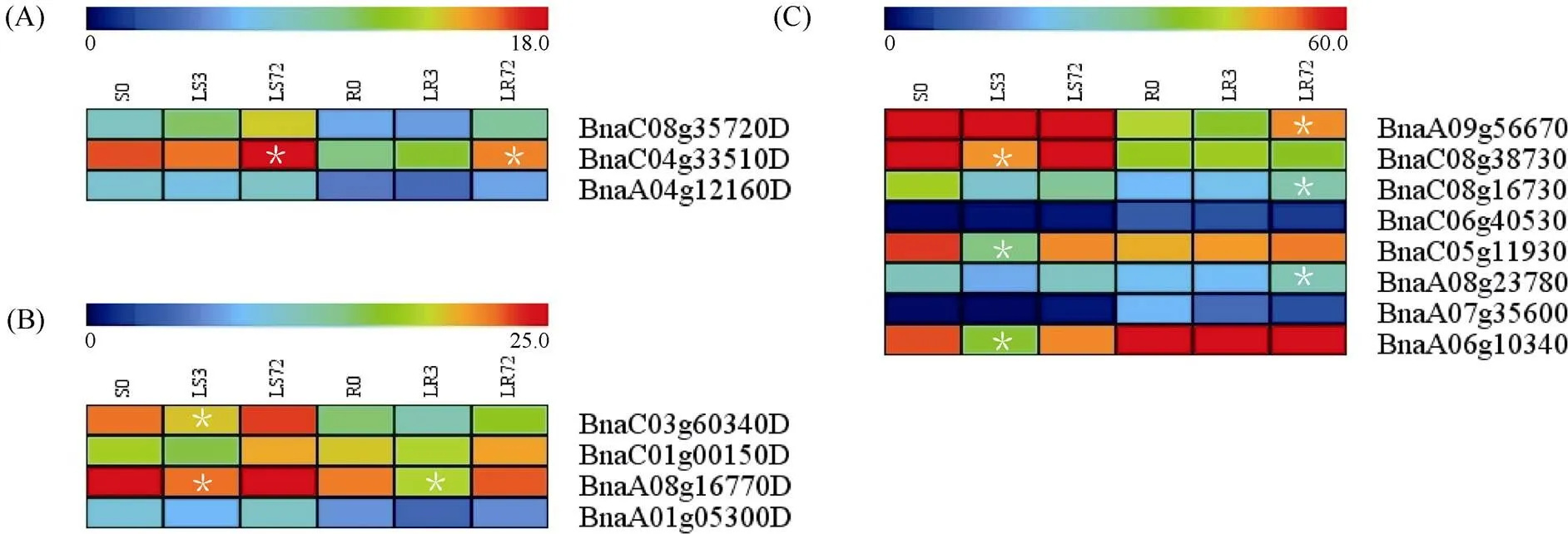
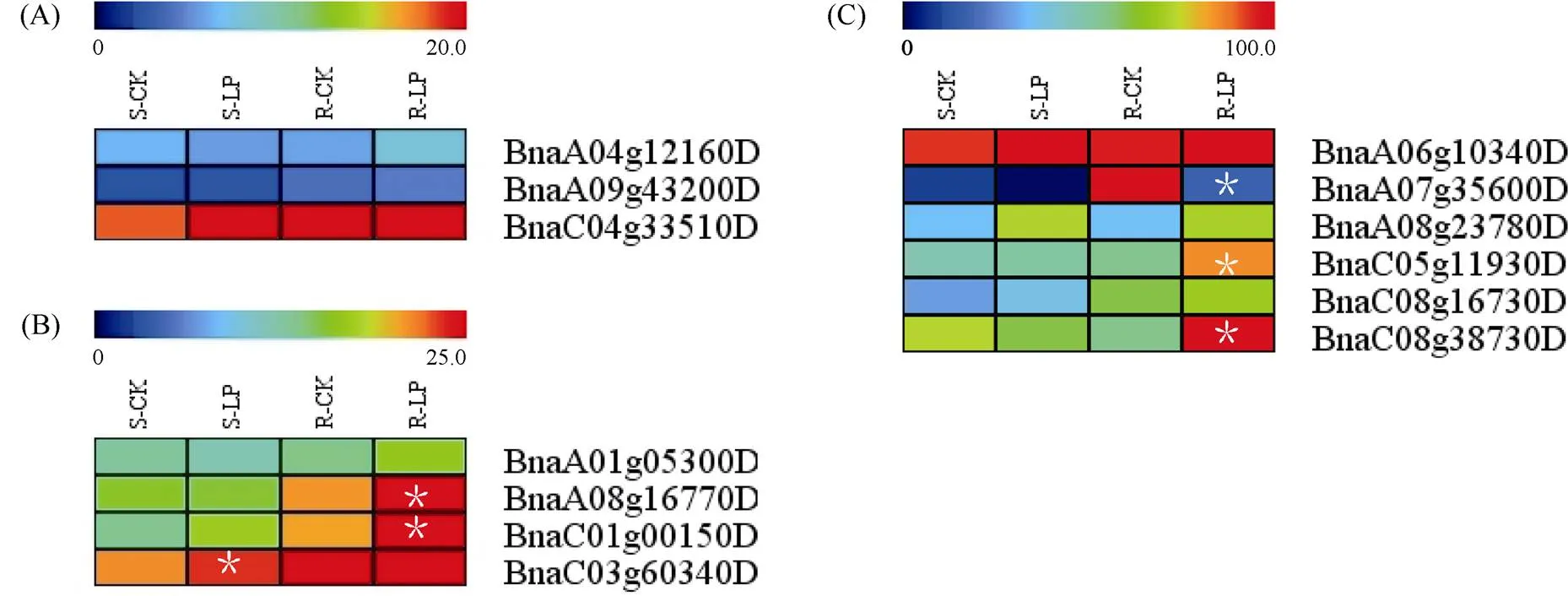
1.2.1 甘藍(lán)型油菜和基因的鑒定 首先以、和為原始序列, 使用在線工具Pfam[8](http://pfam.xfam. org/)和SMART[9](http://smart.em-bl-heidelberg.de/)分析、和序列, 分析結(jié)果顯示, AtAVP1、AtVHA-a2和AtVHA-a3具有的跨膜結(jié)構(gòu)域; 其次, 下載甘藍(lán)型油菜、白菜、甘藍(lán)全基因組數(shù)據(jù)(http://brassicadb.org/brad/), 并利用Bio Edit軟件構(gòu)建本地數(shù)據(jù)庫, 以、和的Mem-trans為檢索序列, 設(shè)定檢索參數(shù)為E值 1.2.2 甘藍(lán)型油菜AVP1、VHA-a2和VHA-a3蛋白的分子特性分析 采用ExPASy ProtoParam (https://web.expasy.org/protparam/)[10]在線軟件預(yù)測甘藍(lán)型油菜AVP1、VHA-a2和VHA-a3蛋白的氨基酸數(shù)目和組成、相對分子量(MW)、理論等電點(pI)、蛋白質(zhì)的親水性(GRAVY)及穩(wěn)定性等理化性質(zhì)。 1.2.3 甘藍(lán)型油菜AVP1、VHA-a2和VHA-a3蛋白的進(jìn)化選擇壓力分析 為了研究AVP1、VHA-a2和VHA-a3蛋白在物種進(jìn)化過程中是否涉及達(dá)爾文的選擇, 對甘藍(lán)型油菜中和的CDS序列和蛋白序列進(jìn)行比對, 利用在線軟件PAL2NAL (http://www.bork.embl.de/pal2nal/)計算核苷酸的同義突變頻率(synonymous, Ks)和非同義突變頻率(non-synonymous, Ka), 并計算非同義突變頻率與同義突變頻率的比值即Ka/Ks。 1.2.4 保守結(jié)構(gòu)域和保守殘基的鑒定 使用SMART (http://smart.emblheidelberg.de/)[9]鑒定保守結(jié)構(gòu)域, 并使用Pfam (http://pfam.xfam.org/)注釋[8]。使用Vector NTI對保守殘基進(jìn)行多重比對分析。 1.2.5 甘藍(lán)型油菜AVP1、VHA-a2和VHA-a3蛋白保守基序分布信息獲取 運(yùn)用MEME Version 4.9.1 (http://meme.nbcr.net/meme/cgi-bin/meme.cgi)[11]在線工具分析甘藍(lán)型油菜AVP1、VHA-a2和VHA-a3蛋白的保守基序信息, 設(shè)置最大基序檢索值為10。 1.2.6 AVP1、VHA-a2和VHA-a3的系統(tǒng)進(jìn)化樹構(gòu)建 運(yùn)用Clustal X version 2.1[12]軟件對甘藍(lán)型油菜、擬南芥、甘藍(lán)、白菜以及部分其他物種的AVP1、VHA-a2和VHA-a3蛋白的氨基酸序列進(jìn)行多重比對, 使用 MEGA6.0[13]軟件分析比對結(jié)果并采用鄰接法(Neighbor-Joining, NJ)構(gòu)建系統(tǒng)進(jìn)化樹, 設(shè)定泊松校正法計算進(jìn)化距離和進(jìn)行重復(fù)1000次的自展法(bootstrap)檢驗。 1.2.7 甘藍(lán)型油菜和基因染色體定位分析 選取甘藍(lán)型油菜全基因組數(shù)據(jù)庫(http://brassicadb.org/brad/)用于甘藍(lán)型油菜和基因的篩選。利用Pfam[8](http://pfam.xfam.org/)對篩選到的和基因進(jìn)行結(jié)構(gòu)域判定, 去除冗余基因, 確定位置信息, 利用Circos 0.6[14]構(gòu)建和基因染色體分布圖譜。 1.2.8 甘藍(lán)型油菜AVP1、VHA-a2和VHA-a3蛋白的二級結(jié)構(gòu)分析及三維結(jié)構(gòu)預(yù)測 使用GOR4 (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)[15]和PSIPRED (http://bioinf.cs. ucl.ac.uk/web_servers/)[16-17]2種不同的工具分析二級結(jié)構(gòu)。使用Phyre2 (http://www.sbg.bio.ic.ac.uk/~ phyre2/html/)[18]預(yù)測BnaAVP1、BnaVHA-a2和BnaVHA-a3蛋白的三維結(jié)構(gòu)。 1.2.9 營養(yǎng)液培養(yǎng)實驗 油菜苗期營養(yǎng)液培養(yǎng)試驗在湖南農(nóng)業(yè)大學(xué)植物營養(yǎng)與養(yǎng)分高效利用課題組光照培養(yǎng)室中進(jìn)行。光照培養(yǎng)室的溫度設(shè)置為22oC, 光照周期為14 h (光照)/10 h (黑暗), 光照強(qiáng)度為300~320 μmol m–2s–1, 濕度為60%~75%。選取大小一致的油菜種子, 使用1% NaClO滅菌處理10 min, 將種子表面沖洗干凈后, 于4oC下用滅菌超純水(>18.25 MΩ)浸泡24 h。將浸泡過后的種子均勻播種到塑料育苗盤表面固定的紗布上, 育苗盤中加適量超純水。育苗1周后, 將長勢一致的幼苗移栽至盛有10 L營養(yǎng)液的黑色塑料盆中, 營養(yǎng)液為1/4濃度采用Hoagland營養(yǎng)液[19]。 1.2.10 低氮處理高通量轉(zhuǎn)錄組測序試驗 油菜幼苗先在正常氮條件下培養(yǎng)10 d, 然后轉(zhuǎn)至0.3 mmol L-1NO3-培養(yǎng), 0、3和72 h后用離心管取樣, 樣品先裝入液氮罐中速凍, 后移入-80oC冰箱保存待測, 每個處理3個獨立的生物學(xué)重復(fù)。測序平臺為 Illumina Hiseq 2000[20], 其產(chǎn)生6.0 Gb測序數(shù)據(jù), 每個樣品具有150 bp配對末端(PE)讀數(shù), 轉(zhuǎn)錄組豐度(FPKM值)由RNA-seq數(shù)據(jù)確定[21]。使用(Mev, http://www.tm4.org/mev.html)[22]繪制基因表達(dá)譜的熱圖, 使用錯誤發(fā)現(xiàn)率(FDR)≤0.05和log2(倍數(shù)變化)≥1作為鑒定差異表達(dá)基因的閾值。 1.2.11 低磷處理高通量轉(zhuǎn)錄組測序試驗 油菜幼苗先在250 μmol L-1Pi (KH2PO4)營養(yǎng)液中培養(yǎng)10 d, 再將油菜樣品分成2組, 一組繼續(xù)在正常營養(yǎng)液中培養(yǎng), 另一組轉(zhuǎn)移至無磷的營養(yǎng)液中培養(yǎng)5 d, 分別對2組樣品的地上部(S)和根(R)取樣, 將樣品先裝入液氮罐中速凍, 后移入-80oC冰箱保存待測, 每個處理3個獨立的生物學(xué)重復(fù)。測序平臺為Illumina Hiseq 2000[20], 其產(chǎn)生6.0 Gb測序數(shù)據(jù), 每個樣品具有150 bp配對末端(PE)讀數(shù), 轉(zhuǎn)錄組豐度(FPKM值)由RNA-seq數(shù)據(jù)確定[21]。使用(Mev, http://www.tm4. org/mev.html)[22]繪制基因表達(dá)譜的熱圖, 使用錯誤發(fā)現(xiàn)率(FDR)≤0.05和log2(倍數(shù)變化)≥1作為鑒定差異表達(dá)基因的閾值。 基因的拷貝數(shù)與基因組大小密切相關(guān), 為了比較十字花科作物和基因的進(jìn)化多樣性, 以AtAVP1、AtVHA-a2和AtVHA-a3的氨基酸序列為查詢對象, 對NCBI數(shù)據(jù)庫進(jìn)行BLASTN搜索, 在異源四倍體甘藍(lán)型油菜中鑒定了9個3個和4個, 且基因數(shù)量明顯多于甘藍(lán)和白菜(圖1)。可能是由于甘藍(lán)型油菜是由白菜和甘藍(lán)遠(yuǎn)緣雜交形成的異源四倍體作物, 其進(jìn)化和遺傳遠(yuǎn)比白菜和甘藍(lán)復(fù)雜[6]。 由表1可知,基因編碼區(qū)長度在1821 bp ()~3525 bp ()之間, 編碼606~1174個氨基酸, 預(yù)測蛋白質(zhì)的理論分子量為64.61~126.46 kD; 理論等電點(pI)為5.01~6.29, 為酸性蛋白;基因編碼區(qū)長度平均為821, 編碼823個氨基酸, 預(yù)測其分子量是92.96 kDa, 理論等電點(pI)為5.61左右, 為酸性蛋白;基因編碼區(qū)長度在2454 bp ()~2463 bp ()之間, 編碼817~820個氨基酸, 預(yù)測蛋白質(zhì)的理論分子量為92.32~92.85 kD; 理論等電點(pI)為5.66~5.86, 為酸性蛋白。根據(jù)親水性指數(shù)介于-0.5~0.5為兩性蛋白(GRAVY為負(fù)值表示親水性, 正值表示疏水性)的原則[23], 對于BnaAVP1成員, 僅有BnaAVP1-2和BnaAVP1-3是兩性蛋白外, 其余均為疏水性蛋白, 而BnaVHA-a2和BnaVHA-a3蛋白均為兩性蛋白。 圖1 甘藍(lán)型油菜、甘藍(lán)、白菜AVP1、VHA-a2和VHA-a3基因的拷貝數(shù)變異 柱狀圖頂部數(shù)值為該物種拷貝的基因數(shù)目。 The number at the top of the histogram is the number of genes copied for that species. 表1 甘藍(lán)型油菜AVP1、VHA-a2和VHA-a3基因成員信息 在遺傳學(xué)中認(rèn)為, Ka/Ks的比例是判斷這個基因在進(jìn)化中是否受到選擇壓力的一個指標(biāo)。當(dāng)Ka/Ks>1.0時, 認(rèn)為有正選擇效應(yīng); 當(dāng)Ka/Ks=1.0時, 認(rèn)為該蛋白存在中性選擇; 當(dāng)Ka/Ks<1.0時, 則認(rèn)為存在純化選擇作用[24]。由圖2可知, AVP1、VHA-a2和VHA-a3在甘藍(lán)型油菜中的Ka/Ks值均小于1.0, 表明這3種蛋白在物種進(jìn)化過程中為保留其重要功能而存在純化選擇作用。 甘藍(lán)型油菜和基因染色體定位分析發(fā)現(xiàn), 3個基因的成員分布于甘藍(lán)型油菜基因組A/C亞基因組上, 但不是均勻分布。的9個成員中,和位于A6染色體上,位于A7染色體上,位于A8染色體上,位于A9染色體上,位于C5染色體上,位于C6染色體上,和位于C8染色體上。的3個成員中,位于A4染色體上,位于C4染色體上,位于C8染色體上。的4個成員中,位于A1染色體上,位于A8染色體上,位于C1染色體上,位于C3染色體上(圖3)。 保守基序分析發(fā)現(xiàn)甘藍(lán)型油菜AVP1蛋白的N末端具有保守基序數(shù)1 (Motif 1), 而VHA-a2和VHA-a3則具有相同的N末端保守蛋白和保守基序數(shù)。對于甘藍(lán)型油菜AVP1蛋白, 其保守基序數(shù)量變化范圍為1~10, 具有一定規(guī)律: 除了BnaAVP1-2外, 其他系列都含有10個基序, 此外BnaAVP1-3的Motif8所在保守序列的位置不同于其他蛋白。此外, 研究還發(fā)現(xiàn)BraAVP1-3的保守基序數(shù)8缺失。對于甘藍(lán)型油菜蛋白VHA-a2和VHA-a3, 均有相同的N末端保守蛋白和保守基序數(shù)(圖4)。 圖2 甘藍(lán)型油菜中BnaAVP1、BnaVHA-a2和BnaVHA-a3蛋白的同義突變頻率和非同義突變頻率 (圖3) 圖3 甘藍(lán)型油菜AVP1、VHA-a2和VHA-a3基因染色體定位 圖4 甘藍(lán)型油菜、擬南芥、白菜以及甘藍(lán)的AVP1、VHA-a2和VHA-a3蛋白家族成員的保守基序分布 通過將編碼序列與蕓薹屬作物中相應(yīng)基因組序列的比對來確定和基因的外顯子-內(nèi)含子結(jié)構(gòu), 由圖5可知, 蕓薹屬作物中基因的內(nèi)含子-外顯子結(jié)構(gòu)與擬南芥中的同源物相似, 大多數(shù)基因被6~10個內(nèi)含子間隔;和基因的外顯子-內(nèi)含子結(jié)構(gòu)與擬南芥中的同源物也相似, 均含有17個內(nèi)含子。 為確定不同物種中AVP1、VHA-a2和VHA-a3蛋白質(zhì)之間的分子進(jìn)化和系統(tǒng)發(fā)育關(guān)系, 基于來自14種植物的蛋白質(zhì)序列構(gòu)建了無根系統(tǒng)發(fā)育樹(圖6)。結(jié)果表明, 對于BnaAVP1的成員, BnaAVP1-1和BnaAVP1-3、BnaAVP1-4、BnaAVP1-5分別與BolAVP1-4、BolAVP1-3、BolAVP1-2關(guān)系緊密, BnaAVP1-6和BnaAVP1-9與BolAVP1-1和BraAVP1-2關(guān)系緊密, BnaAVP1-7與BraAVP1-3關(guān)系緊密, BnaAVP1-8與BraAVP1-1關(guān)系緊密, 而BnaAVP1-2則與其他成員關(guān)系不緊密。對于BnaVHA-a2成員, BnaVHA-a2-1、BnaVHA-a2-2和BnaVHA-a2-3與BraVHA-a2-1、BraVHA-a2-2關(guān)系緊密。BnaVHA-a3成員中, BnaVHA-a3-1和BolVHA-a3關(guān)系緊密, BnaVHA-a3-3與BraVHA-a3-2, 而BnaVHA-a3-2、BnaVHA-a3-4與BraVHA-a3-1關(guān)系緊密, 說明甘藍(lán)型油菜VHA-a2和VHA-a3蛋白更多地遺傳于白菜。 使用GOR4和SPIPRED進(jìn)行BnaVHA-a2蛋白的二級結(jié)構(gòu)分析, GOR4和SPIPRED預(yù)測結(jié)構(gòu)類似(圖7)。運(yùn)用Phyre2數(shù)據(jù)庫、分析的保守氨基酸殘基和AVP1、VHA-a2和VHA-a3的蛋白二級結(jié)構(gòu)對BnaAVP1、BnaVHA-a2和BnaVHA-a3蛋白進(jìn)行三級結(jié)構(gòu)預(yù)測(圖8)。由BnaVHA-a2-1蛋白二級結(jié)構(gòu)和BnaVHA-a2-1、BnaVHA-a3-1、BnaAVP1-1蛋白三級預(yù)測結(jié)構(gòu)可知, α螺旋是BnaAVP1s、BnaVHA-a2s和BnaVHA-a3s 蛋白的主要結(jié)構(gòu), BnaVHA-a2s和BnaVHA-a3s蛋白三級結(jié)構(gòu)相似, 與BnaAVP1s結(jié)構(gòu)有較大差異, 這可能導(dǎo)致了其功能的差異性。 圖5 甘藍(lán)型油菜、擬南芥、白菜以及甘藍(lán)的AVP1、VHA-a2和VHA-a3基因外顯子-內(nèi)含子結(jié)構(gòu) 圖6 甘藍(lán)型油菜BnaAVP1、BnaVHA-a2和BnaVHA-a3蛋白的進(jìn)化分析 藍(lán)色代表BnaAVP1家族, 綠色代表BnaVHA-a3家族, 紅色代表BnaVHA-a2家族。 Blue represents the BnaAVP1 family, green represents the BnaVHA-a3 family, and red represents the BnaVHA-a2 family. 氮元素是蛋白合成的基本元素, 也是植物生長發(fā)育所必需的營養(yǎng)元素。為了確定和對低氮是否存在響應(yīng), 本研究對短期(3 h)和長期(72 h)低氮培養(yǎng)的甘藍(lán)型油菜地上部和根進(jìn)行了高通量轉(zhuǎn)錄組測序。結(jié)果表明,基因主要在地上部表達(dá), 其中和在根部和地上部均有表達(dá),在低氮處理3 h后地上部表達(dá)下調(diào), 在低氮處理72 h后根中表達(dá)上調(diào), 部分有顯著差異(圖9-C)。和基因在地上部和根中均有表達(dá),在低氮處理72 h后表達(dá)量基本呈上調(diào)趨勢,達(dá)到顯著差異(圖9-A),在低氮3 h后基本呈下調(diào)趨勢, 少數(shù)達(dá)到顯著差異(圖9-B)。 磷元素是植物生長發(fā)育所必需的營養(yǎng)元素。為了確定和對低磷是否存在響應(yīng), 本研究對低磷培養(yǎng)的甘藍(lán)型油菜地上部和根進(jìn)行了高通量轉(zhuǎn)錄組測序。結(jié)果表明, 低磷處理后,基因在根中大部分表達(dá)上調(diào), 而在地上部基因表達(dá)基本無差異(圖10-C)。在低磷處理后基本無差異(圖10-A)。基因在地上部和根中均有表達(dá), 在低磷處理后表達(dá)上調(diào)較多, 且部分達(dá)到顯著差異(圖10-B)。 圖7 甘藍(lán)型油菜BnaVHA-a2-1蛋白二級結(jié)構(gòu)分析 GOR4 (A)和PSIPRED (B)分別是進(jìn)行二級結(jié)構(gòu)分析的2種不同的工具。 GOR4 (A) and PSIPRED (B) are two tools for the secondary structure analysis. 圖8 甘藍(lán)型油菜BnaAVP1、BnaVHA-a2和BnaVHA-a3蛋白三級結(jié)構(gòu)預(yù)測 A: BnaVHA-a2-1; B: BnaVHA-a3-1; C: BnaAVP1-1. 圖9 在低氮條件下甘藍(lán)型油菜BnaAVP1、BnaVHA-a2和BnaVHA-a3家族的轉(zhuǎn)錄組分析。 S: 地上部; R: 根; 0、3、72 (h)代表缺氮脅迫的時間。圖中結(jié)果表示3次生物學(xué)重復(fù)的平均值。*代表有顯著差異。 S: shoot; R: root; 0, 3, and 72 (h) represent the time course of nitrogen deficiency. The results represent the average of three biological replicates. * represent significant differences. (A): BnaVHA-a2s; (B): BnaVHA-a3s; (C): BnaAVP1s. 圖10 在低磷條件下甘藍(lán)型油菜BnaAVP1、BnaVHA-a2和BnaVHA-a3家族的轉(zhuǎn)錄組分析 S: 地上部; R: 根。CK代表正常條件, LP代表低磷脅迫。圖中結(jié)果表示3次生物學(xué)重復(fù)的平均值。*代表有顯著差異。 S: shoot; R: root; CK represent normal condition and LP represent low phosphorus stress. The results represent the average of three biological replicates. * represent significant differences. (A): BnaVHA-a2s; (B): BnaVHA-a3s; (C): BnaAVP1s. 細(xì)胞的伸長和分裂是植物生長發(fā)育的必然過程,在這一過程中, 液泡是調(diào)控細(xì)胞內(nèi)外壓力平衡以及物質(zhì)代謝的主要器官。植物體內(nèi)3種質(zhì)子泵中VHA (V-H+-ATPase)的功能和結(jié)構(gòu)最為復(fù)雜; 對于AVP即H+-PPase (V-H+-PPase), 目前認(rèn)為有3種編碼H+-PPase的基因, 其中1種基因編碼I型酶, 叫做AVP1, 定位于液泡, 另2種編碼II型酶, 叫做AVP2-1和AVP2-2, 定位于高爾基體膜[25]。AVP1蛋白水解產(chǎn)生能量并使液泡酸化, 有研究表明, 擬南芥突變體中根、芽、花的生長受到嚴(yán)重影響并導(dǎo)致敗育, 主要是因為擬南芥AVP1除了酸化液泡外, 還控制植物生長素的運(yùn)輸[26-27]。甘藍(lán)型油菜作為旱地作物, 主要以硝態(tài)氮為氮素營養(yǎng), 并累積在液泡中, 這種氮素利用特性導(dǎo)致根際土壤pH升高, 而液泡型質(zhì)子泵的水解會減輕鹽分過高造成的生理干旱[28],基因的表達(dá), 也調(diào)控著甘藍(lán)型油菜的氮代謝循環(huán)。本文以基因功能已知的擬南芥基因為參考序列, 篩選出9條基因, 發(fā)現(xiàn)甘藍(lán)型油菜在白菜和甘藍(lán)遠(yuǎn)緣雜交后遺傳完好, 且數(shù)量明顯多于甘藍(lán)和白菜; 進(jìn)一步的信息和序列分析發(fā)現(xiàn), 其編碼的氨基酸均為酸性氨基酸, 且大部分為疏水性蛋白; 染色體定位表明,基因分布于甘藍(lán)型油菜基因組A/C亞基因組上, 且甘藍(lán)型油菜的基因與甘藍(lán)基因關(guān)系緊密。 近年來, 已在植物基因功能的發(fā)現(xiàn)和挖掘方面做了大量的研究工作, 從轉(zhuǎn)錄合成到對植物的生理調(diào)控都有了一定的了解, 甜菜中基因的A亞基的啟動子在NaCl存在下活性增高, 轉(zhuǎn)錄量增加[29]; 鹽脅迫下, 擬南芥和竹子A亞基轉(zhuǎn)錄水平增加2~4倍, 而番茄中A亞基轉(zhuǎn)錄水平瞬時增加, 且在持續(xù)處理3 d后恢復(fù)到對照水平[30]。本文篩選出的3條和4條甘藍(lán)型油菜基因, 在白菜和甘藍(lán)遠(yuǎn)緣雜交后遺傳完好, 且數(shù)量多于甘藍(lán)和白菜, BnaVHA-a2和BnaVHA-a3均為兩性蛋白, 且甘藍(lán)型油菜和基因也與甘藍(lán)關(guān)系緊密。 旱地作物主要吸收硝態(tài)氮來合成體內(nèi)有機(jī)代謝物, 而質(zhì)子泵在這一過程中起著重要的調(diào)控作用, 質(zhì)子泵的活性在銨態(tài)氮營養(yǎng)下明顯高于在硝態(tài)氮下, 這與銨和硝態(tài)氮的吸收方式有關(guān)[31], 同時也與這2種氮素形態(tài)在細(xì)胞內(nèi)的同化過程有關(guān)。在銨態(tài)氮營養(yǎng)下根系質(zhì)子泵提高是一種必然的現(xiàn)象, 主要是因為銨態(tài)氮的吸收促進(jìn)了質(zhì)子泵的活性, 進(jìn)而分泌質(zhì)子來平衡細(xì)胞內(nèi)外電荷和離子平衡[32]。硝酸鹽從細(xì)胞質(zhì)進(jìn)入液泡主要靠液泡膜上的H+/NO3–通道運(yùn)輸來完成, 而液泡膜上硝酸鹽與其他陰離子構(gòu)成的通道則有利于液泡中硝酸鹽向細(xì)胞質(zhì)的轉(zhuǎn)移, 細(xì)胞質(zhì)中高濃度的NO3–-N對液泡膜H+-ATPase有抑制作用, 隨著細(xì)胞質(zhì)內(nèi)NO3-趨于耗盡, 抑制作用被解除, H+-ATPase活性恢復(fù), 建立起新的質(zhì)子梯度, 從而推動NO3–/H+共運(yùn)轉(zhuǎn), 使液泡內(nèi)的NO3–外排至細(xì)胞質(zhì)[33-34]。這一觀點與本文的研究結(jié)果一致, 本研究中, 隨著低氮處理的時間增加, 3種質(zhì)子泵的表達(dá)量均表現(xiàn)為先下降后上升的趨勢。基于目前的研究, 不同質(zhì)子泵的不同家族成員在甘藍(lán)型油菜體內(nèi)的表達(dá)部位不同, 我們將進(jìn)一步探究甘藍(lán)型油菜生長過程中質(zhì)子泵家族基因之間的關(guān)系及其在氮素吸收利用過程中的調(diào)控機(jī)制, 以期從質(zhì)子調(diào)控角度為甘藍(lán)型油菜氮素養(yǎng)分利用過程提供理論指導(dǎo)。 十字花科作物的和拷貝數(shù)存在著差異, 異源四倍體作物甘藍(lán)型油菜的和同源基因數(shù)量明顯多于系統(tǒng)進(jìn)化關(guān)系相近的甘藍(lán)和白菜,、和基因分別位于A/C亞基因組的不同染色體上, 均有N末端保守結(jié)構(gòu), 所翻譯蛋白多為兩性蛋白; 另一方面, 甘藍(lán)型油菜的基因多與甘藍(lán)關(guān)系緊密, 而和基因與白菜關(guān)系更緊密。在低氮和低磷條件下, 3個基因的表達(dá)也存在著差異,基因在低氮條件下地上部表達(dá)下調(diào), 而根中基因在2個處理下表達(dá)均上調(diào);在低氮條件下基本呈上調(diào)趨勢, 但在低磷處理后卻無明顯差異;在低氮條件下下調(diào), 而低磷處理條件下表達(dá)上調(diào)較多。 [1] Sze H, Schumacher K, Müller M L, Padmanaban S, Taiz L. A simple nomenclature for a complex proton pump:genes encode the vacuolar H+-ATPase., 2002, 7: 157–161. [2] Sze H, Li X, Palmgren M G. Energization of plant cell membranes by H+-pumping ATPases: regulation and biosynthesis., 1999, 11: 677–689. [3] Schumacher K. pH in the plant endomembrane system: an import and export business., 2014, 22: 71–76. [4] Drozdowicz Y M, Rea P A. Vacuolar H+pyrophosphatases: from the evolutionary backwaters into the mainstream., 2001, 6: 206–211. [5] Maeshima M. Tonoplast transporters: organization and function., 2001, 52: 469–497. [6] Bayer P E, Hurgobin B, Golicz A A, Chan C K K, Yuan Y, Lee H, Zou J. Assembly and comparison of two closely related Brassica napus genomes., 2017, 15: 1602–1610. [7] Altschul S F, Gish W, Miller W, Myers E W, Lipman D J. Basic local alignment search tool., 1990, 215: 403–410. [8] Finn R D, Bateman A, Clements J, Coggill P, Eberhardt R Y, Eddy S R, Sonnhammer E L. Pfam: the protein families database., 2013, 42: D222–D230. [9] Letunic I, Doerks T, Bork P. SMART: recent updates, new developments and status in 2015., 2014, 43: D257–D260. [10] Gasteiger E, Gattiker A, Hoogland C, Ivanyi I, Appel R D, Bairoch A. ExPASy: the proteomics server for in-depth protein knowledge and analysis., 2003, 31: 3784–3788. [11] Bailey T, Lelka N. Fitting a mixture model by expectation maximization to discover motifs in biopolymers., 1994, 4: 28–36. [12] Aiyar A. The use of CLUSTAL W and CLUSTAL X for multiple sequence alignment., 2000, 132: 221–241. [13] Kumar S, Nei M, Dudley J, Tamura K. MEGA: a biologist-centric software for evolutionary analysis of DNA and protein sequences., 2008, 9: 299–306. [14] Krzywinski M I, Schein J E, Birol I, Connors J, Gascoyne R, Horsman D, Marra M A. Circos: an information aesthetic for comparative genomics., 2009, 19: 1639–1645. [15] Combet C, Blanchet C, Geourjon C, Deleage G. NPS@: network protein sequence analysis., 2000, 25: 147–150. [16] Jones D T. Protein secondary structure prediction based on position-specific scoring matrices., 1999, 292: 195–202. [17] Buchan D W, Minneci F, Nugent T C, Bryson K, Jones D T. Scalable web services for the PSIPRED Protein Analysis Workbench., 2013, 41: W349–W357. [18] Mezulis S, Sternberg M J, Kelley L A. PhyreStorm: A web server for fast structural searches against the PDB., 2016, 428: 702–708. [19] Hoagland D R, Arnon D I. The water culture method for growing plants without soil., 1950, 347: 4–32. [20] Morin R D, Bainbridge M, Fejes A, Hirst M, Krzywinski M, Pugh T J, Marra M A. Profiling the HeLa S3 transcriptome using randomly primed cDNA and massively parallel short-read sequencing., 2008, 45: 81–94. [21] Hua Y, Feng Y, Zhou T, Xu F. Genome-scale mRNA transcriptomic insights into the responses of oilseed rape (L.) to varying boron availabilities., 2017, 416: 205– 225. [22] Eisen M B, Spellman P T, Brown P O, Botstein D. Cluster analysis and display of genome-wide expression patterns., 1998, 95: 14863–14868. [23] Kohl M, Wiese S, Warscheid B. Cytoscape: software for visualization and analysis of biological networks.2011, 696: 291–303. [24] Nekrutenko A, Makova K D, Li W H. TheA/Sratio test for assessing the protein-coding potential of genomic regions: an empirical and simulation study., 2002, 12: 198–202. [25] Segami S, Nakanishi Y, Sato M H, Maeshima M. Quantification, organ-specific accumulation and intracellular localization of type II H+-pyrophosphatase in Arabidopsis thaliana., 2010, 51: 1350–1360. [26] Li J, Yang H, Peer W A, Richter G, Blakeslee J, Bandyopadhyay A, Krizek B. Arabidopsis H+-PPase AVP1 regulates auxin- mediated organ development., 2005, 310: 121–125. [27] Gaxiola R A, Palmgren M G, Schumacher K. Plant proton pumps., 2007, 581: 2204–2214. [28] Beyenbach K W, Wieczorek H. The V-type H+ATPase: molecular structure and function, physiological roles and regulation., 2006, 209: 577–589. [29] Narasimhan M L, Binzel M L, Perez-Prat E, Chen Z, Nelson D E, Singh N K, Hasegawa P M. NaCl regulation of tonoplast ATPase 70-kilodalton subunit mRNA in tobacco cells., 1991, 97: 562–568. [30] Binzel M L, Dunlap J R. Abscisic acid does not mediate NaCl-induced accumulation of 70-kDa subunit tonoplast H+-ATPase message in tomato., 1995, 197: 563–568. [31] Yamashita K, Kasai M, Ezaki B, Shibasaka M, Yamamoto Y, Matsumoto H, Sasakawa H. Stimulation of H+extrusion and plasma membrane H+-ATPase activity of barley roots by ammonium-treatment., 1995, 41: 133–140. [32] 周金泉, 張明超, 魏志軍, 胡軍, 朱毅勇. 高粱分泌硝化抑制物對羥基苯丙酸與質(zhì)子泵的關(guān)系研究. 土壤學(xué)報, 2015, 52: 620–627. Zhou J Q, Zhang M C, Wei Z J, Hu J, Zhu Y Y. Relationship between exudation of nitrification inhibitor MHPP and plasma membrane proton pump of sorghum root., 2015, 52: 620–627 (in Chinese with English abstract). [33] De Angeli A, Monachello D, Ephritikhine G, Frachisse J M, Thomine S, Gambale F, Barbier-Brygoo H. The nitrate/proton antiporter AtCLCa mediates nitrate accumulation in plant vacuoles., 2006, 442: 939–942. [34] 黃海濤, 張振華, 宋海星, 劉強(qiáng), 榮湘民, 彭建偉, 官春云. 基于液泡膜質(zhì)子泵的硝態(tài)氮再利用研究進(jìn)展. 生態(tài)學(xué)雜志, 2012, 31: 731–737. Huang H T, Zhang Z H, Song H X, Liu Q, Rong X M, Peng J W, Guan C Y. Nitrate nitrogen reutilization based on proton pump of vacuole membrane: a review., 2012, 31: 731– 737 (in Chinese with English abstract). Identification and function analysis of,, andgenes inL. YAO Jun-Yue1,2, HUA Ying-Peng1,2, ZHOU Ting1,2, WANG Tao1,2, SONG Hai-Xing1,2, GUAN Chun-Yun3, and ZHANG Zhen-Hua1,2,* 1College of Resource and Environment, Hunan Agricultural University, Changsha 410128, Hunan, China;2Southern Regional Collaborative Innovation Center for Grain and Oil Crops in China, Changsha 410128, Hunan, China;3Hunan Branch, National Oil Crops Improvement Center, Changsha 410128, Hunan, China Vacuoles play an important role in regulating plant cell differentiation and growth.,, andgenes are important carrier elements for regulating the acid-base balance inside and outside the vacuole of plants and the energy provided by ion transport. In this study, nine, three, and fourgenes were identified ingenome database and NCBI plant genome annotation database by using the known,, andgenes ofas reference sequences. Bioinformatics studies on copy number variation, molecular characteristics, transmembrane domain, conserved motifs, chromosome localization, phylogenetic tree construction, secondary structure and three- dimensional structure prediction of proteins and high-throughput transcriptome sequencing were carried out, indicating that the number of genes ofandwas significantly higher than that ofand; the AVP1, VHA-a2 and VHA-a3 proteins ofbelonged to a stable protein composed of acidic amino acids. The analysis of evolutionary selection ability showed that after low nitrogen treatment,genes were mainly expressed in shoots, and the expression ofgenes was down-regulated in shoots after three hours of low nitrogen treatment, and up-regulated in roots after 72 hours of low nitrogen treatment.andgenes were expressed in both shoots and roots, whilegenes were up-regulated after 72 hours of low nitrogen treatment, andgenes were down-regulated after three hours of low nitrogen treatment. After low phosphorus treatment, the expression of mostgenes was up-regulated in roots, and no difference in shoots. The expression ofgenes was almost no difference, and that ofgenes up-regulated in both shoots and roots. This result lays a foundation for further study on the biological functions of,andgenes inand the molecular mechanism that AVP1, VHA-a2, and VHA-a3 proteins hydrolyze ATP to provide energy for plant metabolism, and provides references for other species family genetic bioinformatics studies that are known to have large amounts of data. L;gene;gene; bioinformatics 2018-09-20; 2019-04-15; 2019-04-30. 10.3724/SP.J.1006.2019.84124 張振華, E-mail: zhzh1468@163.com E-mail: yjy950606@163.com 本研究由國家重點研發(fā)計劃項目(2018YFD0200901, 2018YFD0200906)和國家現(xiàn)代農(nóng)業(yè)產(chǎn)業(yè)技術(shù)體系建設(shè)專項(CARS-13)資助。 This study was supported by the National Key R&D Program of China (2018YFD0200901, 2018YFD0200906) and the China Agriculture Research System (CARS-13). URL:http://kns.cnki.net/kcms/detail/11.1809.S.20190429.1518.002.html2 結(jié)果與分析
2.1 十字花科作物AVP1、VHA-a2和VHA-a3基因的拷貝數(shù)變異
2.2 甘藍(lán)型油菜AVP1、VHA-a2和VHA-a3基因分子特征
2.3 甘藍(lán)型油菜AVP1、VHA-a2和VHA-a3蛋白的進(jìn)化選擇壓力分析
2.4 甘藍(lán)型油菜AVP1、VHA-a2和VHA-a3基因的染色體定位
2.5 甘藍(lán)型油菜、擬南芥、白菜以及甘藍(lán)的AVP1、VHA-a2和VHA-a3蛋白的保守基序分布



2.6 甘藍(lán)型油菜、擬南芥、白菜以及甘藍(lán)的AVP1、VHA-a2和VHA-a3基因外顯子-內(nèi)含子結(jié)構(gòu)的比對分析
2.7 AVP1、VHA-a2和VHA-a3蛋白的系統(tǒng)進(jìn)化分析
2.8 甘藍(lán)型油菜AVP1、VHA-a2和VHA-a3 蛋白二級結(jié)構(gòu)分析和三級結(jié)構(gòu)預(yù)測

2.9 甘藍(lán)型油菜AVP1、VHA-a2和VHA-a3基因在低氮條件下的表達(dá)分析
2.10 甘藍(lán)型油菜AVP1、VHA-a2和VHA-a3基因在低磷條件下的表達(dá)分析

3 討論
4 結(jié)論

