甘藍型油菜開花相關基因的鑒定及進化與表達分析
王艷花 謝 玲 楊 博 曹艷茹 李加納,*
?
甘藍型油菜開花相關基因的鑒定及進化與表達分析
王艷花1,2謝 玲1,2楊 博1,2曹艷茹1,2李加納1,2,*
1西南大學農學與生物科技學院 / 油菜工程研究中心, 重慶 400715;2西南大學現代農業科學研究院, 重慶 400715
開花是開花植物繁衍后代的前提, 控制開花時間對農作物獲得高產穩產具有重要影響。然而, 關于甘藍型油菜基因組水平上開花相關基因的信息報道較少。本研究對甘藍型油菜開花相關的基因進行了鑒定、特征分析、進化與表達模式分析。結果表明, 基因組水平上共鑒定到甘藍型油菜1173個開花相關基因, 這些基因分為9類, 且不均勻地分布在染色體上; 與白菜(AA, 2=20)和甘藍(CC, 2=18)相比, 甘藍型油菜(AACC, 2=38)經過自然雜交和染色體加倍后, 使開花相關基因的數目顯著擴增; 選擇壓力分析表明, 糖代謝信號途徑的基因比自發途徑的開花相關基因受到的選擇壓力更大; 仍有一些開花相關基因在擬南芥和油菜基因組內非常保守。甘藍型油菜基因數目的擴增和功能分化導致其開花調控機制更加復雜, 本研究為油菜開花途徑提供更多的信息, 也為闡明擬南芥和油菜開花基因的進化關系指明了方向。
甘藍型油菜; 開花基因; 進化; 調控途徑; 表達分析
開花是開花植物成功繁衍的前提。對于農作物而言, 開花時間適當是作物獲得高產和優質的重要條件, 而且開花時間受環境影響比較大, 因此, 開花時間是一項重要的農藝指標, 對作物有性繁殖和高產具有重要影響。目前, 大多數影響作物開花時間的遺傳組成和環境因子的信息都是從擬南芥研究中獲得的[1]。開花時間受外界和自身信號調控[2], 受環境影響的光周期途徑和環境溫度途徑, 受內部信號調控的自主開花途徑、赤霉素途徑和衰老途徑的顯著影響[1]。在擬南芥中有超過300個開花相關基因被鑒定(Flowering Interactive Database)[3]。這些基因參與自發途徑、光周期、赤霉素、春化和內在因素(包括衰老和糖信號)途徑五大開花通路[4]。盡管不同基因參與不同的通路, 但不同通路均受到()、()、()、()等幾個關鍵基因的協同調控[5]。然而, 僅有很少的開花基因在重要作物中得到鑒定。基因組序列的釋放和新的計算方法的開發為在基因組水平上鑒定開花相關基因提供了極大便利, 比如在蘿卜和小麥中分別鑒定到254個和900個開花相關基因[6]。
油菜是全世界廣泛種植的油料作物之一。開花時間在不同油菜品種之間具有非常廣泛的變異。前人利用QTL手段研究油菜開花時間, 但只有少數的基因如等得到鑒定或克隆[7-8]。與QTL定位、轉錄組測序和實驗驗證方法相比, 比較基因組學成為非常方便的手段來篩選開花候選基因, 特別在非模式作物研究中[6,9], 已經為重要性狀進一步的功能驗證提供非常重要的信息。目前, 在油菜基因組水平上還沒有展開開花相關基因的鑒定工作。本研究在基因組水平上鑒定了油菜開花相關基因, 并揭示了這些基因的進化和表達模式, 為油菜開花研究提供更多的候選基因, 為進一步揭示油菜開花機理奠定基礎。
1 材料與方法
1.1 甘藍型油菜、白菜和甘藍開花相關基因的篩選
從網站TAIR10 (http://www.arabidopsis.org/)下載擬南芥開花基因的蛋白序列, 從網站BRAD (http:// brassicadb.org/brad/)下載甘藍、白菜和甘藍型油菜的基因注釋信息。利用擬南芥開花基因的蛋白序列在BRAD網站上進行Blastp分析, 篩選甘藍型油菜、白菜和甘藍開花相關基因, 篩選標準為E值 <1e–20、相似度>60%、覆蓋率>75%以及匹配長度>70氨基酸殘基。
1.2 甘藍型油菜開花相關基因的染色體分布
從甘藍型油菜基因組網站(http://www.genoscope. cns.fr/brassicanapus/)下載, 并利用軟件Mapchart (https://www.wur.nl/en/show/Mapchart.htm)展示甘藍型油菜開花相關基因的物理位置信息。
1.3 甘藍型油菜開花相關基因的選擇壓力分析
為分析開花相關基因的選擇壓力, 利用軟件PAML計算甘藍型油菜與擬南芥開花相關基因對的非同義替換率(Ka)與同義替換率(Ks)[10]。當Ka/Ks比值大于1, 等于1或小于1時, 分別表示基因受到正向、中性和純化選擇[11]。
1.4 甘藍型油菜開花相關基因的表達分析
利用本課題組前期完成的轉錄組數據(NCBI注冊號為PRJNA358784)分析甘藍型油菜開花相關基因的組織表達情況。利用軟件Cufflinks[12]和TopHat2[13]計算基因的表達量FPKM (fragments per kilobase of exon per million mapped reads)。利用軟件MeV 4.9.0 (http://en.bio-soft.net/chip/MeV.html)展示表達熱圖。
2 結果與分析
2.1 甘藍型油菜開花相關基因的鑒定與染色體分布
利用擬南芥306個開花基因[3],本研究篩選到1173個甘藍型油菜開花相關基因(附表1),在甘藍型油菜基因組內可以找到超過89.5%的擬南芥開花基因同源基因(附表2)。大部分的油菜開花相關基因屬于光周期、生物鐘和光信號途徑(圖1)。
根據基因的位置信息,1045個開花相關基因被定位在19條染色體上, 剩余128個基因被定位在“unanchored scaffolds”上。這些基因在油菜基因組內分布是非常不均勻的, 在C01上有101個基因,A09上75個,A03上74個,在A08上最少,只有33個基因(圖2)。

圖1 甘藍型油菜開花相關基因鑒定與分類
Ag: 衰老途徑; At: 環境溫度; Au: 自發途徑; Cp: 光周期途徑; Fd: 花器官發育及頂端分生組織響應途徑; Ft: 開花時間調控者; Ho: 激素途徑; Su: 糖信號; Ve: 春化。
Ag: aging pathway; At: ambient temperature; Au: autonomous pathway; Cp: clock and photoperiod, pathway; Fd: flower development and apical meristem response pathway; Ft: flowering time integrator; Ho: hormones pathway; Su: sugar signal; Ve: vernalization.
2.2 擬南芥、白菜、甘藍和甘藍型油菜開花相關基因的比較分析
在白菜和甘藍基因組內, 共鑒定出549個和561個開花相關基因(圖3和附表3)。根據擬南芥開花基因的分類信息[3], 甘藍型油菜、白菜和甘藍的開花同源基因可參與9大類, 即衰老途徑、溫度、自發途徑、光周期、花器官發育、開花調控因子、激素、糖及春化途徑。而且, 有些基因可能會參與多個途徑, 如和同時參與花器官發育以及開花調控因子。大部分基因屬于光周期和自發途徑, 溫度途徑基因在4個物種中均是最少的。
2.3 甘藍型油菜開花相關基因的關鍵通路和基因家族分析
2.3.1 光周期途徑 光周期是顯著影響植物開花時間的外界環境因子[14]。在該途徑中, 利用103個擬南芥開花基因, 共鑒定出401個甘藍型油菜開花相關同源基因(圖1和附表1)。作為核心調控因子, CONSTANS(CO)整合外界環境因素如日照長度與內在的生物鐘過程來顯著調節開花時間[15]。在甘藍型油菜中共篩選出4個基因, 同時篩選出參與生物鐘過程的關鍵基因如、和[1,16-18]。ZTL、FKF1和LKP2均屬于F-box蛋白[19], 但是在甘藍型油菜基因組內沒有篩選到和的同源基因, 而卻有6個同源基因。在白菜和甘藍基因組內同樣沒有和基因, 表明和的基因丟失以及的三倍化事件同樣發生在共同祖先白菜和甘藍基因組內[20]。在甘藍型油菜中同樣篩選出光信號途徑的關鍵因子如和[1]。
2.3.2 春化和自發途徑 許多植物都需要春化過程來誘導開花。大量研究證明()基因和FLOWERING LOCUS C (FLC)基因在春化過程中起至關重要的作用[4]。作為開花抑制因子, FLC被FRI正向調控[21]。在甘藍型油菜基因組內有9個同源基因。同時, 在甘藍和白菜基因組內分別檢測到2個和1個同源基因, 沒有篩選到基因。而且, 很多春化響應基因如、和也在甘藍、白菜和甘藍型油菜基因組內被檢測到。與春化途徑相似, 自發途徑基因如()、()、、和通過抑制的表達來間接誘導開花[22-23]。在甘藍型油菜基因組內, 有461個基因屬于自發途徑。

(圖2)

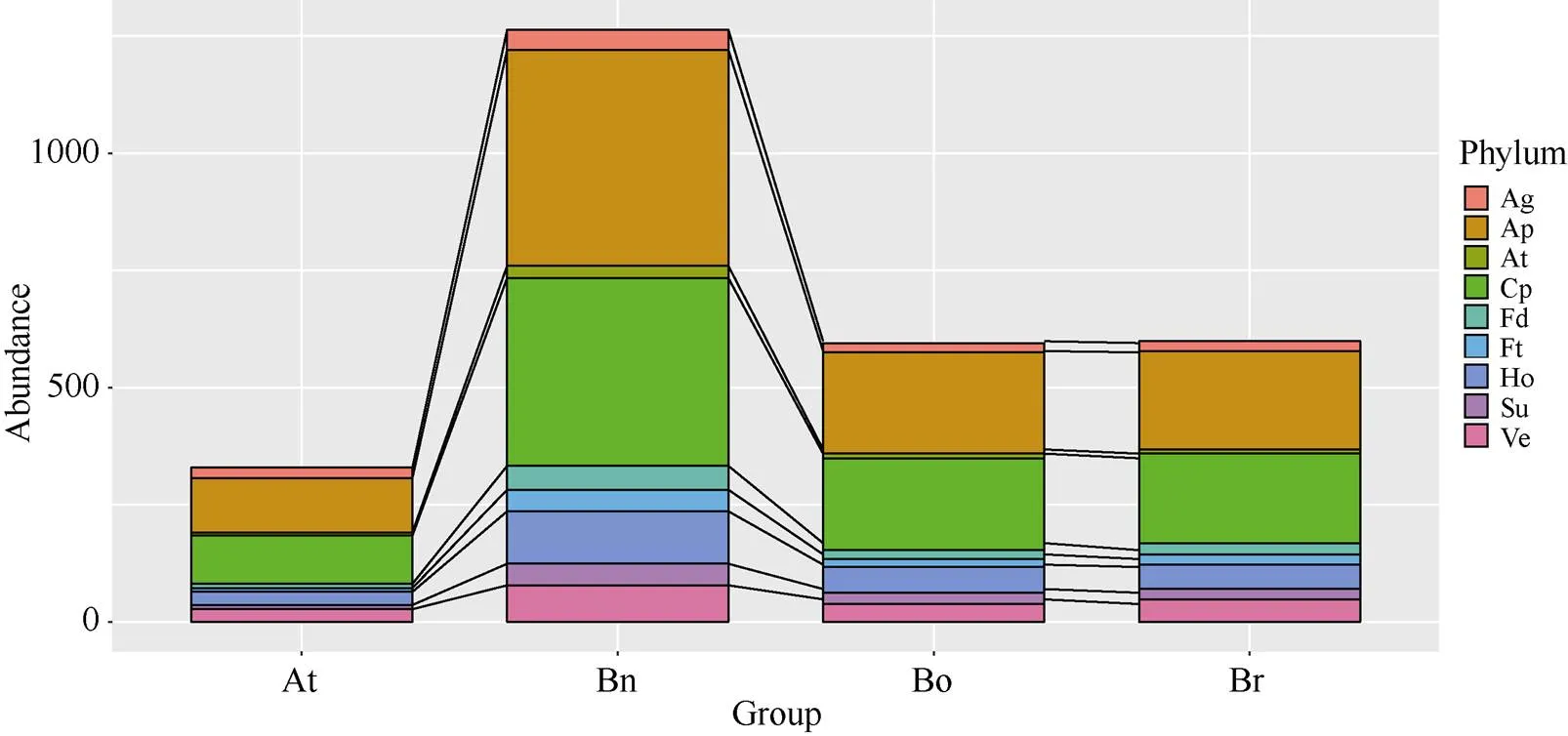
圖3 不同開花途徑基因在擬南芥、白菜、甘藍和甘藍型油菜基因組內的數目
縮寫同圖1。Abbreviation are the same as those given in Fig. 1.
2.3.3 頂端分生組織響應途徑 開花時間受到復雜的遺傳因子的調控, 這類調控因子被稱之為“調控者”基因, 可以整合內外環境信號和不同途徑的信號[24-25]。在本研究中, 91個開花相關基因被鑒定為“調控者”基因, 比如等。在甘藍型油菜基因組內僅有1個同源基因。
2.3.4 赤霉素信號與代謝途徑 很多證據表明, 在短日照情況下, 赤霉素是開花的必要條件, 但在長日照條件下則不需要。截至目前, 在擬南芥中有28個基因參與赤霉素途徑, 這些基因主要分為赤霉素合成途徑基因如和[26]和信號傳導因子基因如和[27]。在甘藍型油菜基因組內, 除之外, 所有赤霉素相關基因都有同源基因。GAI屬于DELLA蛋白家族, 但另外一個DELLA蛋白家族成員在甘藍型油菜基因組內卻有7個同源基因, 該基因抑制植物從苗期向花期的轉變[28]。
2.3.5 溫度途徑 溫度可以顯著影響開花時間[29]。適當高溫可以促進開花, 在擬南芥中已經有響應溫度的關鍵基因被鑒定, 如、和[1]。在甘藍型油菜中, 篩選到6個同源基因, 該基因在高溫環境中通過結合的啟動子來誘導開花[30]。作為MADS-box蛋白, SVP通過響應外界溫度來調節開花時間, 該蛋白通過結合在和的啟動子區域來抑制開花[31], 而EFM通過正調節SVP來參與調控開花時間[32]。在甘藍型油菜中,和各有4個同源基因。
2.3.6 糖信號途徑 除了赤霉素, 糖也可以參與調節開花時間[1]。特別指出的是, 蔗糖和海藻糖顯著影響開花時間[33-34]。在甘藍型油菜中, 46個影響開花的糖代謝相關的同源基因被鑒定。作為正向調控開花因子, TREHALOSE-6-PHOSPHATE SYNTHASE 1 (TPS1)參與海藻糖合成, 不管長日照還是短日照環境, 下調該基因都將導致開花延后[35]。編碼鋅指類轉錄因子, 通過調控糖的運輸和代謝來促進開花[36]。
2.3.7 衰老途徑 在甘藍型油菜基因組內共鑒定出43個影響開花的衰老途徑同源基因。該途徑的關鍵基因包括(和)、和[1]。很多證據表明miRNAs參與開花調控。其中和分別編碼miR156和miR172。隨著植物年齡增長, miR156表達量下調, 但是miR172表達量升高。miR156和miR172分別通過調控靶基因和基因來調控開花時間。作為開花抑制因子, 不管長日照還是短日照, 過表達SMZ都可以延遲開花[37-38]。miR156的靶基因通過誘導miR172來間接促進開花[39]。另外, HXK1參與果糖和葡萄糖的磷酸化, 其通過抑制miR156間接促進開花, 突變體在長日照環境中推遲開花時間[40]。
2.4 開花相關基因的選擇壓力分析
同源基因對的Ka/Ks比值被用來當作選擇壓力的指標。對于開花相關基因在擬南芥和油菜之間的垂直同源基因對的選擇壓力, 計算表明, 各開花相關基因通路的Ka/Ks比值范圍為0.18~0.46 (圖4和附表4), 表明開花相關基因受到純化選擇壓力。
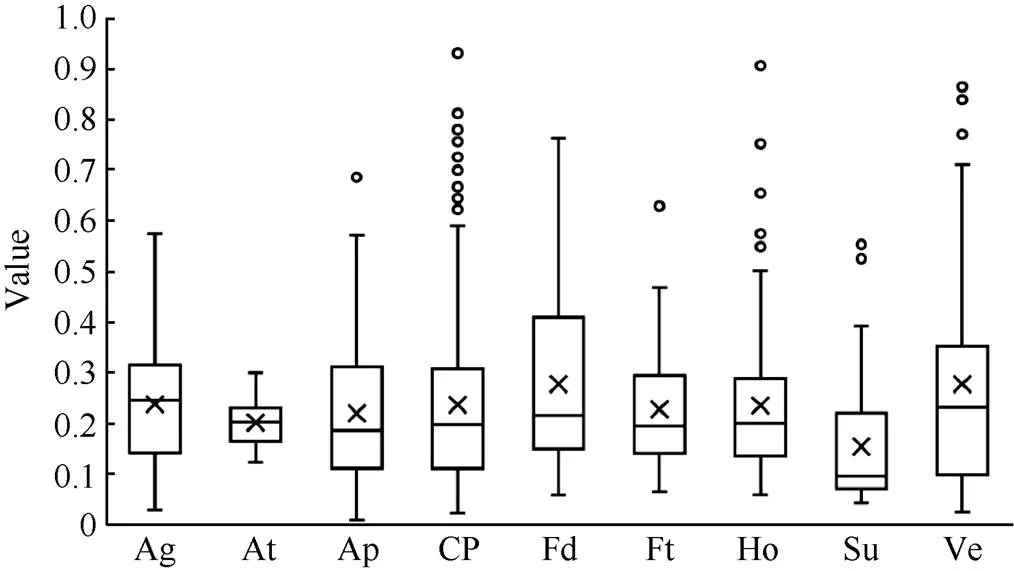
圖4 甘藍型油菜不同開花途徑基因的選擇壓力分析
縮寫同圖1。Abbreviations are the same as those given in Fig. 1.
2.5 甘藍型油菜開花相關基因的表達分析
本研究利用課題組前期完成的以“中雙11”為材料獲得的各時期各組織表達的轉錄組數據(NCBI注冊號為PRJNA358784)分析甘藍型油菜開花基因的表達特征。由圖5可知, 非功能化、新功能化或次功能化現象在重復基因對內出現, 盡管多數基因對具有相似的表達模式, 但有些具有新的功能。
3 討論
白菜、甘藍和甘藍型油菜基因組數據的釋放為研究重要農藝性狀的基因及功能提供了極大的便利[41-43]。雖然很多基因在擬南芥中都已經研究的很透徹, 但其同源基因在以上3種近源物種中的功能尚不明確。為補充這些信息, 本研究利用擬南芥開花相關基因, 通過同源比對的方法篩選到1173個甘藍型油菜、561個甘藍和549個白菜開花相關同源基因。考慮到白菜、甘藍和甘藍型油菜的基因組大小, 甘藍型油菜基因組內的開花相關基因的數目比其在白菜和甘藍基因組內數量的總和還要多[41,43]。甘藍型油菜基因組內的開花相關基因數目是其在擬南芥基因組內的3.8倍, 有些同源基因數目超過6個, 有些則低于3個, 表明同源基因內發生了丟失、重組、功能保留和分化。然而, 這并不影響甘藍型油菜主要的開花途徑, 因為油菜同樣可以整合環境內外的信號來調控開花時間。
在甘藍型油菜中篩選到一些光周期途徑的關鍵調控因子基因, 如、和。且在甘藍型油菜基因組內篩選到2個同源基因, 這2個成員在各組織器官中的表達量均較高。在甘藍型油菜中有7個同源基因, 且該基因在擬南芥中已經得到驗證[44], 其中4個成員表達量較高, 而其余3個成員幾乎不表達, 可能發生非功能化。在甘藍型油菜中篩選得到的6個同源基因在所有檢測的組織中表達量均較高, 可能誘導的表達[45]。生物鐘途徑的關鍵調控因子的2個同源基因也同樣具有較高的表達量[17]。在甘藍型油菜中有4個同源基因, 其中2個表達量較高, 而其余2個幾乎不表達。GI和CO的存在表明在甘藍型油菜中GI/CO調控開花時間的方式是非常保守的。相比其他途徑基因, 光周期途徑的基因的Ka/Ks比值的變異范圍更廣。
作為開花關鍵調控因子, 在甘藍型油菜基因組內分別檢測到9個、4個、6個、3個、4個和5個。在自發和春化途徑中, FLC是關鍵的調控因子, 其通過與FRI互作來抑制開花過程[46]。盡管在甘藍型油菜基因組內有9個同源基因, 但其表達量都很低, 可能跟取材時間有關。在甘藍型油菜中鑒定得到自發途徑和長日照條件下起重要作用的4個同源基因[47], 但只有1個成員表達量較高。整合光周期、春化和自發途徑的關鍵調控因子[48]在甘藍型油菜中有6個同源基因, 其中4個表達量較高。編碼一個促進早開花的轉錄因子, 該轉錄因子與APETALA1 (AP1)協同作用[49], 在甘藍型油菜中有4個成員, 其中2個在主序頂端中高表達, 5個同源基因, 均在花蕾、花萼、萼片、花瓣和主序頂端中高表達。總之, 幾個開花關鍵調控因子可以通過整合不同途徑信號來調控開花時間, 表明開花調控過程在擬南芥和油菜中是非常保守的。

圖5 甘藍型油菜開花相關基因的組織表達分析
縮寫同圖1。Abbreviations are the same as those given in Fig. 1.
4 結論
在甘藍型油菜中鑒定出1173個開花相關基因, 并分為9大類。開花調控機制在擬南芥和油菜之間是非常保守的, 保留了主要的調控通路和調節因子。光周期途徑比其他途徑的選擇壓力變異更大。這為甘藍型油菜開花調控機制提供更多的信息, 為育種家培育新品種提供基礎。
附表 請見網絡版: 1) 本刊網站http://zwxb.china-crops.org/; 2) 中國知網http://www.cnki.net/; 3) 萬方數據http://c.wanfangdata.com.cn/Periodical-zuowxb. aspx。
[1] Srikanth A, Schmid M. Regulation of flowering time: all roads lead to Rome., 2011, 68: 2013–2037.
[2] Koornneef M, Alonso B C, Peeters A J M, Soppe W. Genetic control of flowering time in Arabidopsis., 1998, 49: 345–370.
[3] Bouche F, Lobet G, Tocquin P, Perilleux C. FLOR-ID: an interactive database of flowering-time gene networks in., 2016, 44: 1167–1171.
[4] Blumel M, Dally N, Jung C. Flowering time regulation in crops-what did we learn from Arabidopsis?., 2015, 32: 121–129.
[5] Fornara F, de Montaigu A, Coupland G. SnapShot: control of flowering in Arabidopsis., 2010, 141: 550–550.
[6] Peng F Y, Hu Z, Yang R C. Genome-wide comparative analysis of flowering-related genes in Arabidopsis, wheat, and barley., 2015, 15: 1–17.
[7] Raman H, Raman R, Coombes N, Song J, Prangnell R, Bandaranayake C, Tahira R, Sundaramoorthi V, Killian A, Meng J, Dennis E S, Balasubramanian S. Genome-wide association analyses reveal complex genetic architecture underlying natural variation for flowering time in canola., 2016, 39: 1228–1239.
[8] Xu L, Hu K, Zhang Z, Guan C, Chen S, Hua W, Li J, Wen J, Yi B, Shen J, Ma C, Tu J, Fu T. Genome-wide association study reveals the genetic architecture of flowering time in rapeseed (L.)., 2016, 23: 43–52.
[9] Wang J, Qiu Y, Cheng F, Chen X, Zhang X, Wang H, Song J, Duan M, Yang H, Li X. Genome-wide identification, characterization, and evolutionary analysis of flowering genes in radish (L.)., 2017, 18: 981, doi: 10.1186/s12864-017-4377-z.
[10] Yang Z. PAML 4: phylogenetic analysis by maximum likelihood., 2007, 24: 1586–1591.
[11] Liang Y, Wan N, Cheng Z, Mo Y, Liu B, Liu H, Raboanatahiry N, Yin Y, Li M. Whole-genome identification and expression pattern of the vicinal oxygen chelate family in rapeseed (L.)., 2017, 8: 745, doi: 10.3389/fpls.2017.00745.
[12] Trapnell C, Roberts A, Goff L, Pertea G, Kim D, Kelley D R, Pimentel H, Salzberg S L, Rinn J L, Pachter L. Differential gene and transcript expression analysis of RNA-seq experiments with TopHat and Cufflinks., 2012, 7: 562–578.
[13] Kim D, Pertea G, Trapnell C, Pimentel H, Kelley R, Salzberg S L. TopHat2: accurate alignment of transcriptomes in the presence of insertions, deletions and gene fusions., 2013, 14: R36.
[14] Song Y H, Ito S, Imaizumi T. Flowering time regulation: photoperiod- and temperature-sensing in leaves., 2013, 18: 575–583.
[15] Wenkel S, Turck F, Singer K, Gissot L, Le Gourrierec J, Samach A, Coupland G. CONSTANS and the CCAAT box binding complex share a functionally important domain and interact to regulate flowering of Arabidopsis., 2006, 18: 2971–2984.
[16] Dong M A, Farre E M, Thomashow M F. Circadian clock-associated 1 and late elongated hypocotyl regulate expression of the C-repeat binding factor (CBF) pathway in Arabidopsis., 2011, 108: 7241–7246.
[17] Sawa M, Kay S A. GIGANTEA directly activates flowering locus T in., 2011, 108: 11698–11703.
[18] Nagel D H, Doherty C J, Pruneda P J L, Schmitz R J, Ecker J R, Kay S A. Genome-wide identification of CCA1 targets uncovers an expanded clock network in Arabidopsis., 2015, 112: 4802–4810.
[19] Baudry A, Ito S, Song Y H, Strait A A, Kiba T, Lu S, Henriques R, Pruneda P J L, Chua N H, Tobin E M, Kay S A, Imaizumi T. F-box proteins FKF1 and LKP2 act in concert with ZEITLUPE to control Arabidopsis clock progression., 2010, 22: 606–622.
[20] Lou P, Wu J, Cheng F, Cressman L G, Wang X, McClung C R. Preferential retention of circadian clock genes during diploidization following whole genome triplication in., 2012, 24: 2415–2426.
[21] Johanson U, West J, Lister C, Michaels S, Amasino R, Dean C. Molecular analysis of FRIGIDA, a major determinant of natural variation in Arabidopsis flowering time., 2000, 290: 344–347.
[22] Noh B, Lee S H, Kim H J, Yi G, Shin E A, Lee M, Jung K J, Doyle M R, Amasino R M, Noh Y S. Divergent roles of a pair of homologous jumonji/zinc-finger-class transcription factor proteins in the regulation of Arabidopsis flowering time., 2004, 16: 2601–2613.
[23] Simpson G G. The autonomous pathway: epigenetic and post- transcriptional gene regulation in the control of Arabidopsis flowering time., 2004, 7: 570–574.
[24] Parcy F. Flowering: a time for integration., 2005, 49: 585–593.
[25] Kim S, Soltis P S, Wall K, Soltis D E. Phylogeny and domain evolution in the APETALA2-like gene family., 2006, 23:107–120.
[26] Mitchum M G, Yamaguchi S, Hanada A, Kuwahara A, Yoshioka Y, Kato T, Tabata S, Kamiya Y, Sun T P. Distinct and overlapping roles of two gibberellin 3-oxidases in Arabidopsis development., 2006, 45: 804–818.
[27] Ariizumi T, Murase K, Sun T P, Steber C M. Proteolysis- independent downregulation of DELLA repression in Arabidopsis by the gibberellin receptor GIBBERELLIN INSENSITIVE DWARF1., 2008, 20: 2447–2459.
[28] Achard P, Vriezen W H, Van D S D, Harberd N P. Ethylene regulates arabidopsis development via the modulation of DELLA protein growth repressor function., 2003, 15: 2816–2825.
[29] Samach A, Wigge P A. Ambient temperature perception in plants., 2005, 8: 483–486.
[30] Thines B C, Youn Y, Duarte M I, Harmon F G. The time of day effects of warm temperature on flowering time involve PIF4 and PIF5., 2014, 65: 1141–1151.
[31] Lee J H, Yoo S J, Park S H, Hwang I, Lee J S, Ahn J H. Role of SVP in the control of flowering time by ambient temperature in Arabidopsis., 2007, 21: 397–402.
[32] Yan Y, Shen L, Chen Y, Bao S, Thong Z, Yu H. A MYB-domain protein EFM mediates flowering responses to environmental cues in Arabidopsis., 2014, 30: 437–448.
[33] Paul M J, Primavesi L F, Jhurreea D, Zhang Y. Trehalose metabolism and signaling., 2008, 59: 417–441.
[34] Dalchau N, Baek S J, Briggs H M, Robertson F C, Dodd A N, Gardner M J, Stancombe M A, Haydon M J, Stan G B, Goncalves J M, Webb A A. The circadian oscillator genemediates a long-term response of thecircadian clock to sucrose., 2011, 108: 5104–5109.
[35] Wahl V, Ponnu J, Schlereth A, Arrivault S, Langenecker T, Franke A, Feil R, Lunn J E, Stitt M, Schmid M. Regulation of flowering by trehalose-6-phosphate signaling in., 2013, 339: 704–707.
[36] Seo P J, Ryu J, Kang S K, Park C M. Modulation of sugar metabolism by an INDETERMINATE DOMAIN transcription factor contributes to photoperiodic flowering in Arabidopsis., 2011, 65: 418–429.
[37] Jung J H, Seo Y H, Seo P J, Reyes J L, Yun J, Chua N H, Park C M. The GIGANTEA-regulated microRNA172 mediates photoperiodic flowering independent of CONSTANS in Arabidopsis., 2007, 19: 2736–2748.
[38] Mathieu J, Yant L J, Murdter F, Kuttner F, Schmid M. Repression of flowering by the miR172 target SMZ., 2009, 7: e1000148.
[39] Wang J W, Czech B, Weigel D. miR156-regulated SPL transcription factors define an endogenous flowering pathway in, 2009, 138: 738–749.
[40] Matsoukas I G, Massiah A J, Thomas B. Starch metabolism and antiflorigenic signals modulate the juvenile-to-adult phase transition in Arabidopsis., 2013, 36: 1802–1811.
[41] Wang X, Wang H, Wang J, Sun R, Wu J, Liu S, Bai Y, Mun J H, Bancroft I, Cheng F, Huang S, Li X, Hua W, Wang J, Wang X, Freeling M, Pires J C, Paterson A H, Chalhoub B, Wang B, Hayward A, Sharpe A G, Park B S, Weisshaar B, Liu B, Li B, Liu B, Tong C, Song C, Duran C, Peng C, Geng C, Koh C, Lin C, Edwards D, Mu D, Shen D, Soumpourou E, Li F, Fraser F, Conant G, Lassalle G, King G J, Bonnema G, Tang H, Wang H, Belcram H, Zhou H, Hirakawa H, Abe H, Guo H, Wang H, Jin H, Parkin I A, Batley J, Kim J S, Just J, Li J, Xu J, Deng J, Kim J A, Li J, Yu J, Meng J, Wang J, Min J, Poulain J, Wang J, Hatakeyama K, Wu K, Wang L, Fang L, Trick M, Links M G, Zhao M, Jin M, Ramchiary N, Drou N, Berkman P J, Cai Q, Huang Q, Li R, Tabata S, Cheng S, Zhang S, Zhang S, Huang S, Sato S, Sun S, Kwon S J, Choi S R, Lee T H, Fan W, Zhao X, Tan X, Xu X, Wang Y, Qiu Y, Yin Y, Li Y, Du Y, Liao Y, Lim Y, Narusaka Y, Wang Y, Wang Z, Li Z, Wang Z, Xiong Z, Zhang Z,Genome Sequencing Project C. The genome of the mesopolyploid crop species., 2011, 43: 1035–1039.
[42] Chalhoub B, Denoeud F, Liu S, Parkin I A, Tang H, Wang X, Chiquet J, Belcram H, Tong C, Samans B, Correa M, Da S C, Just J, Falentin C, Koh C S, Le C I, Bernard M, Bento P, Noel B, Labadie K, Alberti A, Charles M, Arnaud D, Guo H, Daviaud C, Alamery S, Jabbari K, Zhao M, Edger P P, Chelaifa H, Tack D, Lassalle G, Mestiri I, Schnel N, Le P M C, Fan G, Renault V, Bayer P E, Golicz A A, Manoli S, Lee T H, Thi V H, Chalabi S, Hu Q, Fan C, Tollenaere R, Lu Y, Battail C, Shen J, Sidebottom C H, Wang X, Canaguier A, Chauveau A, Berard A, Deniot G, Guan M, Liu Z, Sun F, Lim Y P, Lyons E, Town C D, Bancroft I, Wang X, Meng J, Ma J, Pires J C, King G J, Brunel D, Delourme R, Renard M, Aury J M, Adams K L, Batley J, Snowdon R J, Tost J, Edwards D, Zhou Y, Hua W, Sharpe A G, Paterson A H, Guan C, Wincker P. Early allopolyploid evolution in the post-Neolithicoilseed genome., 2014, 345: 950–953.
[43] Liu S, Liu Y, Yang X, Tong C, Edwards D, Parkin I A, Zhao M, Ma J, Yu J, Huang S, Wang X, Wang J, Lu K, Fang Z, Bancroft I, Yang T J, Hu Q, Wang X, Yue Z, Li H, Yang L, Wu J, Zhou Q, Wang W, King G J, Pires J C, Lu C, Wu Z, Sampath P, Wang Z, Guo H, Pan S, Yang L, Min J, Zhang D, Jin D, Li W, Belcram H, Tu J, Guan M, Qi C, Du D, Li J, Jiang L, Batley J, Sharpe A G, Park B S, Ruperao P, Cheng F, Waminal N E, Huang Y, Dong C, Wang L, Li J, Hu Z, Zhuang M, Huang Y, Huang J, Shi J, Mei D, Liu J, Lee T H, Wang J, Jin H, Li Z, Li X, Zhang J, Xiao L, Zhou Y, Liu Z, Liu X, Qin R, Tang X, Liu W, Wang Y, Zhang Y, Lee J, Kim H H, Denoeud F, Xu X, Liang X, Hua W, Wang X, Wang J, Chalhoub B, Paterson A H. Thegenome reveals the asymmetrical evolution of polyploid genomes., 2014, 5: 3930, doi: 10.1038/ncomms4930.
[44] Fujiwara S, Oda A, Yoshida R, Niinuma K, Miyata K, Tomozoe Y, Tajima T, Nakagawa M, Hayashi K, Coupland G, Mizoguchi T. Circadian clock proteins LHY and CCA1 regulate SVP protein accumulation to control flowering in Arabidopsis., 2008, 20: 2960–2971.
[45] Ding Z, Millar A J, Davis A M, Davis S J. TIME FOR COFFEE encodes a nuclear regulator in thecircadian clock., 2007, 19: 1522–1536.
[46] Tao Z, Shen L, Liu C, Liu L, Yan Y, Yu H. Genome-wide identification of SOC1 and SVP targets during the floral transition in Arabidopsis., 2012, 70: 549–561.
[47] Wigge P A, Kim M C, Jaeger K E, Busch W, Schmid M, Lohmann J U, Weigel D. Integration of spatial and temporal information during floral induction in Arabidopsis., 2005, 309: 1056–1059.
[48] Lee H, Suh S S, Park E, Cho E, Ahn J H, Kim S G, Lee J S, Kwon Y M, Lee I. The AGAMOUS-LIKE 20 MADS domain protein integrates floral inductive pathways in Arabidopsis., 2000, 14: 2366–2376.
[49] Liu C, Xi W, Shen L, Tan C, Yu H. Regulation of floral patterning by flowering time genes., 2009, 16: 711–722.
Flowering genes in oilseed rape: identification, characterization, evolutionary and expression analysis
WANG Yan-Hua1,2, XIE Ling1,2, YANG Bo1,2, CAO Yan-Ru1,2, and LI Jia-Na1,2,*
1College of Agronomy and Biotechnology, Southwest University/ Chongqing Engineering Research Center for Rapeseed, Chongqing 400715, China;2Academy of Agricultural Sciences, Southwest University, Chongqing 400715, China
Flowering is a prerequisite for successful sexual reproduction. Controlling of flowering time is important for crop production in different geographical regions. However, few information regarding flowering genes or their evolution at genome-wide level inhas been reported. In this study, identification, characterization, evolutionary and expression analysis of flowering genes in oilseed rape were performed. In total, 1173 flowering-related genes classified into nine types and distributed unevenly on the chromosomes were identified at the genome level of. Compared with(AA, 2= 20) and(CC, 2= 18),(AACC, 2= 38) showed significantly enlarge number of flowering-related genes due to natural hybridization and chromosome doubling. Selective pressure analysis showed that the autonomous pathway genes had less selectionpressure than the genes involved in sugar metabolic pathway, suggesting that some key flowering-related genes are relatively conserved betweenand. The present study provides more information on theflowering pathways and sheds light on the evolutionary relationship of flowering-related genes betweenand.
; flowering genes; evolution; regulatory pathway;expression analysis
2018-11-16;
2019-04-15;
2019-05-08.
10.3724/SP.J.1006.2019.84159
李加納, E-mail: ljn1950@swu.edu.cn, Tel: 023-68250642
E-mail: hawer313@163.com
本研究由重慶市民生工程主題專項項目(cstc2016shms-ztzx80020)和高等學校學科創新引智基地項目(“111”項目)(B12006)資助。
This study was supported by the Special Project of Chongqing People’s Livelihood Project (cstc2016shms-ztzx80020) and the Project of Intellectual Base for Discipline Innovation in Colleges and Universities (“111” Project) (B12006).
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20190505.1436.008.html

