結直腸癌免疫治療的研究進展
黎華麗,鄭勇斌
(武漢大學人民醫院,武漢430000)
結直腸癌是臨床上最常見的消化系統惡性腫瘤,近年來其發病率和病死率在世界范圍內均呈上升趨勢[1]。雖然外科手術、放療、化療等治療技術已有較大提高,但由于大部分患者在確診時即處于進展期,喪失了接受標準治療的機會,預后較差。研究發現,免疫系統在腫瘤發生、發展過程中發揮重要作用[2]。隨著腫瘤學、免疫學以及分子生物學等相關學科的迅速發展和交叉滲透,腫瘤免疫治療研究突飛猛進。免疫治療成為繼外科手術、放療、化療之后又一種重要的腫瘤治療手段。目前,結直腸癌的免疫治療方法主要包括癌癥疫苗、細胞療法、細胞因子治療以及免疫檢查點抑制劑治療。本文結合文獻就結直腸癌免疫治療的研究進展作一綜述。
1 癌癥疫苗
癌癥疫苗是指通過調節抗原提呈細胞和T淋巴細胞的相互作用,來增強和完善自體免疫系統對腫瘤細胞的殺傷作用[3]。目前,針對結直腸癌的癌癥疫苗主要有全腫瘤細胞疫苗、肽疫苗、DNA疫苗、樹突狀細胞(DC)疫苗和病毒載體疫苗。這些疫苗各具特征、優勢和局限,見表1。在結直腸癌臨床免疫治療中,常用的癌癥疫苗有肽疫苗、DC疫苗和病毒載體疫苗,而全腫瘤細胞疫苗和DNA疫苗由于免疫原性較低逐漸淡出了臨床治療。
肽疫苗可識別腫瘤細胞表面的抗原多肽或其內部異常表達的蛋白,具有良好的修飾潛力和靶向腫瘤特異抗原的能力[4]。在治療結直腸癌的癌癥疫苗中,肽疫苗可靶向多種腫瘤相關抗原,如癌胚抗原(CEA)、p53以及EphA2等[5,6]。Speetjens等[6]將p53合成長肽疫苗用于轉移性結直腸癌的臨床治療,在接受治療的10例患者中,有9例出現了p53特異性T細胞免疫反應,且其中6例免疫反應持續至少6個月。但目前常見的肽疫苗還未能克服MHC Ⅰ/HLA Ⅰ限制以及免疫原性較低等問題。近年鮮有肽疫苗用于結直腸癌臨床治療的報道。
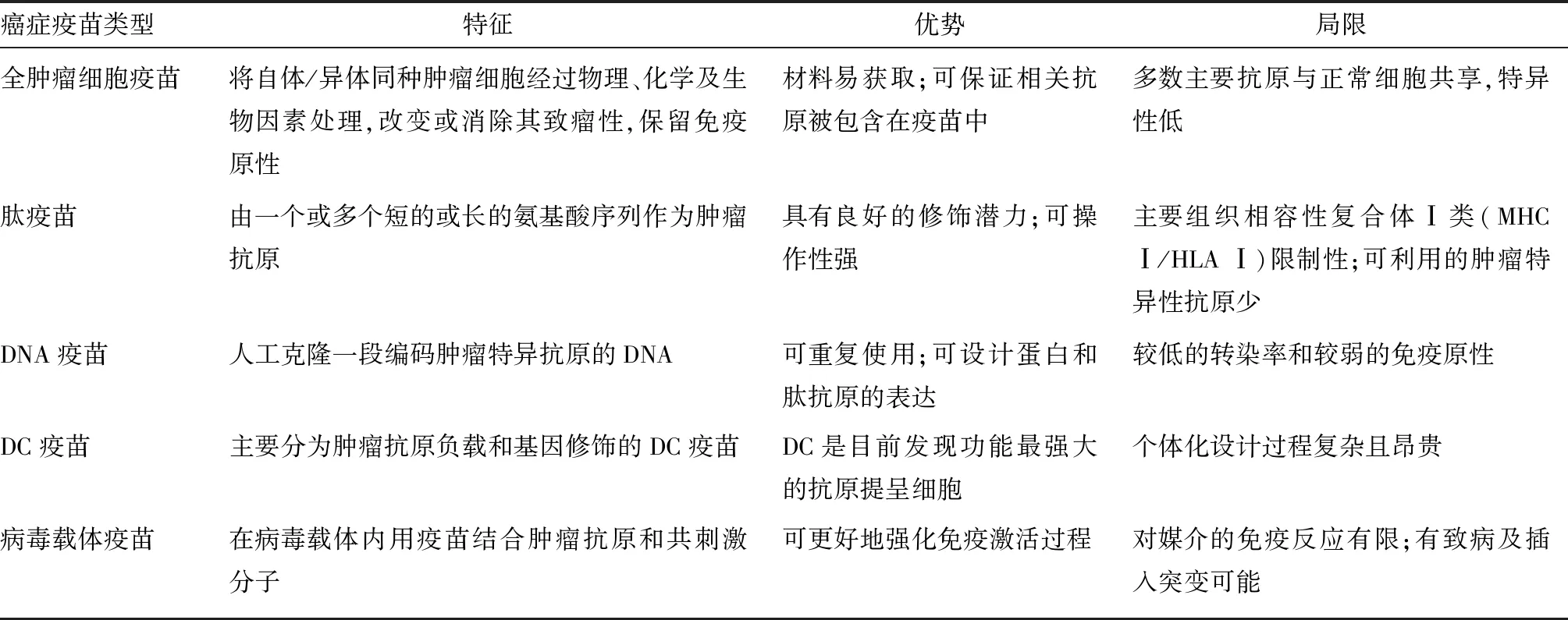
表1 結直腸癌不同類型癌癥疫苗的特征、優勢和局限
DC可為抗腫瘤免疫反應提供激活T細胞的關鍵信號,即通過MHC提呈抗原和合適的共同刺激受體-配體以及關鍵細胞因子表達[7]。DC疫苗即為負載相應腫瘤抗原的DC,可刺激機體內的腫瘤殺傷性淋巴細胞增殖。DC疫苗Sipuleucel-T已被美國食品藥品管理局(FDA)批準用于前列腺癌治療。在結直腸癌中,一項Ⅰ期臨床試驗顯示,接種DC疫苗的結直腸癌患者雖有部分表現出較低的治療相關毒性,但在生存獲益上并未表現出明顯優勢[8]。目前,更多關于結直腸癌DC疫苗的臨床試驗正在進行,其有效性和安全性尚需進一步研究證實。
病毒載體疫苗是指利用重組病毒表達腫瘤相關抗原,通常感染抗原提呈細胞,尤其是DC[9],以刺激并強化機體抗腫瘤免疫反應。這種疫苗是一種比強化免疫活性更有前途的方法,可在病毒載體基礎上結合腫瘤抗原和共刺激分子,常見的載體病毒有腺病毒和扁豆病毒等[10]。Quiroga等[11]在研究編碼重組Eimeria抗原(rEA)的腺病毒(rAd5-rEA)與針對CEA的細胞毒性反應的關系時發現,rAd5-rEA和基于CEA的腺病毒疫苗聯合應用可明顯增強和擴大腫瘤相關抗原特異性的獲得性免疫反應,顯現出病毒載體在癌癥疫苗治療中的佐劑潛力。
2 細胞療法
細胞療法又稱過繼性細胞免疫治療(ACT),是指通過外界修飾讓普通T細胞成為能夠特異性識別腫瘤細胞的效應T細胞,從而產生對腫瘤細胞的殺傷效應[12]。目前研究較為廣泛的免疫效應細胞有自體淋巴因子激活的殺傷細胞(LAK)、自體腫瘤浸潤性淋巴細胞(TILs)、自然殺傷細胞(NK)、細胞毒性T細胞(CTLs)以及經基因修飾改造的T細胞,如嵌合抗原受體T細胞(CAR-T)和T細胞受體嵌合型T細胞(TCR-T)等。這些效應細胞的特征、優勢和局限見表2。

表2 細胞療法免疫效應細胞的特征、優勢和局限
ACT的淋巴細胞主要來源于自體腫瘤,如TILs,其在體外擴增后回輸體內,能夠表現出強大的抗腫瘤效應,并可誘導急性炎性反應,而這種炎性反應可誘導不依賴于抗原的免疫細胞對同一病變的二次侵襲[13]。CTLs是TILs的主要組成部分,也是免疫系統發揮抗腫瘤效應的關鍵細胞成分。NK是先天免疫系統的細胞毒性淋巴細胞,在缺乏體內和體外刺激的情況下可殺死多種腫瘤細胞和被感染細胞[14]。Song等[15]利用慢病毒載體轉導產生的轉基因NK,通過腹腔注射治療結直腸癌,結果發現NK可在腫瘤部位積聚,浸潤腫瘤組織并誘導細胞凋亡,繼而延緩腫瘤生長。在一項關于LAK的研究中,研究者利用自體來源的LAK聯合IL-2用于標準化治療無效的轉移性腫瘤患者,發現部分肝轉移的結直腸癌患者可表現出腫瘤進展延緩甚至衰退[16]。提示LAK有可能用于實體腫瘤的輔助治療,但仍需進一步研究,以明確其在結直腸癌臨床治療中的安全性和耐受性等。
在各種免疫效應細胞中,CAR-T是一種極具創新性的免疫治療策略之一,是通過基因工程使細胞表面表達TAA受體,這些受體可識別并結合腫瘤抗原,進而實現對腫瘤細胞的特異性殺傷效應[17]。CAR-T可提供非MHC限制的細胞表面識別成分,并可通過病毒載體高效地引入T細胞[13]。Zhang等[18]觀察了CEA-CAR-T對10例CEA陽性的轉移性結直腸癌患者的治療效果,結果發現,大多數患者血清CEA水平明顯下降,2例患者腫瘤縮小,2例患者病情穩定30周以上。表明CAR-T對CEA陽性的結直腸癌患者具有較好的耐受性及一定程度的抗腫瘤效應。但截至目前CAR-T單一治療還不足以克服腫瘤微環境中PD-1、CTLA-4等檢查點所誘導的抑制性作用,其在結直腸癌中的治療效果以及聯合應用還有待于進一步研究。
3 細胞因子治療
細胞因子是一種能有效激活腫瘤免疫細胞和對抗腫瘤免疫抑制的多效性蛋白[19],其在先天性和特異性免疫反應的各個方面具有關鍵性作用,可通過激活機體免疫系統殺傷腫瘤細胞,還可直接干擾腫瘤細胞增殖[10]。有研究證實,對胃腸道惡性腫瘤具有抑制作用的細胞因子主要有白細胞介素(如IL-2、IL-15、IL-21等)、干擾素(如IFN-γ、IFN-α等)以及粒細胞-巨噬細胞集落刺激因子(GM-CSF)等[20,21]。Snook等[22]將IL-2、GM-CSF用于轉移性結直腸癌小鼠的輔助性治療,結果發現二者均能明顯優化抗腫瘤免疫反應,提示細胞因子聯合其他治療策略用于治療結直腸癌的佐劑潛力。但在細胞因子治療中應重視發生免疫不良相關事件的潛在風險。在一項評估IL-2治療轉移性黑色素瘤的有效性與安全性研究中,270例患者中有64%患者出現了低血壓,17%患者出現了室上性心動過速,4%患者發生了4級呼吸事件,15%患者出現感染,且2.2%患者死于治療相關的毒性反應[23]。這表明細胞因子治療在腫瘤微環境中增強局部抗腫瘤免疫反應的同時,也會誘導免疫系統的廣泛激活,進而誘發治療相關的毒性反應,甚至導致死亡。近年關于結直腸癌細胞因子單一治療的研究非常有限。
4 免疫檢查點抑制劑治療
免疫檢查點是指表達于腫瘤細胞和(或)免疫細胞上的蛋白分子,它們能夠調控T細胞的啟動/激活過程。目前,已發現的抑制性檢查點有PD-1、PD-L1/2、CTLA-4、淋巴細胞活化基因3、B/T淋巴細胞弱化因子以及T細胞免疫球蛋白和黏蛋白3等[24,25]。這些共抑制分子可誘導T細胞凋亡、抑制活化T細胞的功能,而腫瘤細胞則可利用這種對免疫系統的抑制作用來逃避腫瘤微環境中免疫細胞的特異性殺傷效應[26]。目前,已被FDA批準用于惡性腫瘤治療的免疫檢查點抑制劑有抗PD-1抗體(如Nivolumab、Pembrolizumab)、抗PD-L1抗體(如Atezolizumab、Avelumab、Durvalumab)及抗CTLA-4抗體(如Ipilimumab),但可用于結直腸癌治療或在臨床試驗中表現出有效性的免疫檢查點抑制劑卻很少。在一項Ⅱ期臨床試驗中,Nivolumab被用于治療化療效果不佳的結直腸癌患者,結果發現有31%患者表現出有效的免疫反應[27]。Pembrolizumab也被證實在部分結直腸癌亞型患者中具有較高的免疫應答率[28]。Le等[29]評估了Pembrolizumab在41例進展性轉移癌或不伴錯配修復缺陷(dMMR)患者中的臨床活性,結果發現,在dMMR的結直腸癌患者中免疫應答率為40%,而在錯配修復良好(pMMR)的結直腸癌患者中為0,顯示出免疫檢查點抑制劑在部分結直腸癌患者中的高反應性。但到目前為止,僅有PD-1/PD-L1阻滯劑單一治療的早期臨床試驗,雖在dMMR的結直腸癌治療中顯示出了可觀的免疫反應,但未能在pMMR的結直腸癌患者中誘導出有效的免疫反應。這可能是由高微衛星不穩定性(MSI-H)腫瘤特點所決定的。在免疫組化上,MSI-H腫瘤有90%以上的病灶顯示出至少一種DNA MMR蛋白表達缺失[30]。dMMR的腫瘤浸潤淋巴細胞水平高,腫瘤突變負荷也較高。有研究發現,dMMR亞型結直腸癌隊列中每個腫瘤平均有1 782個體細胞突變,而pMMR亞型隊列中每個腫瘤僅73個體細胞突變,表現出更低的免疫原性[31]。此外,dMMR/MSI-H結直腸癌患者亞群僅占結直腸癌的一小部分(不足5%),大部分為pMMR/non-MSI-H亞型[32],這種亞型差異限制了免疫檢查點抑制劑治療結直腸癌的有效性。
隨著現代醫學的發展,免疫治療逐漸成為腫瘤治療的熱點,也是結直腸癌治療的一個新方向,在一定程度上改善了部分結直腸癌患者預后。但現有的結直腸癌免疫治療方法僅對部分亞型表現出良好的免疫應答率,大部分患者免疫應答率仍然較低,仍需多中心、大樣本量研究,以滿足其在多數結直腸癌患者中的有效性與安全性,從而使更多患者獲益。結直腸癌免疫治療是一個非常有前景性的治療選擇,值得進一步研究探索。

