潰瘍性結腸炎患者結腸黏膜5-HT信號通路的變化特點
潰瘍性結腸炎(UC)是一種炎癥性腸病(IBD),其特征是結腸黏膜和黏膜下慢性炎性反應,臨床表現主要包括腹瀉、便血和腹痛。UC的發病機制尚未完全明確[1]。
腸道5-羥色胺(5-HT)主要由腸嗜鉻(EC)細胞合成、貯存和釋放[2]。EC細胞通過色氨酸羥化酶1(TPH1)合成5-HT,5-HT釋放后,一部分作用于各種5-HT受體發揮生物學效應,另一部分被5-HT再攝取轉運蛋白(SERT)攝取到上皮細胞中,經單胺氧化酶代謝而終止作用。5-HT在胃腸道的運動、分泌和感覺調節中起著關鍵作用[3]。研究發現5-HT與腸道疾病如腸易激綜合征、IBD有關[2,4-5]。有研究報道UC患者結腸黏膜中5-HT信號通路的變化,但結果不一致[2]。本課題組研究了5-HT信號通路在UC患者結腸黏膜中的變化,并分析了5-HT釋放量與UC疾病活動度的相關性,以期進一步了解UC的發病機制。
1 研究對象與方法
1.1 研究對象
本研究選擇2016年6月至2018年1月在香港大學深圳醫院接受診治的18例活動期UC患者,另選擇11名同期的健康體檢者作為健康對照組。UC患者包括11例男性和7例女性,年齡范圍24~68歲,平均年齡(45.3±12.0)歲,平均病程(4.5±3.1)年。UC的診斷根據潰瘍性結腸炎共識第1部分,采用Mayo病活動指數(DAI)評估UC疾病活動度(3~5分為輕度,6~10分為中度,11~12分為重度)[6]。UC組與健康對照組的年齡、性別差異無統計學意義(P>0.05),詳見表1。兩組均未使用針對5-HT系統的藥物(如選擇性5-羥色胺再攝取抑制劑、5-HT4激動劑或5-HT3拮抗劑)。通過結腸鏡下活組織檢查獲得兩組的結腸黏膜組織標本。本研究獲得醫院倫理委員會批準,所有入選者均知情同意。

表1 兩組一般情況
1.2 結腸黏膜5-HT含量的測定
按照說明書制備結腸黏膜組織勻漿,使用酶免疫分析試劑盒(美國ENZO公司)檢測5-HT含量。組織中5-HT含量單位為ng/mg。
1.3 結腸黏膜5-HT釋放量的測定
每個受試者均取兩塊結腸黏膜活組織標本用來檢測5-HT釋放量。將標本置于37 ℃、5% CO2的組織培養板中(24孔),在1 000 μL含有10%胎牛血清(美國Gibco公司)、100 U/mL青霉素和100 μg/mL鏈霉素的RPMI 1640培養基中孵育24 h,吸取培養液后離心,獲取上清液,用酶免疫測定試劑盒(美國ENZO公司)測定釋放到上清液中的5-HT量。
1.4 免疫熒光法檢測5-HT、TPH1和SERT的分布和表達
將結腸黏膜活組織標本固定在10%的中性甲醛中過夜,常規制備石蠟切片。石蠟切片經脫蠟和水化后,經pH 6.8的枸櫞酸鈉溶液用高壓鍋行抗原熱修復,在室溫下0.1 mol/L PBS溶液(含5%正常驢血清和0.3%Triton X-100)中孵育30 min,4 ℃孵育一抗過夜,使用的一抗包括山羊抗人5-HT(1∶1 000)、兔抗人SERT(1∶100)和兔抗人TPH1(1∶100),均購自美國Abcam公司。切片用PBS溶液洗3次,在室溫下用相應的二抗孵育1 h,使用的二抗包括Alexa Fluor 594標記的驢抗山羊IgG(1∶200)和Alexa Fluor 594標記的驢抗兔IgG(1∶200),均購自美國Jackson ImmunoResearch公司。切片用PBS溶液洗3次,再用包含DAPI的抗熒光衰減試劑封片(美國Cell Signaling公司),用熒光顯微鏡進行圖像采集和分析。
1.5 圖像分析EC細胞數量
用熒光顯微鏡觀察5-HT和DAPI染色的免疫反應性,使用20倍高倍鏡獲取圖像。5-HT免疫反應呈紅色,DAPI復染細胞核為藍色,位于結腸黏膜內的5-HT免疫陽性細胞即EC細胞。每個切片隨機選取3個視野計數EC細胞數量和隱窩數量[24],計算隱窩的EC細胞平均數(3個視野的EC細胞總數÷3個視野的隱窩總數)。
1.6 結腸黏膜TPH1和SERT的mRNA表達水平
采用qRT-PCR檢測TPH1和SERT的mRNA表達水平。使用RNeasy Plus Mini試劑盒(德國Qiagen公司),從新鮮冷凍結腸黏膜組織中提取和純化總RNA。測定所有樣品的RNA量,凝膠電泳評估RNA完整性。使用QuantiNova Reverse Transcription試劑盒(德國Qiagen公司)進行反轉錄,將所得的cDNA用于qRT-PCR。
qRT-PCR在LightCycler 480實時熱循環儀(德國Roche公司)中進行,反應體積為20 μL。TPH1、SERT和內參基因β-肌動蛋白的mRNA水平采用QuantiNova SYBR Green PCR試劑盒(德國Qiagen公司)進行PCR檢測。PCR擴增條件為95 ℃、5 s,然后95 ℃、5 s和60 ℃、10 s進行40個循環。用2-ΔΔCt法將SERT和TPH1的mRNA水平與內參基因β-肌動蛋白進行標準化,并與健康對照組進行比較。所有引物購自上海英濰捷基公司,SERT的正義引物為5′-TTGGACGTGTGAGGAT GTGG-3′,反義引物為5′-TCCCTGTTCTCTC CTACGCA-3′;TPH1的正義引物為5′-ACGTCGA AAGTATTTTGCGGA-3′,反義引物為5′-AC GGTTCCCCAGGTCTTAATC-3′;β-肌動蛋白的正義引物為5′-CATGTACGTTGCTATCCAGGC-3′,反義引物為5′-CTCCTTAATGTCACGCACGA T-3′。
1.7 統計學處理
采用SPSS 16.0軟件進行數據分析,計量數據以均數±標準差表示。比較UC組和健康對照組時,用Studentt檢驗分析比較組間均數,用卡方檢驗分析計數資料。采用線性回歸分析確定5-HT釋放量與UC疾病活動度的相關性。P<0.05為差異有統計學意義。
2 結果
2.1 5-HT的含量
如圖1A所示,UC組結腸黏膜中5-HT含量[(67.48±21.14)ng/mg]顯著高于健康對照組[(24.69±7.08) ng/mg],差異有統計學意義(P<0.001),說明UC患者結腸黏膜5-HT的含量增加。
2.2 TPH1的表達
腸道5-HT絕大部分由EC細胞合成、儲存和分泌。5-HT生物合成的限速酶為TPH1。UC患者結腸黏膜中5-HT含量增加是否與5-HT合成增加有關?本研究采用RT-PCR定量研究TPH1的mRNA表達水平。結果顯示,與健康對照組(1.01±0.18)相比,UC組結腸黏膜中TPH1的mRNA水平(2.01±0.43)顯著升高,差異有統計學意義(P<0.001),見圖1B。免疫熒光法檢測發現,結腸黏膜隱窩內TPH1免疫反應性呈紅色,DAPI復染細胞核為藍色,UC組結腸黏膜中TPH1的免疫反應性較對照組升高,提示其TPH1蛋白表達水平顯著升高,見圖1C和1D。UC患者結腸黏膜中TPH1表達水平升高,提示5-HT合成增加。
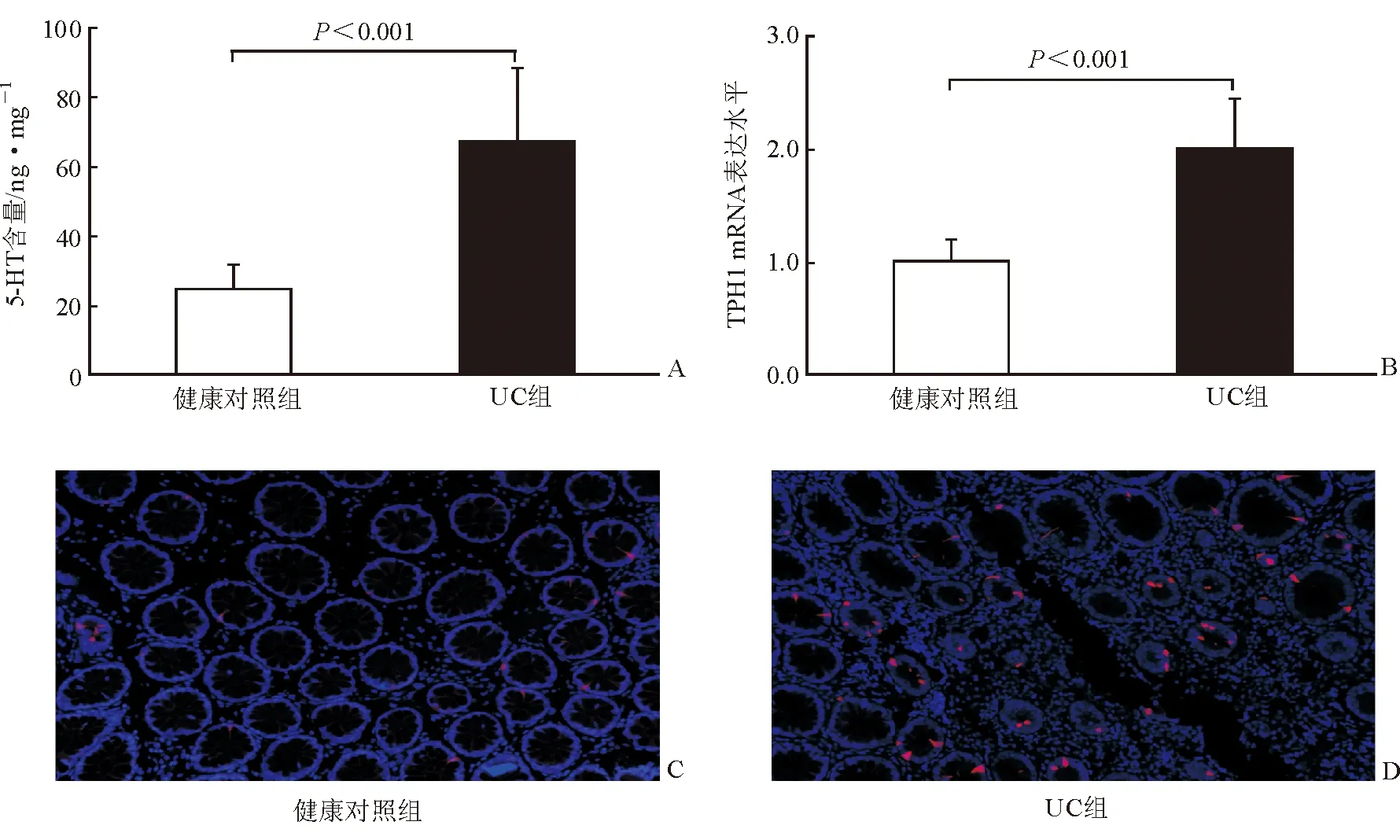
圖1結腸黏膜中5-HT含量和TPH1表達A兩組的5-HT含量比較B兩組的TPH1 mRNA表達水平比較C對照組TPH1的免疫熒光反應(紅色) ×200DUC組TPH1的免疫熒光反應(紅色) ×200
2.3 EC細胞的數量
為了確定結腸黏膜中5-HT含量增加是否與EC細胞數量增加有關,本研究通過免疫熒光標記結腸黏膜中5-HT來定量檢測EC細胞。如圖2A和2B所示,結腸黏膜隱窩內5-HT免疫反應性呈紅色,DAPI復染細胞核為藍色,UC組的5-HT免疫反應性較對照組升高。如圖2C所示,定量分析顯示UC組結腸黏膜中每個隱窩的EC細胞數量[(1.3±0.3)個]比對照組[(0.5±0.1)個]顯著增加(P<0.001)。

圖2結腸黏膜中EC細胞數量A對照組的5-HT免疫熒光反應(紅色) ×200BUC組的5-HT免疫熒光反應(紅色) ×200C兩組的EC細胞數量定量分析比較
2.4 5-HT的釋放量及其與UC疾病活動度的相關性
結腸黏膜5-HT釋放量如圖3A所示,與健康對照組[(15.18±3.42)ng/mg]相比,UC患者5-HT釋放量顯著增加[(81.16±16.62)ng/mg],差異有統計學意義(P<0.001)。這表明隨著TPH1表達水平的升高,5-HT含量和EC細胞數量的增加,結腸黏膜5-HT釋放量也增加。相關分析顯示,UC組結腸黏膜5-HT釋放量與UC疾病活動度(Mayo評分)呈線性正相關(r=0.735,P=0.001),見圖3B。

圖3結腸黏膜5-HT釋放量及其與UC疾病活動度的相關性A兩組結腸黏膜5-HT釋放量比較B結腸黏膜5-HT釋放量與UC疾病活動度的相關性分析
2.5 SERT的表達
上述數據表明UC組結腸黏膜5-HT的釋放量增加,然而,如果5-HT釋放后被再攝取滅活的能力受到影響,5-HT信號通路可能改變。為了確定SERT在UC組結腸黏膜中的表達是否發生改變,本研究采用免疫熒光法檢測發現,SERT廣泛表達于結腸黏膜細胞,陽性表達的細胞染色為紅色。與對照組相比,UC患者結腸黏膜中SERT的免疫反應性顯著降低(見圖4A和4B),提示結腸黏膜中SERT的蛋白表達水平也降低。本研究采用qRT-PCR法檢測SERT的mRNA表達水平,發現與對照組(1.05±0.33)相比,UC組結腸黏膜中SERT mRNA表達水平(0.33±0.14)顯著降低,差異有統計學意義(P<0.001),見圖4C。

圖4結腸黏膜中SERT表達水平A對照組的SERT免疫熒光反應(紅色) ×200BUC組的SERT免疫熒光反應(紅色) ×200C兩組的SERT mRNA表達水平比較
3 討論
UC發病率在全球普遍升高,其發病機制尚未完全清楚。5-HT在腸道運動、分泌和感覺功能中起著重要作用,并可加重結腸炎動物模型的炎性反應[5],因此UC發病可能與5-HT信號通路的改變有關。有關UC患者結腸黏膜5-HT信號通路異常的研究報道較少,而且結果不一致[2]。
本課題對UC患者結腸黏膜5-HT信號通路的變化以及5-HT釋放量與UC疾病活動度的相關性進行了研究。腸黏膜中5-HT信號通路涉及5-HT的合成、儲存、釋放和再攝取降解。本研究結果表明,5-HT信號通路的幾個關鍵環節在UC患者中發生改變,包括結腸黏膜中EC細胞增加、5-HT含量增加、合成酶TPH1表達上調以及SERT下調而導致的5-HT再攝取改變,這些改變導致UC患者結腸黏膜中5-HT的有效性增強。此外,本研究還發現結腸黏膜5-HT釋放量與UC疾病活動度呈正相關。
本研究發現,UC組結腸黏膜中EC細胞數、5-HT含量和TPH1表達水平高于健康對照組,表明UC組結腸黏膜中5-HT的有效性增強。EC細胞中5-HT合成的限速酶TPH1表達升高,提示EC細胞合成5-HT增加。以往研究表明,UC患者結腸黏膜中EC細胞數量和5-HT含量增加[7-8],與本研究結果一致。然而,也有研究發現重度UC患者的結腸黏膜中EC細胞數量減少[9],這可能是由于重度UC患者結腸黏膜損傷導致EC細胞數量減少,也可能與EC細胞計數方法有關(EC細胞數量÷上皮細胞數量),UC患者結腸黏膜細胞增生可能導致EC細胞計數結果減少。
本研究發現UC患者結腸黏膜5-HT釋放量增加,提示結腸黏膜中5-HT含量和EC細胞數量的增加改變了5-HT的釋放量。動物實驗發現結腸炎性反應時5-HT釋放量增加[10],但也有研究發現UC患者結腸黏膜5-HT釋放量無改變[9],這可能與檢測方法有關,結腸黏膜5 min的5-HT釋放量可能不足以反映炎性反應的黏膜與正常黏膜的差異。本研究檢測結腸黏膜24 h的5-HT釋放量,發現炎性反應黏膜較正常黏膜釋放更多的5-HT。釋放量增加的5-HT可能作用于各種5-HT受體,從而誘導更強的生物學作用。動物實驗發現,5-HT可誘導動物結腸炎性反應加重[11],TPH1基因敲除小鼠[5]和TPH1抑制劑[12-13]均可使小鼠的結腸炎性反應顯著減輕。本研究發現,5-HT釋放量與UC疾病活動度(Mayo評分)呈正相關性。因此,UC患者結腸黏膜5-HT釋放量增強,可能導致結腸炎性反應加重。
本研究還發現,UC組結腸黏膜5-HT攝取轉運蛋白SERT的mRNA和免疫反應水平下調。以往研究發現UC患者結腸黏膜中SERT表達在蛋白和轉錄水平上均顯著降低[9,14],動物結腸炎模型研究也有類似的結果[15],本研究結果與以往研究結果一致。臨床研究發現,選擇性5-HT再攝取抑制劑的應用與顯微鏡下結腸炎有關[16]。缺乏SERT的轉基因小鼠可出現更嚴重的結腸炎[17]。因此,UC患者結腸黏膜SERT表達降低,提示5-HT再攝取滅活可能受損,可能也導致了5-HT有效性增強,導致結腸炎性反應加重。
總之,本研究結果表明,UC患者結腸黏膜5-HT信號通路多個環節發生異常改變,包括EC細胞數量增加、5-HT合成酶TPH1表達升高、5-HT含量和釋放量增加,以及5-HT再攝取轉運蛋白SERT表達下調,導致結腸黏膜5-HT的有效性增強。此外,結腸黏膜5-HT釋放量與UC疾病活動度呈正相關。鑒于5-HT在腸道運動、感覺、分泌功能和炎性反應中的作用,UC患者的臨床癥狀可能與結腸黏膜的5-HT信號通路異常改變有關。今后有必要進一步研究5-HT在UC患者結腸炎性反應中的作用,以及以5-HT信號通路為靶點的藥物對UC患者的治療作用[2,18]。

