高溫下乙醇/異辛烷混合物著火特性的反應動力學研究
秦明元,何本壯,陳日新,樊祥山,王井山,王錫斌
(西安交通大學能源與動力工程學院,710049,西安)
在當今石油資源不斷減少的大背景下,燃料乙醇C2H5OH成為國際上公認的可降低汽車尾氣排放和替代石油燃料的清潔能源。乙醇具有辛烷值高、與汽油無限互溶、污染少的特點,可以代替MTBE等作為汽油辛烷值改進劑,有助于提高燃油經濟性,降低排放,具有廣闊的應用前景[1-2]。
著火滯燃期作為內燃機工作過程中的一個重要參數,直接影響到發動機的動力指標、噪音大小以及工作粗暴性,同時也是內燃機燃燒過程的重要表征參數,因此研究燃料著火滯燃期特性具有很重要的意義。在燃燒研究領域,異辛烷IC8H18與汽油性質接近,通常用異辛烷作為汽油的替代燃料進行分析研究。Mittal等提出了乙醇燃燒詳細機理,可以準確預測乙醇在低溫和高壓下的自燃特性,并在壓力p為1~5 MPa、溫度T為825~985 K和當量比Φ為0.3~1.0的條件下進行了著火滯燃期的驗證[3]。Curran提出了高壓下異辛烷空氣的詳細反應機理,并利用該機理模擬了激波管中的著火滯燃期,結果表明該模型與實驗具有良好的吻合性[4]。Shen等利用激波管測定了異辛烷在p為0.7~5.8 MPa、T為868~1 300 K下,當量比分別為0.25、0.5、1時的著火滯燃期數據,大多情況下Ar作為稀釋劑的混合燃料比N2作為稀釋劑的點火時間短20%[5]。Bogin等在一臺著火質量測試儀上對乙醇/異辛烷混合燃料在p為0.5~1.5 MPa、T為623~993 K、當量比為0.7~1.0時進行了著火滯燃期的研究,發現隨著乙醇濃度的增加,負溫度特性區域減少[6]。Barraza等利用自由活塞式快速壓縮設備對乙醇、異辛烷和異辛烷/乙醇混合燃料在p為1 MPa、T為900~1 080 K、當量比為1.0的著火滯燃期進行了實驗研究,結果表明乙醇/異辛烷混合燃料的反應受到異辛烷和乙醇相互之間反應的限制[7-8]。
綜上所述,針對純乙醇燃料著火滯燃期的研究較少,異辛烷及乙醇/異辛烷混合燃料的著火滯燃期特性研究雖然較多,但大多集中在溫度低于1 000 K的工況,而內燃機工作混合氣處于更高的溫度狀態,此時通過著火滯燃期結合反應機理及反應路徑,可以更好地反映缸內燃料燃燒的化學反應過程。因此,本文通過激波管研究了高溫條件下(1 100~1 900 K)乙醇/異辛烷混合燃料著火滯燃期的變化規律,可為進一步完善乙醇/異辛烷混合燃料的機理提供實驗基礎。
1 實驗裝置與燃料組分
1.1 實驗裝置
激波管實驗平臺可被用來測量不同燃料的著火滯燃期,是研究燃料自燃特性、優化化學反應機理的理想設備,實驗裝置如圖1所示。圖中間的雙膜機構將激波管分成2.0 m的高壓驅動段和7.4 m的低壓被驅動段,低壓被驅動段右端為實驗段,附近等距布置了4個壁面壓力傳感器,壓力傳感器之間并聯有3個時間間隔計數器,用于獲得實驗段端面的入射激波速度,實驗段端面為OH*光信號傳感器,用于測量OH*濃度的變化[9]。
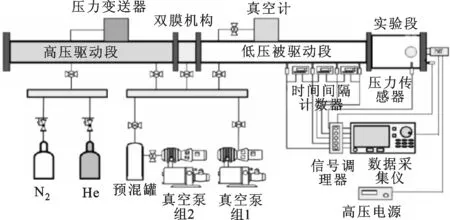
圖1 激波管實驗裝置示意圖
配氣時,首先計算乙醇、異辛烷、Ar、O2各分壓,按照設計壓力比,將乙醇和異辛烷注入到抽過真空的不銹鋼預混罐中,控制罐內壓力要低于二者飽和蒸氣壓的1/2,以保證兩種液體完全氣化與混合。將相對應比例的He、N2充入高壓段和夾膜段,低壓段充入預混罐中的混合氣。當氣體進入后,打開夾膜段和排氣閥門,使得高壓驅動段與夾膜段之間存在的壓差足以穿透夾膜;等待雙模機構破膜后,利用實驗段右端面的光電倍增管(PMT)測量OH*光信號作為著火開始的判斷依據[10]。本文的實驗數據均為同一條件下進行多次實驗,在誤差范圍內取平均值所得,具有一定的重復性。
著火滯燃期的定義不同,得出的實驗結果不同。本實驗中定義實驗段端面反射激波形成的時刻,即將壓力曲線上漲達到目標壓力的時刻定義為著火滯燃期的零點,選擇OH*發光自由基信號曲線上升過程中斜率最大處的切線反推至零線的時刻點作為開始劇烈燃燒的時刻,二者之間的時間間隔即為著火滯燃期[11-12],反射激波溫度為1 200 K、壓力為1 MPa、當量比為1.0條件下乙醇/異辛烷/Ar/O2混合壓力和OH*信號隨時間的變化如圖2所示。由圖2可知,E50(見表1)的著火滯燃期為2 411 μs,可使結果受環境影響最小,減小了后處理過程中產生的誤差,因而得到了燃燒學界的廣泛使用[13]。
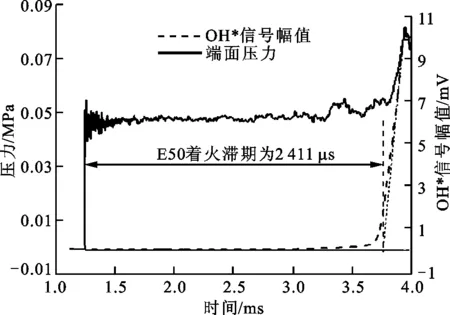
圖2 反射激波管和OH*信號演變過程
1.2 燃料組分
目前,低摻比醇類混合燃料研究較多,中高摻比的研究相對較少,高摻醇比和純乙醇燃料是目前的研究熱點。因此,本文選擇乙醇摩爾分數分別為0、50%、75%和100%的乙醇/異辛烷混合燃料(分別用E0、E50、E75和E100表示)進行分析,實驗采用Ar稀釋,初始壓力為0.2、1 MPa,溫度為1 100~1 900 K,當量比為1.0。4種不同混合燃料的實驗配氣組分如表1所示。
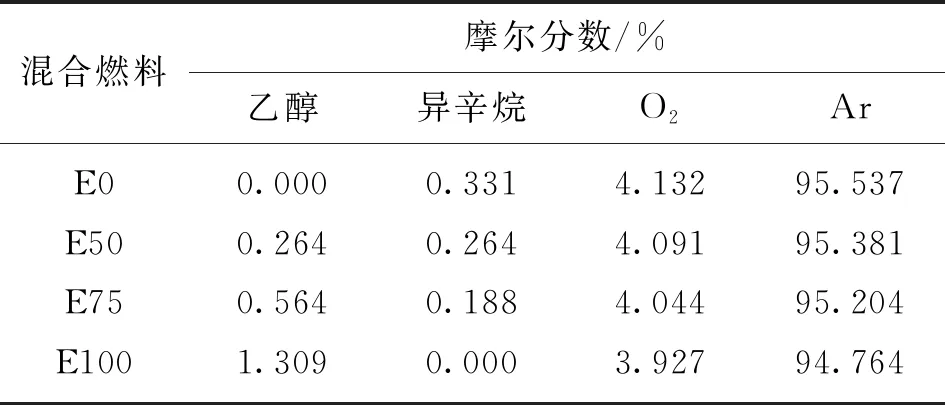
表1 混合燃料的實驗配氣組分
混合燃料著火滯燃期的模擬計算采用CHEMKIN-Pro軟件的SENKIN子代碼,采用定容、絕熱、零維反應器模型進行研究,SENKIN中著火滯燃期定義為從反應開始時刻到溫度梯度達到最大值之間的時間間隔[14]。文獻[15]的異辛烷機理較為完善,且包含詳細的乙醇機理,因此本文采用文獻[15]的異辛烷機理來模擬計算乙醇/異辛烷混合燃料的著火滯燃期。
2 實驗結果與分析
2.1 乙醇摻混比對滯燃期的影響
初始壓力為0.2、1 MPa時乙醇/異辛烷混合燃料著火滯燃期隨乙醇摻混比的變化關系如圖3所示。由圖3可知:初始壓力為0.2、1 MPa時乙醇/異辛烷混合燃料的著火滯燃期隨著乙醇含量的增加而縮短,而且在較低溫時乙醇摻比變化對著火滯燃期的影響效果和較高溫度時相比更明顯,這時溫度升高也會對著火滯燃期產生影響;乙醇含量較高時,著火滯燃期變化更明顯,當異辛烷中加入乙醇后,由于乙醇中的OH基,影響了重要反應的活性,而燃料高溫裂解會產生OH基,從而促進燃料分子的氧化,有效地縮短的著火滯燃期;T=1 452 K時,E0的著火滯燃期為373.7 μs,E50著火滯燃期為206 μs,時間縮短了44.9%;E100著火滯燃期為57.7 μs,與E0的著火滯燃期相比縮短了84.6%。
(a)p=0.2 MPa
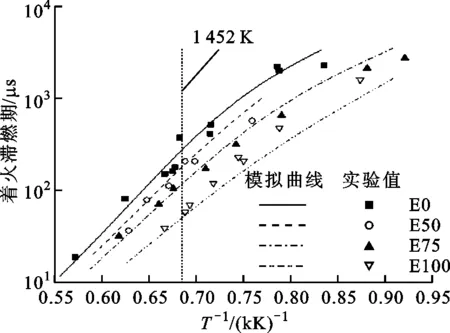
(b)p=1 MPa圖3 乙醇/異辛烷混合燃料滯燃期隨乙醇摻混比的變化關系
2.2 初始壓力對滯燃期的影響
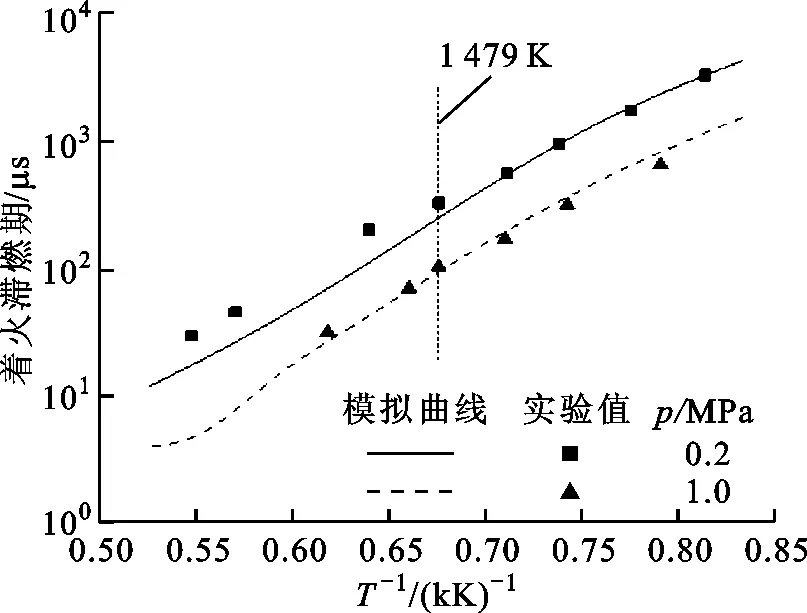
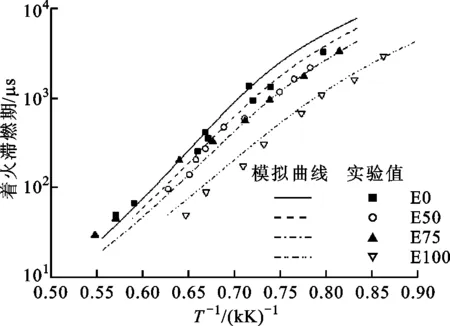
圖4 E75在不同壓力、溫度下滯燃期的實驗、模擬值
壓力為0.2、1 MPa、溫度為1 200~1 900 K時E75著火滯燃期的變化如圖4所示。由圖4可知,著火滯燃期的對數值與溫度的倒數近似呈線性關系。E75混合燃料的著火滯燃期隨溫度的升高而減小,隨壓力的增大而減小,T=1 479 K時,E75在壓力為0.2 MPa時著火滯燃期為329 μs,而在壓力為1 MPa時著火滯燃期為103.4 μs,縮短了68.6%。當初始溫度升高時,外界環境為化學反應提供了更多的能量,從而更容易達到反應所需的活化能,所需的時間更短,混合燃料的著火滯燃期縮短。溫度一定時可認為分子動能恒定,根據分子碰撞理論,壓力升高會減小分子的平均自由歷程,增大分子之間的碰撞頻率,從而促進燃料化學反應,使得混合燃料的著火滯燃期縮短。
2.3 混合燃料滯燃期的Arrhenius擬合公式
由實驗結果可對不同乙醇摻混比混合燃料進行多元線性回歸擬合,Arrhenius公式為
(1)
式中:τ為滯燃期,μs;A為指前因子;B為壓力指數;Ea為活化能,kJ/mol;p為激波管端面的實際壓力,MPa;Ru=8.314 kJ/(mol·K-1)為通用氣體常數;T為激波管端面的實際溫度,K。式(1)表征了溫度和壓力對滯燃期的影響,Arrhenius公式中各參數隨乙醇摻混比的變化如表2所示。
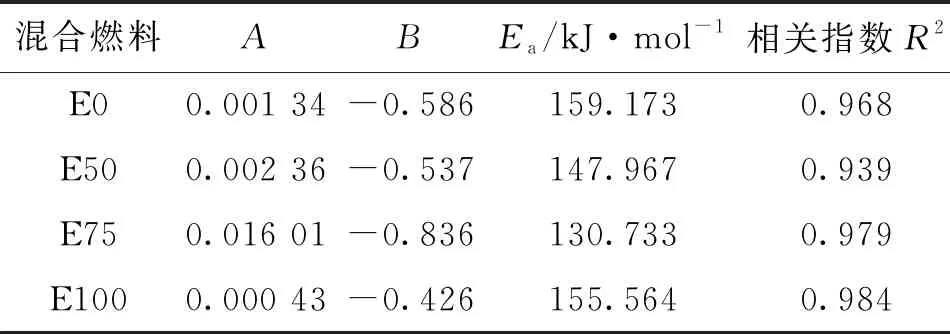
表2 不同乙醇摻混比下的Arrhenius公式參數
由表2可知,壓力指數B為負數,印證了乙醇/異辛烷著火滯燃期隨壓力的增大而減小,并且異辛烷著火滯燃期壓力指數的絕對值大于乙醇(E100)壓力指數的絕對值,這說明壓力對異辛烷著火滯燃期的影響大于乙醇,著火滯燃期與溫度的倒數呈正相關,也說明著火滯燃期隨溫度的增大而減小,各摻混比擬合式的相關指數R2均大于0.9。乙醇/異辛烷混合燃料滯燃期擬合值和實驗值的對比如圖5所示,可知擬合值與實驗值吻合良好。
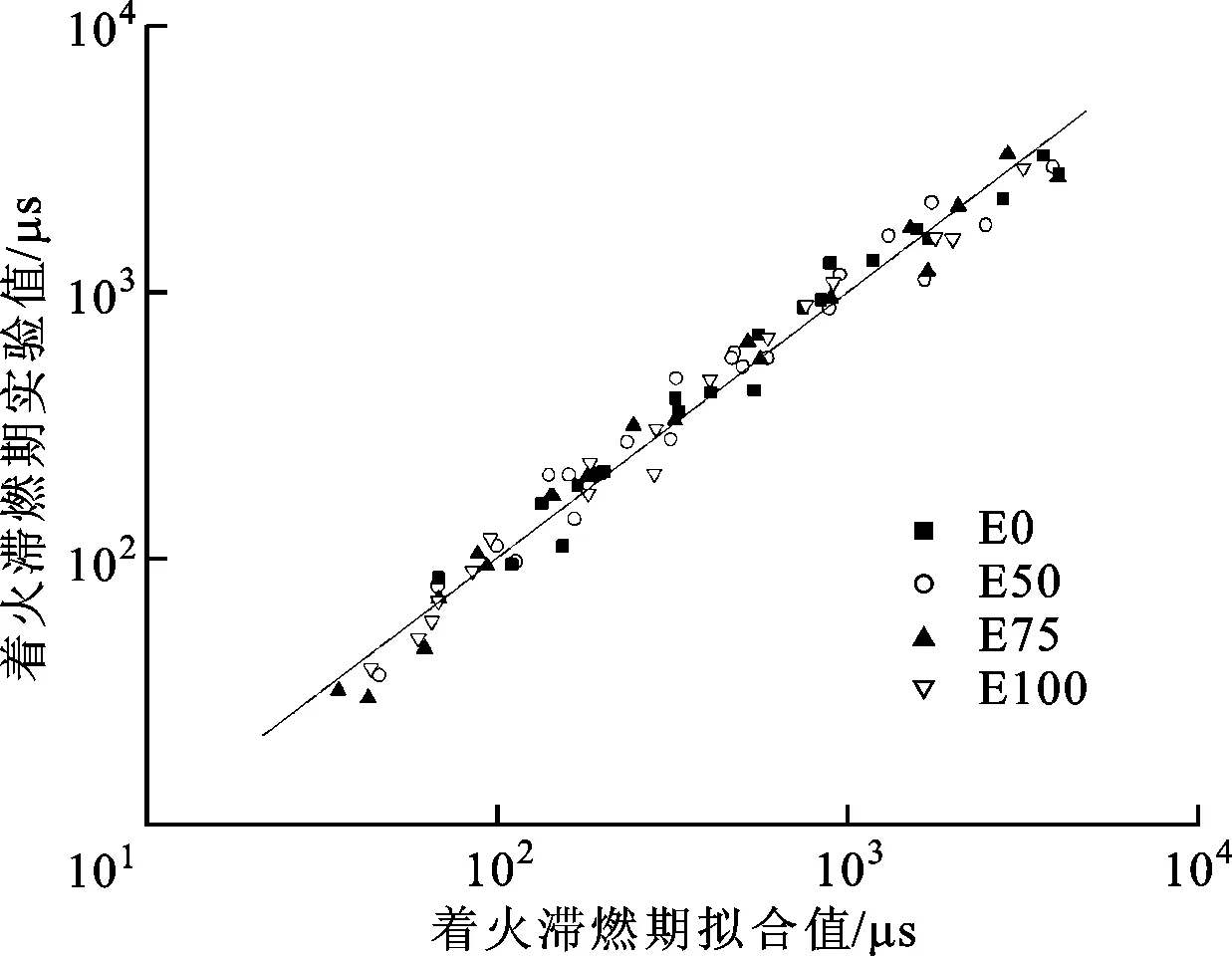
圖5 乙醇/異辛烷混合燃料滯燃期擬合值和實驗值對比
2.4 化學反應路徑分析
為深入理解高溫條件下乙醇/異辛烷的化學反應歷程,通過模擬軟件CHEMKIN,得到Φ=1.0、T=1 600 K、p=1 MPa條件下E25、E75的簡化反應路徑,如圖6所示。
乙醇在高溫下的氧化過程主要通過燃料分子的脫氫反應及燃料的裂解反應,乙醇的主要高溫反應式為C2H5OH+H?SC2H4OH+H2、C2H5OH+H?PC2H4OH+H2、C2H5OH?C2H4+H2和C2H5OH?CH2OH+CH3。乙醇的脫氫反應生成物不同,主要是由于C2H5OH的H原子有3個位置[16],其中α位氫原子和OH基團最近,鍵能最低,最容易發生脫氫反應,因此有超過一半的乙醇在高溫條件下α位發生脫氫反應生成SC2H4OH,乙醇氧化的最終產物為醛類和烯烴,其中醛基對甲基等自由基有一定的消耗作用,促進燃料氧化。異辛烷的主要高溫反應式為IC8H18?YC7H15+CH3、IC8H18?PC7H15+CH3、IC8H18?TC4H9+IC4H9和IC8H18?NCOC5H11+IC3H7。異辛烷主要是通過裂解產生YC7H15、PC7H15兩種同分異構體,進而再進行裂解消耗,異辛烷氧化的最終產物以烯烴為主。
由圖6可知:在相同工況下,隨著乙醇摻混比的增大,乙醇氧化過程中的脫氫反應比例減少,分解反應比例增多;隨著乙醇含量的增加及乙醇的裂解反應增多使得乙烯(C2H4)的含量明顯增加,而乙烯基(C2H3)是烴類氧化過程中重要的高活性C2類自由基[14],能促進燃料分子的氧化過程。
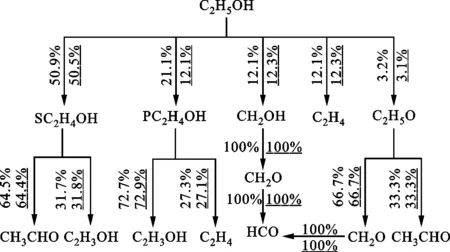
數值有下劃線表示E75的,無下劃線表示E25的(a)乙醇反應路徑
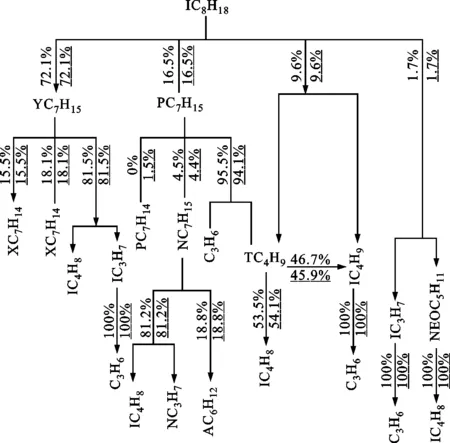
數值有下劃線表示E75的,無下劃線表示E25的(b)異辛烷反應路徑圖6 T=1 600 K、p=1 MPa、Φ=1.0時E25、E75的反應路徑
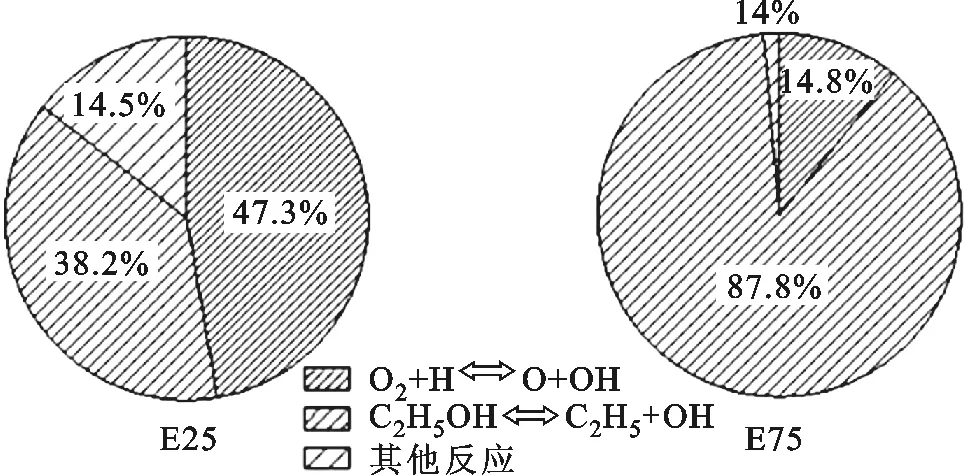
(a)E25 (b)E75圖7 E25、E75中異辛烷的OH基生成路徑對比
E25、E75混合燃料的異辛烷反應路徑中OH基生成路徑的對比如圖7所示。1 600 K時,異辛烷的反應中OH基的生成主要來自反應O2+H?O+OH和反應C2H5OH?C2H5+OH中,由圖7可知,E25反應C2H5OH?C2H5+OH占生成OH基總反應的38.2%,E75占比增至87.8%,隨著乙醇含量的增加,混合燃料中的OH基得到顯著增加,從而促進燃料分子的氧化。無論是從乙醇反應路徑分析還是異辛烷反應路徑分析,隨著乙醇含量的增加乙醇/異辛烷混合燃料的反應速率都增加,因而著火滯燃期縮短。
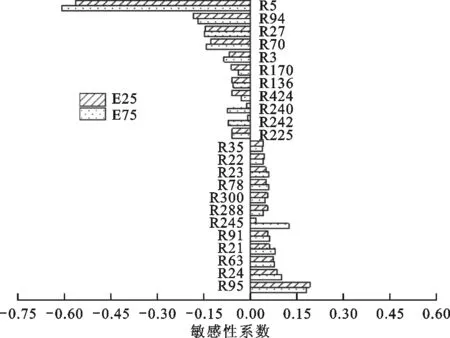
2.5 著火滯燃期敏感性分析
本文使用正規化敏感性分析溫度為1 300、1 600 K時,乙醇摻混比的增加對乙醇/異辛烷混合燃料著火主要反應速率的影響。敏感性系數為
(2)
式中:Si為著火滯燃期的敏感性系數;ki為第i個反應的反應速率。利用Atef Nour簡化機理(189個組分,912個反應),通過模擬計算得到最影響滯燃期的前23個反應,如圖8所示,敏感性分析中涉及的主要反應方程式如表3所示。
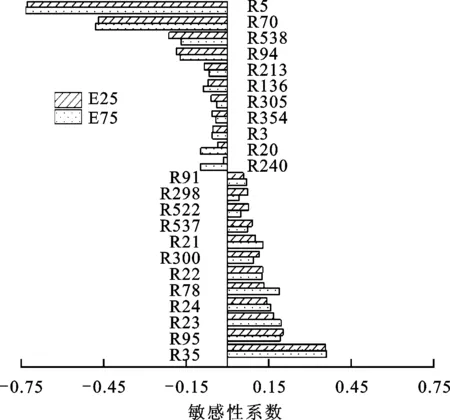
(a)1 300 K
(b)1 600 K圖8 p=1 MPa、Φ=1.0時E25、E75著火滯燃期的敏感性分析
由圖8可知,無論是溫度為1 300 K還是1 600 K,著火滯燃期敏感性系數絕對值最大的都是反應R5,其中敏感性系數為負數時表示促進反應進行,正數時表示抑制反應進行。圖8中敏感性系數為負
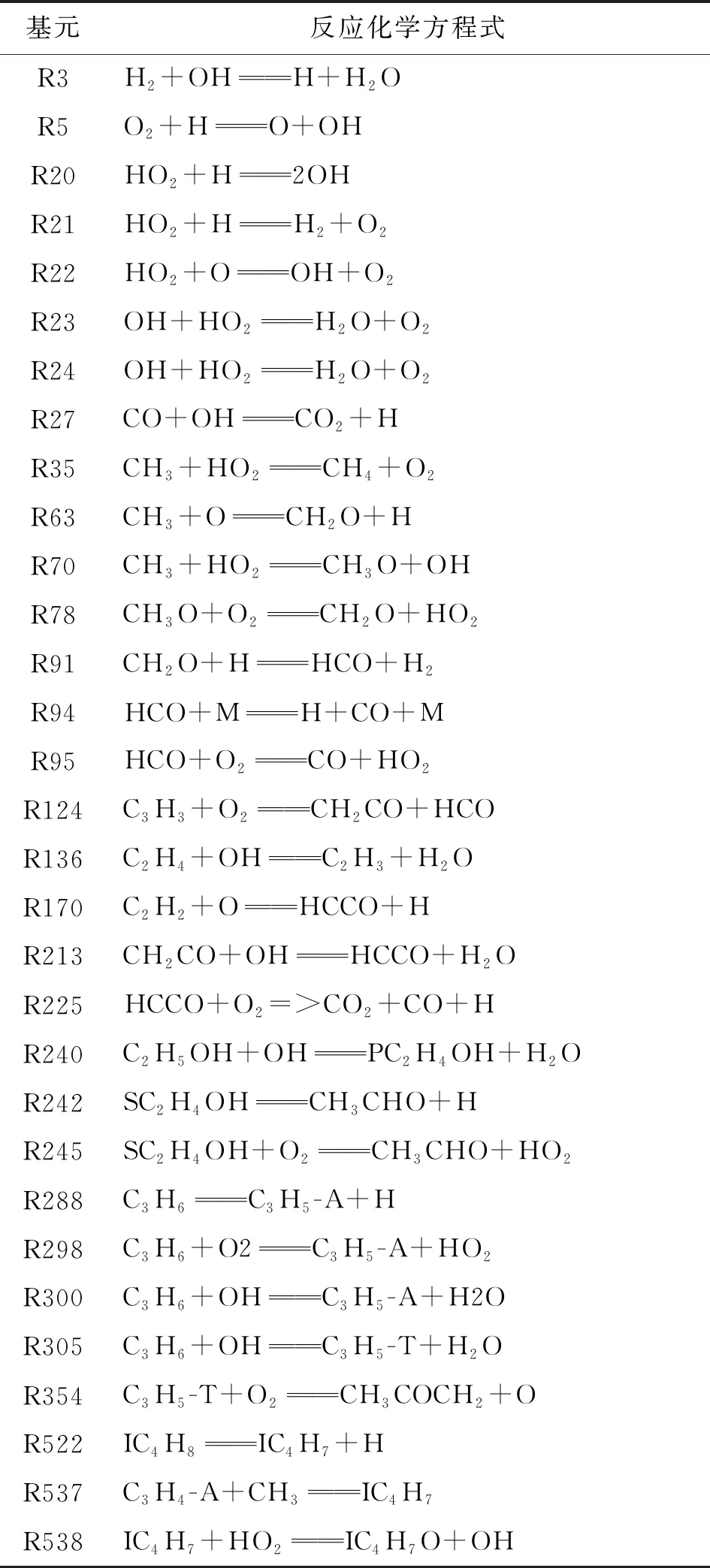
表3 乙醇/異辛烷/O2/Ar反應系統關鍵基元反應
數的公共反應分別是R5、R94、R70、R3、R136、R240,其中只有R3的滯燃期敏感性隨著溫度的升高而增大,這是因為高溫下更容易產生OH自由基從而促進R3的進行,而對于R136、R240,雖然反應物中也含有OH自由基,但因為另一反應物都為C2物質,而高溫下主要以低碳分子進行反應,因而敏感性下降。反應R136在1 300 K時敏感性隨乙醇摻混比增大而增大,1 600 K時隨摻混比增大而減小。反應R240隨乙醇摻混比增加敏感性變化最大,這是由于乙醇含量的增加使得OH基濃度大幅增大導致,是摻混乙醇后影響著火滯燃期的關鍵反應。
圖8中敏感性為正數,即抑制氧化進行的公共反應占大多數,只有反應R537、R522、R298、R63為獨有反應,這是因為高溫下更易發生低碳分子的反應,雖然R537、R522、R298在1 300 K時敏感性系數較大,但在1 600 K時幾乎為0。在公共反應中,所有反應的滯燃期敏感性系數均隨溫度的升高而降低,其中反應R23、R78、R91的敏感性系數隨著乙醇摻混比的增加而增大,主要是因為反應物中含有乙醇氧化生成的OH自由基和醛基,且反應R78、R91構成鏈式反應,加快反應進行。
3 結 論
本文在壓力為0.2或1 MPa、溫度為1 100~1 900 K、當量比為1.0條件下,研究了高溫環境下不同摻比的乙醇/異辛烷混合燃料著火滯燃期變化規律,得到如下結論。
(1)隨著壓力和乙醇摻混比的升高,混合燃料的著火滯燃期均有所減小;溫度越高著火滯燃期越短,且著火滯燃期的對數值與溫度的倒數近似呈線性關系。
(2)將實驗數據進行Arrhenius公式的擬合,通過擬合公式計算的擬合值與實驗值吻合良好,根據擬合公式的壓力指數發現,壓力對異辛烷著火滯燃期的影響大于對乙醇滯燃期的影響。
(3)通過反應路徑和滯燃期敏感性分析發現,混合燃料在燃燒過程中,隨著乙醇摻混比的增加,乙醇產生的OH等自由基會促進反應的進行,從而導致混合燃料的著火滯燃期縮短。

