嗜酸乳桿菌對小鼠潰瘍性結腸炎模型的保護機制研究*
任 聰,陳向東,汪 輝,鮑張杰,練家惠
中國藥科大學 生命科學與技術學院,南京 210009
潰瘍性結腸炎(ulcerative colitis,UC)是炎癥性腸病的一種,潰瘍性結腸炎的發病原因尚不明確,可能與遺傳、環境、免疫紊亂和腸道菌群失調等因素有關。臨床對于潰瘍性結腸炎主要應用以柳氮磺胺吡啶為代表的氨基水楊酸類藥物作為主要的治療藥物[1],對大部分輕、中度患者可收獲較好的療效,但對部分患者,特別是長期服藥的患者存在易復發和副作用大等缺陷[2],且長期服藥價格較高。因此,尋找廉價且副作用小的新療法成為近年來醫藥學界的研究熱點。
近年來益生菌在UC治療中越來越受到人們的關注[3]。本課題組先前對多株益生菌進行耐酸和耐膽鹽抗性篩選,得到一株抗性最佳的嗜酸乳桿菌作為試驗菌株。本研究旨在通過探究嗜酸乳桿菌對葡聚糖硫酸鈉誘導的小鼠潰瘍性結腸炎的保護作用及其作用機制,為臨床應用嗜酸乳桿菌治療和緩解潰瘍性結腸炎提供依據。
1 材 料
1.1 實驗動物和菌株
健康SPF級ICR小鼠40只,雌雄各半,體質量(18~20)g,購自南京市江寧區青龍山動物繁殖場,合格證編號:201728275,飼養于中國藥科大學動物實驗中心。嗜酸乳桿菌(Lactobacillus acidophilus)由中國藥科大學微生物學教研室提供。
1.2 藥品與試劑
MRS培養基(北京奧博星生物科技有限公司);RNAiso Plus、2×PrimeSTAR Max Premix(Takara);5×All-In-One MasterMix(南京愛必夢生物材料有限公司);2×UltraSYBR Mixture(康為世紀生物科技有限公司);柳氮磺胺吡啶(上海信誼天平藥業);葡聚糖硫酸鈉(MP Biomedicals);重蒸水自制。
1.3 儀器
CFX96 real-time PCR儀、S1000TM Thermal Cycler PCR儀(美國伯樂有限公司)。
2 方 法
2.1 DSS誘導小鼠UC建模和給藥
將40只SPF級ICR小鼠隨機分為4組,每組10只,分別為模型組、陽性藥組、菌液組和空白組。
模型組、陽性藥組和菌液組均使用葡聚糖硫酸鈉(dextran sulfate sodium,DSS)造模,方法為以自由飲用的方式給予小鼠質量分數3%的DSS水溶液,時長為7天,致造模成功。
模型組小鼠灌胃生理鹽水,灌胃體積為0.5mL·d-1;菌液組小鼠灌胃嗜酸乳桿菌菌液,菌濃度為1×108CFU·mL-1,體積為 0.5 mL·d-1;陽性藥組小鼠灌胃柳氮磺胺吡啶,將柳氮磺胺吡啶溶于生理鹽水,配制成 20mg·mL-1溶液,依體重給藥,終劑量為500mg·kg-1,時長為7天。空白組小鼠仍正常飼養。
2.2 潰瘍性結腸炎癥狀評估
每日稱量各組小鼠體重,并觀察小鼠的活動情況、外觀變化、飲食情況、糞便性狀和便血情況,參照Liu W等[4]的方法,對小鼠進行疾病活動指數(disease activity index,DAI)評分,標準為:①體重減輕(0,無減輕;1,減輕 1%~5%;2,減輕 6%~10%;3,減輕 10%~20%;4,減輕超過 20%)。②腹瀉(0,正常;2,稀便;4,水樣腹瀉)。③便血(0,無出血;2,輕微出血;4,大出血)。實驗第8天采用頸椎脫臼法處死小鼠,解剖小鼠后取出結腸段,在冷PBS溶液中清洗后測量結腸長度。用剪刀剪取3~5 mm的結腸段落,置于4%多聚甲醛溶液固定24 h,進行石蠟包埋后切片,厚4μm,HE染色,顯微鏡下觀察。
2.3 免疫組化法檢測結腸組織p-STAT3和IL-6表達
將結腸組織的石蠟切片在恒溫烘箱中于60℃下干燥1 h,在0.01 mol·L-1PBS溶液洗滌3次,每次5 min,用無水乙醇洗滌10 min,重蒸水洗滌兩次。將石蠟切片置于微波爐中,100℃保持8 min以進行抗原修復。過氧化氫(3%)用于抑制內源性過氧化物酶活性,封閉溶液用于阻斷非特異性抗原。將切片與抗p-STAT3和IL-6抗體在4℃下孵育過夜,然后與第二抗體孵育后進行DAB染色。最后,將切片脫水、固定,在顯微鏡下觀察。
2.4 qRT-PCR檢測miR-214相關基因表達量
取小鼠結腸組織在無核酶條件下勻漿,加TRIZOL提取總RNA后進行逆轉錄反應制備cDNA,需在冰面上避光操作。以GAPDH為內參基因,利用Ultra SYBR Mixture試劑盒進行qRT-PCR。引物序列見表1。反應體系為20μL。基因的表達水平倍數用相對定量法,即2-ΔΔCt法計算。計算公式如下:
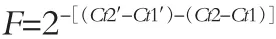
Ct2′為待測組目的基因平均Ct值;Ct1′為待測組內參基因平均Ct值;Ct2為對照組目的基因平均Ct值;Ct1對照組內參基因平均Ct值。

表1 qRT-PCR引物序列
2.5 統計學分析
采用統計學軟件GraphPad Prism5和SPSS19.0處理實驗數據,組間比較進行t檢驗。P<0.05有顯著性差異。
3 結 果
3.1 潰瘍性結腸炎癥狀評估
在各組小鼠中,模型組小鼠體重嚴重下降,萎靡不振,毛發無光澤,實驗第3天出現糞便稀軟、不成形,粘附于肛門周圍,第6天出現血便,證明造模成功。陽性藥組和菌液組小鼠各項癥狀均有明顯好轉,未出現嚴重血便。空白組體重穩步增長,各項體征正常。
由圖1可見,模型組小鼠體重較空白組顯著下降(P<0.01),陽性藥組和菌液組小鼠體重下降程度較模型組顯著減小(P<0.05)。
由圖2可見,模型組小鼠DAI評分較空白組顯著增加(P<0.01),而陽性藥組和菌液組小鼠DAI評分較模型組顯著降低(P<0.01)。以上結果表明,嗜酸乳桿菌對DSS誘導小鼠UC有明顯的緩解作用。
由圖3可見,模型組小鼠結腸長度較空白組明顯縮短(P<0.01),說明模型組小鼠有嚴重的潰瘍性結腸炎癥狀,而陽性藥組和菌液組小鼠結腸長度較模型組顯著增加(P<0.01)。

圖1 4組體重變化曲線(n=10)

圖2 4組DAI評分(n=10)
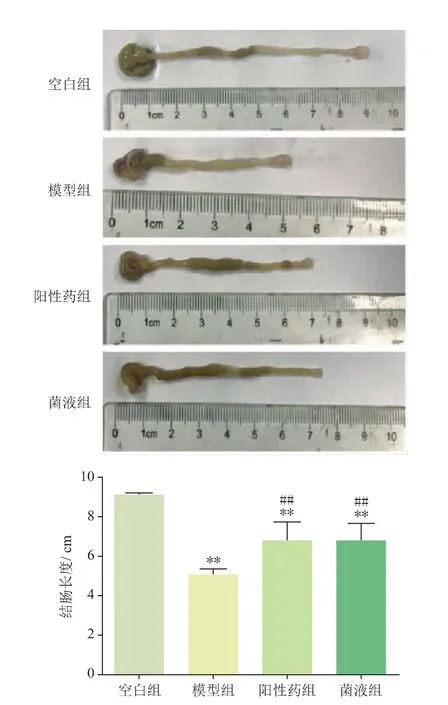
圖3 4組結腸拍照的長度比較(n=10)
3.2 結腸組織病理學變化
結腸組織HE染色觀察發現,由圖4可見空白組(A)小鼠結腸壁清晰,上皮完整,腺體排列整齊,隱窩正常,杯狀細胞豐富,無炎細胞浸潤。模型組(B)小鼠結腸上皮壞死脫落,腸壁變薄,腺體凌亂,潰瘍癥狀嚴重,黏膜肌層出現大量炎細胞浸潤。陽性藥組(C)和菌液組(D)小鼠結腸上皮潰瘍癥狀有明顯改善,無嚴重潰瘍癥狀。

圖4 4組結腸組織HE染色觀察(200×)
3.3 結腸組織IL-6、p-STAT3蛋白表達結果
通過免疫組化法對比IL-6、p-STAT3在各組小鼠結腸組織中的表達情況。由圖5可見,與空白組相比,在模型組中,IL-6和p-STAT3表達呈強陽性。與模型組相比,陽性藥組和菌液組表達呈弱陽性。
3.4 miR-214通路相關基因表達結果
qRT-PCR檢測結果如圖6所示,與空白組比較,模型組 miR-214、IL-6、TNF-α 基因表達量明顯提高(P<0.01);與模型組比較,陽性藥組和菌液組miR-214、IL-6、TNF-α 表達量顯著降低 (P<0.01)。與空白組比較,模型組PTEN、PDLIM2基因表達明顯降低(P<0.01);與模型組比較,陽性藥組和菌液組PTEN、PDLIM2 基因表達顯著提高(P<0.01)。
4 討 論
本研究結果顯示,模型組小鼠較空白組小鼠存在明顯的潰瘍性結腸炎癥狀,陽性藥組和菌液組小鼠體重變化等各項癥狀均顯著改善,結腸組織完整程度較好,已接近空白組。此前研究證明,益生菌具有免疫調節功能,改善黏膜上皮屏障功能和競爭性抑制致病菌在腸上皮的定植等[5,6]。因為益生菌需經胃后定植于腸道起作用,所以其對胃酸和膽鹽的抗性對發揮益生作用至關重要。本實驗采用篩選出的一株耐酸耐膽鹽抗性較好的嗜酸乳桿菌作為試驗菌株,研究結果表明,嗜酸乳桿菌能夠對DSS誘導的小鼠潰瘍性結腸炎有較好的保護作用。

圖5 免疫組化法檢測4組小鼠結腸IL-6和p-STAT3表達(100×)
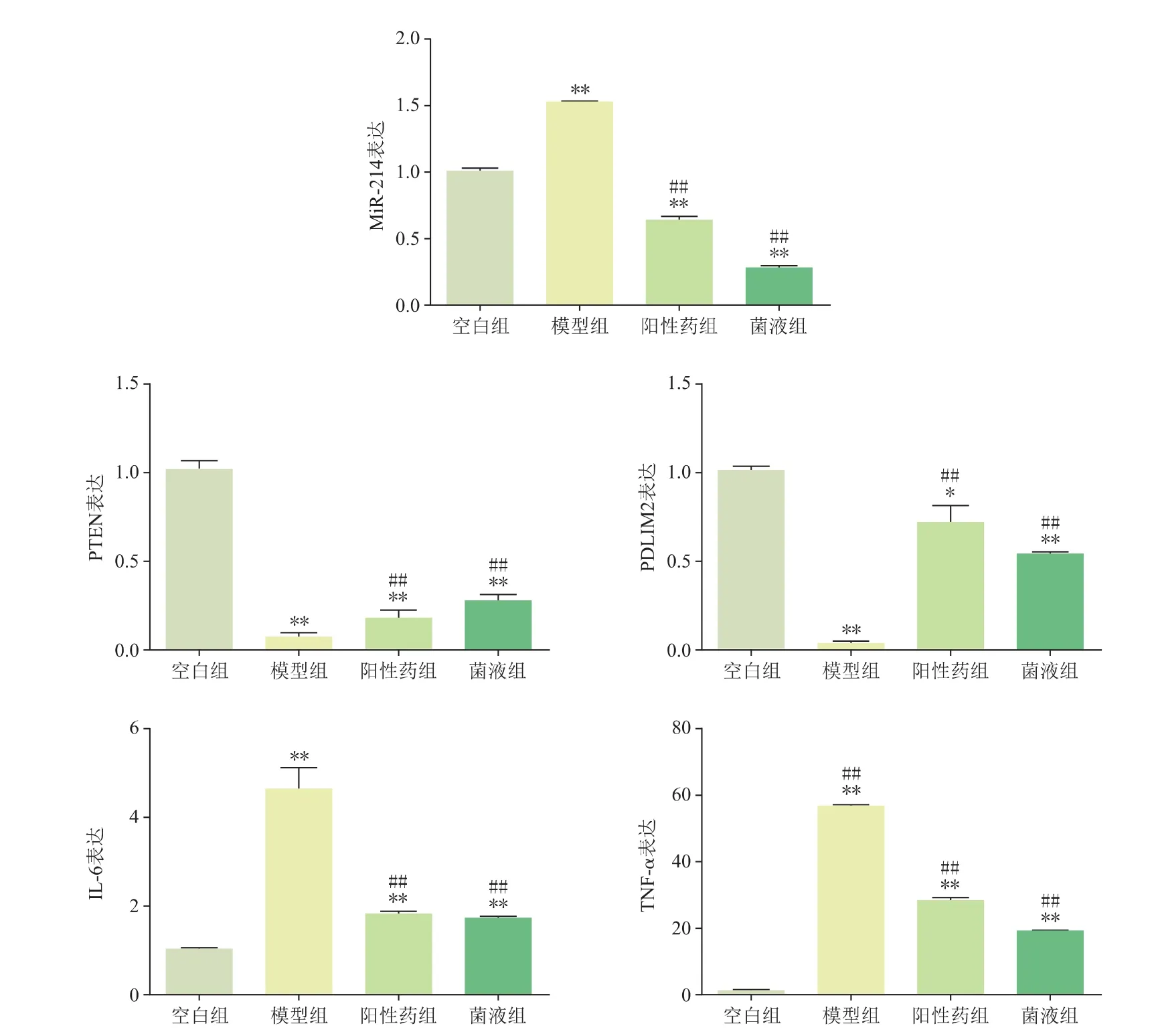
圖6 4組qRT-PCR檢測結果(n=10)
潰瘍性結腸炎發病機制復雜,其中炎癥是重要原因,p-STAT3是一個標志性的炎癥因子,磷酸化程度越高,則炎癥越明顯,IL-6可促進p-STAT3磷酸化[7]。本研究通過免疫組化法測定小鼠結腸組織中IL-6和p-STAT3的表達,結果顯示,模型組表達水平最高,表明模型組產生嚴重的炎癥反應,而陽性藥組和菌液組表達顯著減少,說明此兩組炎癥反應較模型組輕。Farraye FA等[8]研究證明,UC患者機體內miR-214的表達與UC發病程度呈顯著正相關。miR-214表達上調可抑制PTEN和PDLIM2的表達,進而使核轉錄因子kappa B(nuclear factor-kappa B,NF-κB)和蛋白激酶 B(protein kinase B,PKB)表達升高,導致下游促炎癥因子如IL-6、TNF-α等表達。本實驗qRT-PCR檢測結果顯示,模型組miR-214表達較空白組顯著上調,而PTEN和PDLIM2的表達則降低,炎癥因子IL-6、TNF-α表達升高,表明模型組miR-214及下游通路發生紊亂。而陽性藥組和菌液組則通過下調miR-214表達,解除其對PTEN和PDLIM2的抑制,改善了該通路紊亂的情況,最終使促炎因子IL-6、TNF-α表達降低,從而改善了炎癥反應。
綜上所述,本研究證明,嗜酸乳桿菌對DSS誘導的小鼠潰瘍性結腸炎具有較好的保護作用,并進一步證明其作用機制是通過下調miR-214,從而改善下游通路紊亂,最終改善炎癥反應,為使用嗜酸乳桿菌進行潰瘍性結腸炎的臨床治療提供了依據。

