姜黃素對高氧誘導肺泡Ⅱ型上皮細胞損傷的保護作用及機制
方恩容,楊 凱,何 杰,邱 靜,黃 娜
成都醫學院第一附屬醫院 呼吸內科(成都 610500)
采用高于生理濃度的氧(高氧)吸入所進行的氧療是成人急性呼吸窘迫綜合癥等嚴重呼吸道疾病進行機械通氣時的常規治療手段[1]。盡管氧療可改善組織缺氧和提高呼吸窘迫綜合征患者的生存率,但是高氧也可引發氧中毒,包括急性肺損傷[2-4]。肺泡Ⅱ型上皮細胞(alveolar type Ⅱ epithelial cell,AEC2)作為祖細胞,不僅可以實現自我更新,而且可轉分化為肺泡Ⅰ型上皮細胞(alveolar type I epithelial cell,AEC1),在肺泡上皮細胞層的維護和損傷修復中發揮著重要作用[5]。但是,高氧被證實可促進AEC2細胞凋亡[6]和向AEC1過度轉分化[7]。β-catenin作為Wnt信號途徑中的關鍵分子,可轉入細胞核而激活Wnt靶基因轉錄,在細胞增殖、分化、凋亡等過程中發揮著重要作用。同時,β-catenin也能與轉錄共激活因子p300及其他成分結合,形成活性轉錄激活復合物。β-catenin/p300的這種相互作用不僅與胚肺上皮發育相關[8],而且對氣道組織干細胞分化也有影響[9]。但是,β-catenin/p300相互作用與高氧誘導AEC2損傷的關系目前并不清楚。
姜黃素是從姜科、天南星科植物根莖中提取的重要活性化學成分,被證實對各類肺病如缺血-再灌注性損傷[10]、急性肺損傷[11]和慢性阻塞性肺病[12]都有一定保護作用。另外,姜黃素對高氧誘導的新生鼠肺損傷具有保護作用[13]。但是,至今并不清楚姜黃素能否保護高氧誘導下的AEC2損傷。本研究目的是在高氧誘導AEC2損傷的細胞模型中,觀察姜黃素對高氧誘導AEC2損傷的改善作用,探討β-catenin/p300的相互作用與姜黃素改善高氧誘導AEC2損傷作用的關系,為姜黃素在急、慢性肺損傷性疾病防治的臨床應用中提供實驗依據。
1 材料與方法
1.1 動物及試劑
健康雄性SD大鼠(體重180~200 g),由北京維通利華實驗動物技術有限公司[SCXK(京)2012-0001]提供。胰蛋白酶、膠原酶、脫氧核糖核酸酶Ⅰ、姜黃素、β-catenin/p300交互作用的特異抑制劑IQ-1(美國Sigma公司);胎牛血清、DMEM(美國Gibco公司);抗p300、抗β-catenin、抗GAPDH抗體(英國Abcam 公司);抗水通道蛋白-5(AQP5)、抗表面活性物質蛋白C(SP-C)抗體(美國Santa Cruz 公司);CCK-8檢測試劑盒(碧云天生物技術公司);Trizol 和M-MLV 逆轉錄酶(美國Promega 公司);p300 siRNA由銳博生物公司合成,轉染試劑Lipofectamine 2000購自英韋創津公司。
1.2 AEC2分離、培養
參照Dobbs 等[14]方法,分離原代培養AEC2。實驗用溶液Ⅰ、Ⅱ配置方法參考文獻[14]。SD大鼠麻醉、氣管插管、放血處死,快速經右心室穿刺插管至肺動脈,經肺動脈輸注溶液Ⅱ至肺循環,直至全肺變蒼白色,以去除血細胞;溶液Ⅰ、Ⅱ經氣管插管灌洗肺泡分別為8次和2次,以去除肺泡內的巨噬細胞。經氣管插管注入混合消化液(含0.25%胰蛋白酶和0.02%膠原酶)10 mL,取出心肺和氣管,37 ℃保留消化25 min。直接將肺組織剪取,放置含脫氧核糖核酸酶I的小燒杯中,仔細剪碎肺組織。加入胎牛血清以滅活胰酶作用,經200目濾網過濾,離心,細胞經DMEM重懸加入培養瓶中,37 ℃、5%CO2培養箱中培養1 h后,收集未貼壁細胞,DEME重懸,計數后調整細胞數接種于50 mL培養瓶(部分瓶中放置細胞爬片)中,繼續培養20 h,貼壁細胞經堿性磷酸酶染色法鑒定,90%為AEC2細胞。
1.3 分組處理
細胞隨機分為對照組、高氧組、姜黃素組(分為高、中、低劑量3個亞組)、IQ-1組、p300 siRNA組、siRNA陰性對照組。高氧誘導AEC2損傷模型制備參照文獻[15]。對照組直接置于5%CO2培養箱中培養24 h;其他各組通95%O2/5%CO2高純混合氣(3 L/min)10 min后,密封,置培養箱中培養24 h,收集細胞用于檢測。在培養結束前,采用測氧儀(CYS-1型上海嘉定學聯儀表廠,中國)檢測各培養瓶中氧濃度,通高氧的各組樣本如其氧濃度低于90%即舍棄。高、低劑量姜黃素組在通氧前30 min時,培養瓶中加入含姜黃素(終濃度分別為40、10、2 μmol/mL)的DMEM培養液。IQ-1組通氧前30 min時,培養瓶中加入含IQ-1(終濃度為20 μmol/L)的DMEM培養液。p300 siRNA組、siRNA陰性對照組通氧前30 min時,培養瓶中加入含p300 siRNA脂質體(50 nmol/L)或等量轉染溶劑Lipofectamine 2000的DMEM培養液。正常對照組、高氧組通氧前30 min時,培養瓶中加入含等容積溶劑的DMEM培養液。藥物處理結束后,各組棄去培養基,胰酶消化、重懸細胞后,取2 μL細胞混懸液加至血細胞計數板中,計數各組細胞數目。
1.4 CCK-8法檢測AEC2細胞活力
藥物處理過程完成后,收集各組AEC2細胞,以2×106個細胞/孔接種于96孔培養板,繼續培養8 h使細胞貼壁,每孔加10 μL CCK-8液,繼續培養2 h,酶標儀(美國Bio-Tek公司)檢測450 nm處吸光值。
1.5 熒光定量PCR檢測目的基因mRNA
藥物處理過程完成后,提取細胞總RNA,測定濃度后,每組樣本取1 μg RNA進行逆轉錄,合成的cDNA在ABI 7000 型熒光定量PCR 儀(美國Applied Biosytems)中進行擴增。所用引物序列為:SP-C正義鏈 5'-GTCGTCGTGGTGATTGTAGG G-3',反義鏈5'-GAAGGTAGCGATGGTGTCTG-3';AQP5正義鏈 5'-CTTATCTCTCCCAACCCAG-3',反義鏈5'-CCCATCCTTGACCAGAAAT-3';GAPDH正義鏈 5'-GTGCCAGCCTCGTCTC ATAG-3',反義鏈5'-GAACTTGCCGTGGGTA GAGTC-3'。反應條件如下:預變性94 °C 5 min,變性94 °C 30 s,退火60 °C 30 s,延伸72 ℃ 1 min,35次循環。擴增產物大小經1.5%瓊脂糖凝膠電泳證實。以GAPDH為內參,目的基因與GAPDH擴增條帶灰度比值作為目的基因mRNA相對表達量。
1.6 流式細胞雙標記法檢測轉分化細胞亞類
AQP5和SP-C分別是AEC1和AEC2的特征性表型蛋白,對二者的檢測可以作為這兩種細胞類型的標志[16-17]。為此,本研究在流式細胞儀中通過檢測AQP5、SP-C陽性細胞數,驗證AEC2向AEC1轉分化的變化。藥物處理過程完成后,用0.25%胰蛋白酶消化,制備單細胞懸液,1 000 r/min,離心半徑10 cm,離心5 min,PBS洗滌,離心,舍棄上清液,加75%冷乙醇固定2 h。再離心,棄上清液,PBS洗滌后,調整細胞濃度至1 ×108個細胞/L。然后,加入羊抗鼠AQP5抗體、兔抗鼠SP-C抗體(稀釋倍數1∶100),室溫下孵育60 min,PBS洗滌,加FITC標記的抗羊IgG二抗、Cy3標記的抗兔IgG二抗,室溫避光孵育20 min,上流式細胞儀(FACS CantoTMII,BD,美國)檢測。利用Flow Jo軟件作圖,將細胞分為4 個亞群:Q1,AQP5(+)/SP-C(-);Q2,AQP5(+)/SP-C(+);Q3,AQP5(-)/SP-C(-);Q4,AQP5(-)/SP-C(+),結果以陽性細胞的百分率表示(n=5)。其中,Q1亞群即為AEC1細胞,Q4亞群即為AEC2細胞,Q2為AEC2向AEC1轉分化的中間型。
1.7 Western blot 檢測相關蛋白表達量
藥物處理過程完成后,收集并抽提各組細胞的總蛋白,利用BCA 法測定總蛋白濃度。每個泳道上樣50 μg蛋白樣品,經10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE),蛋白轉移至PVDF 膜,加Tris緩沖液-吐溫(TBST)及牛奶液封閉 1 h,加一抗(抗p300、抗β-catenin、抗GAPDH,抗體稀釋倍數1∶500~1∶1 000)4 °C孵育過夜,TBST洗脫,HRP 聯接的二抗(稀釋倍數1∶500)孵育1 h,TBST 再洗脫等步驟,最后,增強化學發光法探測蛋白條帶,經顯影處理,獲得清晰條帶。利用Image J軟件分析各條帶的灰度值。
1.8 統計學方法
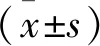
2 結果
2.1 姜黃素對AEC2細胞增殖活力及細胞計數影響
CCK-法檢測顯示,與對照組比較,高氧組AEC2細胞增殖活力和細胞計數明顯減低(P<0.01);與高氧組比較,高、中劑量姜黃素組AEC2細胞增殖活力和細胞計數均明顯增大(P<0.01);與高氧組比較,IQ-1組也能明顯提升AEC2細胞增殖活力和細胞計數(P<0.01);與對照組比較,siRNA陰性對照組AEC2細胞增殖活力和細胞計數均明顯減低(P<0.01);與siRNA陰性對照組比較,p300 siRNA組AEC2細胞增殖活力和細胞計數也明顯增加(P<0.01)(圖1)。基于上述姜黃素劑量與AEC2細胞增殖活力、細胞計數的關系,后續實驗中的姜黃素治療組均只采用了高劑量姜黃素治療組。

圖1 姜黃素對AEC2細胞增殖活力及細胞計數的影響注:A:CCK-8 法檢測的AEC2細胞活力;B:細胞計數板所計數的細胞總數;Ctrl:對照組;Mod:高氧組;Cur2:低劑量姜黃素治療組;Cur10:中劑量姜黃素治療組;Cur40:高劑量姜黃素治療組;IQ-1:IQ-1組;blank siRNA:siRNA陰性對照組;p300 siRNA:p300 siRNA組;與對照組比較,*P<0.01;與高氧組比較,#P<0.01;與siRNA陰性對照組比較,&P<0.01
2.2 姜黃素對高氧誘導AEC2細胞轉分化的影響
熒光定量PCR檢測顯示,與對照組比較,高氧組AEC2標記基因SP-C mRNA表達明顯減少(P<0.01),AEC1標記基因AQP5 mRNA表達明顯增強(P<0.01);與高氧組比較,高劑量姜黃素組SP-C mRNA表達明顯增強(P<0.01),AQP5 mRNA表達明顯減小(P<0.01);與高氧組比較,IQ-1組明顯增加SP-C mRNA表達(P<0.01),減少AQP5 mRNA表達(P<0.01);與對照組比較,siRNA陰性對照組SP-C mRNA表達明顯減少(P<0.01),AQP5 mRNA表達明顯增強(P<0.01);與siRNA陰性對照組比較,p300 siRNA組SP-C mRNA表達增強(P<0.01),AQP5 mRNA表達減小(P<0.01)(圖2)。
流式細胞雙標記法檢測顯示,與對照組比較,高氧組AEC1百分比、AEC2向AEC1轉分化的中間型細胞百分比均明顯增大(P<0.01),AEC2百分比明顯減少(P<0.01);與高氧組比較,高劑量姜黃素組、IQ-1組AEC1百分比、轉分化中間型細胞百分比減少(P<0.01),AEC2百分比明顯增大(P<0.01);與對照組比較,siRNA陰性對照組AEC1百分比、AEC2向AEC1轉分化的中間型細胞百分比均明顯增大(P<0.01),AEC2百分比明顯減少(P<0.01);與siRNA陰性對照組比較,p300 siRNA組AEC1百分比、轉分化中間型細胞百分比減少(P<0.01),AEC2百分比明顯增大(P<0.01)(圖3~4)。

圖2 姜黃素對SP-C、AQP5 mRNA表達的影響注:A:AEC2標記基因SP-C mRNA表達量;B:AEC1標記基因AQP5 mRNA表達量;Ctrl:對照組;Mod:高氧組;Cur40:高劑量姜黃素治療組;IQ-1:IQ-1組;blank siRNA:siRNA陰性對照組;p300 siRNA:p300 siRNA組;與對照組比較,*P<0.01;與高氧組比較,#P<0.01;與siRNA陰性對照組比較,&P<0.01

圖3 姜黃素對AEC2細胞轉分化的影響注:A:對照組(Ctrl);B:高氧組(Mod);C:高劑量姜黃素治療組(Cur40);D:IQ-1組(IQ-1);E:siRNA陰性對照組(blank siRNA);F:p300 siRNA組(p300 siRNA)

圖4 姜黃素對AEC細胞各亞型百分比的影響注:A:AEC2細胞百分比;B:AEC1細胞百分比;C:轉分化中間型細胞百分比;Ctrl:對照組;Mod:高氧組;Cur40:高劑量姜黃素治療組;IQ-1:IQ-1組;blank siRNA:siRNA陰性對照組;p300 siRNA:p300 siRNA組;與對照組比較,*P<0.01;與高氧組比較,#P<0.01;與siRNA陰性對照組比較,&P<0.01
2.3 姜黃素對β-catenin/p300表達量的影響
Western blot 檢測顯示,與對照組比較,高氧組β-catenin、p300蛋白表達量明顯增加(P<0.01);與高氧組比較,高劑量姜黃素組β-catenin、p300蛋白表達量明顯減少(P<0.01)(圖5)。

圖5 姜黃素對β-catenin/p300表達量的影響注:A:β-catenin蛋白表達量;B:p300蛋白表達量;Ctrl:對照組;Mod:高氧組;Cur40:高劑量姜黃素治療組;與對照組比較,*P<0.01;與高氧組比較,#P<0.01
3 討論
高氧引起肺損傷的主要特征包括內皮細胞和肺泡上皮細胞損傷、過度炎癥反應以及肺泡水腫[18-20]。高氧吸入治療時,肺泡上皮細胞(包括AEC1和AEC2)作為肺泡壁的最內層細胞,通過液氣界面直接接觸高氧刺激,而易于產生氧化應激性損傷[21]。其中,AEC2也被證實是高氧肺損傷的主要靶細胞[6,22-23]。高氧可抑制AEC2增殖,促進AEC2凋亡增加[6],促進AEC2過度轉分化為AEC1[7]。本研究結果所示,高氧的損傷作用顯然會減少肺泡壁AEC2的數量,導致肺表面活性物質分泌不足,增加肺泡表面張力,影響肺泡通氣、換氣功能。因此,對成人呼吸窘迫綜合征給予氧療的同時,應采取合理干預措施以預防和治療患者高氧誘導的肺損傷,包括靶向調控和保護AEC2。
中藥因其作用溫和、副作用小等優點,一直為各類肺病研究者所關注。姜黃素中藥活性成分對脂多糖、缺血再灌注、機械通氣等病因誘導的肺損傷有一定保護作用[11,24-25]。有研究[13]顯示,姜黃素對高氧誘導肺損傷具有保護作用,但是其保護性作用的細胞學機制目前并不清楚。因此,本研究觀察了姜黃素對高氧誘導AEC2損傷的影響,結果顯示,姜黃素明顯改善高氧作用下AEC2的增殖活力,抑制AEC2轉分化為AEC1的過程,增加AEC2數量。姜黃素對AEC2的這些作用構成其保護高氧誘導肺損傷的細胞學基礎。
Wnt信號途徑主要成分β-catenin與轉錄共激活因子p300相互作用,在肺組織發生發育中可能發揮著重要作用。β-catenin/p300相互作用不僅促進氣道黏液細胞分化[9],而且參與AEC2、氣管上皮細胞的分化[26]。抑制β-catenin/p300相互作用則抑制小鼠胚肺上皮遠側分支化,促進上皮近側分支化[8]。本研究結果顯示,高氧激活β-catenin/p300相互作用,促進AEC2轉分化為AEC1,同時降低AEC2活力,減少AEC2細胞數量;應用β-catenin/p300相互作用的抑制劑IQ-1或siRNA干擾p300表達,則能逆轉高氧的這些作用。由此可見,盡管β-catenin/p300相互作用在正常肺組織上皮細胞分化中起著重要作用,但是高氧誘導下β-catenin/p300相互作用的過度激活也可能通過影響肺泡壁AEC2數量與功能而促進肺損傷。本研究中,姜黃素處理能抑制高氧誘導對AEC2的損傷作用,包括抑制AEC2過度轉分化、增強AEC2的增殖活力和增加AEC2數量。同時,姜黃素處理也抑制β-catenin、p300的蛋白表達,這提示姜黃素對高氧誘導AEC2損傷的保護作用機制與其抑制β-catenin/p300相互作用有關。

