CRM197重組慢病毒對前列腺癌PC-3細胞作用的初步研究*
劉 雙,李 艷,唐藝媛,曹 康,代呂霞△
1.成都醫(yī)學院 臨床醫(yī)學院(成都 610500);2.成都醫(yī)學院 病原生物學教研室(成都 610500)
CRM197是白喉毒素突變體中的一種。由于錯義突變,CRM197細胞毒性明顯降低,但仍能抑制細胞蛋白質的合成,導致靶細胞死亡[1-4]。近年來有多項研究[1-2]表明,CRM197具有抗腫瘤作用。目前,CRM197蛋白治療卵巢癌和腹膜癌的研究已進入Ⅰ期臨床試驗階段[5]。復發(fā)性卵巢癌和腹膜癌患者腹壁皮下注射CRM197蛋白進行治療,結果顯示,CRM197治療效果良好,其療效與劑量存在正相關[6-7]。細胞凋亡是抗腫瘤藥物發(fā)揮抗腫瘤作用的重要機制之一,Caspase-9是分子量為46 KD細胞凋亡啟動因子,在凋亡信號傳導過程中先于其他蛋白酶被活化,繼而引起Caspase-3的活化。Caspase-3是分子量約為32 KD的細胞凋亡執(zhí)行因子,是細胞凋亡過程中最主要的終末剪切酶。本研究通過觀察CRM197重組慢病毒對PC-3細胞生物學特性的影響,初步探討CRM197重組慢病毒抗前列腺癌的作用機制,為前列腺癌的治療提出新的構思與想法。
1 材料與方法
1.1 材料
PC-3細胞由成都醫(yī)學院科研中心保存,新生牛血清購自浙江天杭生物科技有限公司,DMEM培養(yǎng)基購自HyClone,BCA蛋白定量試劑盒、Caspase-3、Caspase-9、GAPDH購自碧云天生物技術有限公司,PCDH-CRM197-copGFP重組慢病毒、CRM197多克隆抗體已由本課題組制備完成。
1.2 方法
1.2.1 細胞復蘇 取出凍存的PC-3細胞,37 ℃融化后,轉移至15 mL離心管中。加入10%血清的DMEM培養(yǎng)液5 mL,1 000 r/min,離心半徑14 cm,離心5 min,小心棄上清。重新加入10%血清的DMEM培養(yǎng)液5 mL,輕輕吹打混勻后轉移至75 mL 細胞培養(yǎng)瓶中,置于37 ℃、5%CO2培養(yǎng)箱培養(yǎng)。
1.2.2 實驗分組 空白對照組(Con組):PC-3細胞,加入10%血清的DMEM培養(yǎng)液;空病毒組(EV組):PC-3細胞,加入空載體病毒液(MOI=2),感染24 h后,更換為10%血清的DMEM培養(yǎng)液;CRM197組(CRM197組):PC-3細胞,加入CRM197病毒液(MOI=2),感染24 h后,更換為10%血清的DMEM培養(yǎng)液。
1.2.3 MTT實驗 當PC-3細胞生長狀態(tài)良好,達80%~90%融合時,0.25%胰酶進行消化。顯微鏡下觀察細胞收縮、變圓后,加入等量10%血清的DMEM培養(yǎng)液終止消化。輕柔吹打,1 000 r/min,離心半徑14 cm,離心5 min,棄上清。加入10%血清的DMEM培養(yǎng)液5 mL,輕柔吹打重懸細胞沉淀。按5×103/孔的密度接種于96孔板,每組設3個復孔,37 ℃、5%CO2培養(yǎng)箱培養(yǎng)24 h,至細胞達30%~40%融合,進行相應組別處理,37 ℃、5%CO2培養(yǎng)箱中繼續(xù)培養(yǎng)72 h。每孔加入5 μL MTT,37 ℃、5%CO2培養(yǎng)箱4 h。小心吸出培養(yǎng)液,每孔加入150 μL 二甲亞砜(DMSO),輕柔振搖10 min,酶標儀上測OD490。用不含細胞的空白孔調零,將Con組細胞存活率記為100%,分析EV組、CRM197組細胞存活率變化。實驗重復3次,取均值。
1.2.4 Hoechst染色 當PC-3細胞生長狀態(tài)良好,達60%~80%融合時,0.25%胰酶消化細胞。計數(shù)后按5×105/孔的密度接種6孔板,37 ℃、5%CO2培養(yǎng)箱中培養(yǎng)。當細胞密度達40%~50%,分別進行Con組、EV組和CRM197組的相應處理(每組設3個復孔,重復3次)。細胞分組處理72 h后,吸去各孔培養(yǎng)液。加入500 μL Hoechst 33258染色液,37 ℃、5%CO2培養(yǎng)箱中放置15 min。熒光顯微鏡下觀察細胞核形態(tài)。
1.2.5 流式細胞術檢測 細胞分組處理72 h后,0.25%胰酶消化細胞,收集細胞1 000 r/min,離心半徑14 cm,離心5 min,棄上清。加入預冷的PBS重懸細胞,1 000 r/min,離心半徑14 cm,離心5 min,棄上清。加入1 mL預冷的75%乙醇,渦旋振蕩重懸細胞,4 ℃放置24 h,3 000 r/min,離心半徑14 cm,離心5 min,棄上清。加入預冷的PBS重懸細胞,3 000 r/min,離心半徑14 cm,離心5 min,棄上清。加入預冷的PBS重懸細胞,3 000 r/min,離心半徑14 cm,離心5 min,棄上清。加入PI染液500 μL(含PI 20 μg/mL),重懸細胞,室溫避光2 h。調整細胞濃度為1×106/mL,上機檢測。實驗重復3次。
1.2.6 Western blot檢測Caspase-3、Caspase-9蛋白的表達 PC-3細胞分組處理72 h后,0.25%胰酶消化細胞,1 000 r/min,離心半徑14 cm,離心5 min,棄上清,收集各組細胞。加入200 μL RIPA和4 μL PMSF混勻,冰上30 min。設置功率40 W、破碎2 s、間隔3 s、總時間20 s的工作模式,冰上超聲破碎細胞。4 ℃,13 000 r/min,離心半徑14 cm,離心20 min,收集上清,定量蛋白。Western blot檢測Caspase-9、Caspase-3蛋白的表達,凝膠圖像分析系統(tǒng)Quantity One 4.5分析,保存實驗結果。實驗重復3次。
1.3 統(tǒng)計學方法

2 結果
2.1 CRM197蛋白在前列腺癌PC-3細胞中的表達
以抗CRM197多克隆抗體為一抗,Western blot驗證CRM197慢病毒作用PC-3細胞后能否正確表達CRM197蛋白。Western blot結果顯示,CRM197組PC-3細胞出現(xiàn)特異性條帶,而Con組、EV組細胞無特異性條帶的出現(xiàn),這提示CRM197慢病毒作用前列腺癌PC-3細胞后能正確表達CRM197蛋白(圖1)。
2.2 CRM197慢病毒對細胞增殖的影響
將PC-3細胞接種于96孔板并分組處理細胞,MTT檢測并計算細胞增殖的抑制率。MTT結果顯示,CRM197組PC-3細胞的增殖抑制率為34.3%。與Con組和EV組相比,CRM197慢病毒明顯抑制PC-3細胞的增殖,差異有統(tǒng)計學意義(P<0.05)。而EV組和Con組相比,差異無統(tǒng)計學意義(P>0.05)(圖2、表1)。

圖2 CRM197慢病毒對PC-3細胞存活率的影響注:A:PC-3 細胞;B:空載體慢病毒作用后的PC-3細胞;C:CRM197慢病毒作用后的PC-3細胞

表1 CRM197慢病毒對PC-3細胞存活率的影響
注:與Con組相比,*P<0.05;與EV組相比,#P<0.05
2.3 CRM197處理細胞導致的凋亡形態(tài)學分析
將PC-3細胞接種6孔板,分組處理細胞后,倒置顯微鏡下觀察細胞形態(tài)。顯微鏡下觀察到,CRM197慢病毒作用72 h后,細胞變圓、皺縮、空泡、脫落、生長緩慢;而Con組細胞生長狀態(tài)良好,細胞增殖迅速(圖3)。
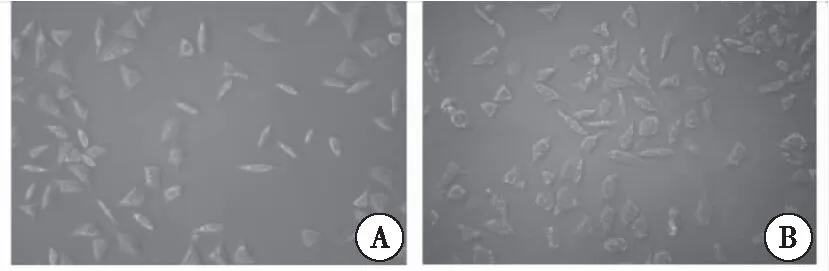
圖3 PC-3腫瘤細胞的形態(tài)變化注:A:PC-3 細胞;B:CRM197慢病毒作用后的PC-3細胞
2.4 CRM197處理細胞導致的細胞核形態(tài)改變
將PC-3細胞接種6孔板,分組處理細胞72 h后行Hoechst 33258染色,熒光顯微鏡下觀察細胞核形態(tài)。熒光顯微鏡下觀察到,CRM197組凋亡細胞比例明顯增加,細胞核出現(xiàn)核固縮、碎塊狀致密濃染或凋亡小體,而Con組和EV組凋亡細胞較少且細胞核沒有明顯變化。提示CRM197明顯促進細胞凋亡的進程(圖4)。

圖4 CRM197慢病毒對PC-3細胞核形態(tài)的影響 注:A、D:PC-3 細胞;B、E:空載體慢病毒作用后的PC-3細胞;C、F:CRM197慢病毒作用后的PC-3細胞
2.5 CRM197慢病毒對Cleaved Caspase-9、Cleaved Caspase-3蛋白表達的影響
Western blot檢測Con組、EV組和CRM197組Cleaved Caspase-9、Cleaved Caspase-3凋亡相關蛋白的表達情況,比較各蛋白與β-actin的相對表達量。結果顯示,與Con組和EV組相比,CRM197組Cleaved Caspase-9、Cleaved Caspase-3的表達量都增加,差異有統(tǒng)計學意義(P<0.05)。而EV組與Con組相比,Cleaved Caspase-9、Cleaved Caspase-3的表達量差異無統(tǒng)計學意義(P>0.05)。提示CRM197啟動線粒體凋亡途徑,從而誘導細胞凋亡(表2、圖5)。


組別Cleaved Caspase-9Cleaved Caspase-3Con組0.05±0.020.07±0.03EV組0.06±0.010.08±0.02CRM197組 0.17±0.03?# 0.28±0.04?#F28.50043.552P<0.001<0.001
注:與Con組比較,*P<0.05;與EV組比較,#P<0.05
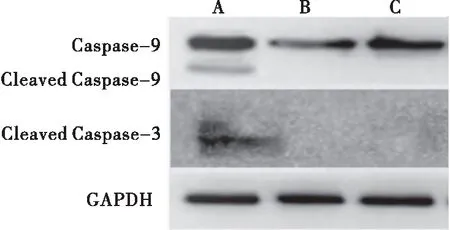
圖5 CRM197慢病毒對Cleaved Caspase-9和Cleaved Caspase-3蛋白表達的影響注:A:CRM197慢病毒作用后的PC-3細胞;B:PC-3 細胞;C:空載體慢病毒作用后的PC-3細胞
2.6 CRM197處理細胞導致的細胞凋亡率改變
將PC-3細胞接種6孔板分組處理細胞72 h后,通過PI染色檢測sub G1期細胞所占比例,定量凋亡的細胞數(shù)目。結果顯示,CRM197作用后PC-3細胞的凋亡率為13.7%,與Con組和EV組相比,CRM197明顯促進細胞凋亡,差異有統(tǒng)計學意義(P<0.05)。EV組與Con組相比,差異無統(tǒng)計學意義(P>0.05)。結果提示,AdCRM197能夠誘導PC-3前列腺癌細胞發(fā)生凋亡(圖6、表3)。

圖6 CRM197慢病毒對PC-3細胞凋亡率的影響注:A:PC-3 細胞;B:空載體慢病毒作用后的PC-3細胞;C:CRM197慢病毒作用后的PC-3細胞

表3 CRM197慢病毒對PC-3細胞凋亡率的影響
注:與Con組比較,*P<0.05;與EV組比較,#P<0.05
3 討論
前列腺癌是歐美國家男性高發(fā)惡性腫瘤,目前在我國也呈現(xiàn)出逐年增長的趨勢[8]。由于我國群眾重視程度不高,常導致發(fā)現(xiàn)時已經(jīng)處于前列腺癌晚期[6]。我國目前在前列腺癌治療方面多采用傳統(tǒng)的化療方法,但由于耐藥頻發(fā),患者治療效果不佳,死亡率高[9-11]。面對重重障礙,尋找到一種新的治療方法迫在眉睫。
既往實驗[12-14]證實,CRM197蛋白干擾EGFR與HB-EGF結合,下調HB-EGF的表達,抑制細胞有絲分裂。CRM197蛋白還被用于治療口腔癌、黑色素瘤、急性T淋巴細胞性白血病等[15-17],CRM197通過抑制細胞蛋白質的生成,抑制腫瘤細胞的遷移、侵襲以及誘導腫瘤細胞凋亡,從而實現(xiàn)抗腫瘤作用。
CRM197重組慢病毒作用PC-3細胞后,Western blot檢測到CRM197的表達,這提示CRM197重組慢病毒在靶細胞中能正確表達CRM197蛋白。CRM197作用PC-3細胞后,細胞增殖的抑制率為34.3%。與Con組、EV組相比,CRM197明顯抑制PC-3細胞的增殖。Hoechst染色觀察到細胞核出現(xiàn)核固縮及凋亡小體。流式細胞檢測術顯示,CRM197作用后PC-3細胞的凋亡率為13.7%,與Con組和EV組相比,CRM197使sub G1期細胞增多,凋亡率升高。
Caspase-3、Caspase-9蛋白可促進細胞凋亡。Caspase-3通過裂解核小體間的DNA,引起細胞凋亡,且Caspase-3是各凋亡通路樞紐最重要的凋亡效應分子,Caspase-9作為Caspase-3最重要的激活劑,是調節(jié)細胞凋亡的關鍵分子[18]。為了探索CRM197誘導腫瘤細胞凋亡的機制,本研究對Caspase-3、Caspase-9凋亡相關蛋白的表達進行了檢測。Western blot顯示CRM197作用后,PC-3細胞中Cleaved Caspase-9和Cleaved Caspase-3表達呈上調狀態(tài)。結果提示,CRM197通過激活線粒體凋亡途徑而誘導腫瘤細胞凋亡。本研究顯示,CRM197重組慢病毒可通過抑制PC-3前列腺癌細胞的增殖,誘導PC-3細胞凋亡,增加Caspase-3和Caspase-9的表達,從而抑制前列腺癌的生長和增強化療藥物的敏感性。

