人脂肪間充質干細胞通過抑制小膠質細胞遷移活性對MPP+誘導帕金森細胞模型的保護作用*
胡康安,劉漪淪,李 燦,孫 靜
1.成都醫學院 生物科學與技術學院(成都 610500);2.成都醫學院第一附屬醫院 四川省老年醫學臨床醫學研究中心(成都 610500);3.成都醫學院 發育與再生四川省重點實驗室(成都 610500)
帕金森病(parkinson's disease,PD)的特征性病理改變為中腦黑質多巴胺能神經元(dopaminergic neurons,DA)變性及壞死而誘發神經炎癥反應[1]。小膠質細胞是中樞性神經系統的固有免疫細胞,當DA能神經元損傷時,小膠質細胞迅速活化,并向病損區遷移。小膠質細胞的趨向性遷移是其參與免疫反應的重要基礎和前提[2]。研究[3]表明,小膠質細胞及其介導的神經炎癥在PD 進展中發揮重要作用。間充質干細胞(mesenchymal stem cells,MSCs)是一種具有多向分化潛能及免疫抑制功能的成體干細胞[4],可調節巨噬細胞M1/M2活化表型,并且MSCs干預炎癥性疾病的可行性和有效性已經被證實[5]。本研究旨在通過PD細胞損傷模型及細胞共培養系統,探索hADMSCs干預后的小膠質細胞對DA神經元的存活及功能的影響及其機制。通過調控小膠質細胞炎癥表型、調節炎癥微環境,有望為PD抗炎策略提供新的視角。
1 材料與方法
1.1 主要試劑
1-Methyl-4-phenyl tetrahydropteridine(MPP+)購于Sigma-Aldrich公司。TUNEL細胞凋亡檢測試劑盒購于Roche公司。TH、GAPDH及DAT抗體購于Abcam公司。HRP標記羊抗兔二抗購于武漢博士德生物工程有限公司。ECL發光試劑盒購自Pierce公司。
1.2 主要細胞
實驗中應用的MN9D細胞系(BNCC340551)為小鼠多巴胺能神經元細胞,BV2細胞(BNCC102012)為小鼠小膠質細胞,均購自北京北納創聯生物研究院細胞庫。
1.3 實驗方法
1.3.1 hADMSCs的分離培養 獲取成人吸脂術抽取的脂肪組織150 mg,用PBS溶液沖洗3次,用眼科剪剪碎。加入0.1%Ⅰ型膠原酶10 mL,在37 ℃的恒溫搖床中振蕩培養30 min,12 000 r/min離心半徑10 cm,離心5 min,輕吸去上清液。用0.15 mol/L的NH4Cl溶解紅細胞,PBS清洗3次,棄上清,細胞沉淀用DMEM培養基重懸后用70 um濾網過濾以去除未消化的脂肪。將細胞按照1×109個/mL濃度接種至培養皿中,置于37 ℃、5%CO2培養箱中培養。當細胞融合度達到80%時,用0.25%胰酶消化傳代,獲得Pl代細胞。將P3代細胞用于后續流式細胞儀檢測。
1.3.2 hADMSCs條件培養基制備 取對數生長期的hADMSCs 細胞,0.25% Trypsin 消化成細胞懸液,取 5×105個細胞用 DMEM/F12 完全培養基重懸與培養瓶中,置于5% CO2、37 ℃恒溫培養箱中培養 24 h。將完全培養基倒出,加入5 mL不含血清的DMEM/F12 培養基,并置于5% CO2、37 ℃恒溫培養箱中培養繼續24 h。將細胞上層的培養基吸入15 mL 離心管中,2 000 r/min,離心5 min 后放入-80 ℃冰箱中凍存備用。
1.3.3 PD體外細胞模型構建 MN9D細胞于實驗前用丁酸鈉進行分化誘導,將MN9D細胞以1×105/孔濃度接種于24孔板,加入培養基常規培養。待細胞融合度達75%左右時,將常規培養基換成含1 mL丁酸鈉的誘導培養基,隔天換液。將丁酸鈉誘導第5天的細胞用PBS漂洗。吸去漂洗液,改用含2 mM MPP+的常規培養基培養細胞24 h,用于后續實驗。
1.3.4 MN9D與BV2細胞共培養 將小膠質細胞與將MPP+處理后的MN9D細胞于37 ℃、5%CO2條件下共培養24 h。實驗共分3組(n=5):正常對照組(control)、MPP+處理組及hADMSCs條件培養基處理組(MPP+/CM)。正常對照組(control):上室:BV2細胞,常規培養基;下室:MN9D細胞,常規培養基。MPP+處理組:上室:BV2細胞,常規培養基;下室:MN9D細胞,含200 μM MPP+的常規培養基。hADMSCs條件培養基處理組(MPP+/CM):上室:BV2細胞,hADMSC條件培養基;下室:MN9D細胞,含200 μM MPP+的常規培養基。共培養時間為24 h,每組設3個生物學重復。收集下層MN9D細胞,TUNEL法檢測MN9D細胞凋亡情況;Western blot方法檢測MN9D細胞內TH及DAT的蛋白表達水平。
1.3.5 TUNEL法檢測MN9D細胞凋亡 收集下層MN9D細胞,采用TUNEL原位凋亡檢測試劑盒檢測細胞凋亡。將細胞爬片浸入4%的多聚甲醛(pH7.4)中室溫固定25 min,PBS 清洗。然后于TritonX-100溶液中浸泡3 min后PBS 洗滌。加 50 μL TUNEL 混合液于標本上,37 ℃避光孵育1 h。PBS 洗滌后滴加DAPI避光孵育5 min。于熒光顯微鏡下觀察采集圖像。計算5個視野下的凋亡指數(AI)。
1.3.6 Western blot檢測MN9D細胞TH/DAT蛋白的表達 MN9D細胞與BV2細胞共培養24 h后,將下層MN9D細胞冰上裂解30 min后,于4 ℃下12 000 r/min,離心半徑10 cm,離心5 min。進行SDS-PAGE電泳,采用濕轉印法轉膜,加入相應一抗(TH 1∶1 000,DAT 1∶1 000),4 ℃孵育過夜,TBST洗滌PVDF膜5次(5 min/次)。二抗稀釋后(1∶50 000稀釋),用其浸泡PVDF膜,37 ℃搖床孵育2 h,TBST洗去多余二抗。ECL發光試劑盒顯色。利用Image Proplus 6.0軟件分析目的條帶和內參GAPDH條帶的灰度值。
1.4 統計學方法
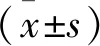
2 結果
2.1 hADMSCs阻礙PD細胞損傷模型中BV2細胞的遷移能力
Transwell共培養結果發現,正常對照組(control)、MPP+處理組及hADMSCs條件培養基處理組(MPP+/CM)細胞遷移數分別為(16.23±6.38)、(96.3±10.13)及(40.33±13.19)。MPP+處理組與正常對照組相比較,從Transwell上室穿透到下室的BV2細胞遷移率明顯增加,差異具有統計學意義(P<0.001)。與MPP+處理組相比較,hADMSCs條件培養基處理組(MPP+/CM)中的BV2細胞遷移率明顯減少,且其差異具有統計學意義(P<0.001)(圖1)。

圖1 結晶紫染色檢測hADMSCs對MPP+誘導PD細胞模型中BV2 細胞的遷移活性影響注:A:正常對照組(×400);B:MPP+處理組(×400);C:hADMSCs條件培養基處理組(MPP+/CM)(×400);D:BV2平均細胞遷移數,與control組和MPP+組比較,***P<0.001
2.2 hADMSCs減輕共培養體系中MPP+誘導的MN9D細胞凋亡
TUNEL檢測結果發現,MPP+處理組中,MN9D細胞單純經200 μM MPP+處理24 h后,出現凋亡,細胞凋亡數量為(22.10±1.74)個。然而,與MPP+處理組相比較,hADMSCs條件培養基處理組(MPP+/CM)MN9D細胞凋亡數量為(10.2±1.70)個,細胞的損傷程度減輕(P=0.004)(圖2)。

圖2 MN9D細胞TUNEL染色及細胞凋亡分析注:A:正常對照組(×400);B:MPP+處理組(×400);C:hADMSCs條件培養基處理組(MPP+/CM)(×400);D:MN9D凋亡細胞數統計,與MPP+/CM組比較,** P<0.01;與control組比較,***P<0.001
2.3 hADMSCs增加共培養體系中MN9D細胞TH/DAT表達
Western blot結果表明,與對照組相比,MN9D細胞單純經200 μM MPP+處理24 h后,MN9D細胞的TH表達量(0.21±0.09 vs 1.01±0.03,P=0.002)及DAT表達量(0.20±0.05 vs 0.99±0.03,P=0.002)均明顯下調。并且,與MPP+處理組相比,MPP+/CM組中MN9D細胞的TH(0.72±1.00 vs 0.21±0.09,P=0.004)及DAT表達水平(0.75±1.24 vs 0.20±0.05,P=0.003)均有明顯上調(圖3)。

圖3 hADMSC對共培養體系中MN9D細胞TH/DAT表達的影響注:A:共培養系統中Western blot檢測MN9D細胞TH/DAT表達;與MPP+組相比,MPP+/CM組中MN9D細胞的DAT及TH表達水平均有明顯上調;B:MN9D細胞TH/DAT表達水平的定量分析,與MPP+組相比較,**P<0.01
3 討論
研究[3]發現,神經炎癥反應是PD的重要病理學特征。CNS中過度炎癥反應可加重DA神經元損傷[6]。基于此理論,抑制小膠質細胞介導的過度炎癥反應,為神經系統多種炎癥性疾病的治療提供新思路。
MSCs的免疫抑制功能使其成為抗炎治療的理想細胞。在多種CNS疾病動物模型中均證實,MSCs可通過減弱局部神經炎癥反應從而緩解疾病進展[7-8]。本實驗采用MPP+誘導的MN9D與BV2細胞共培養體系,通過TUNEL法檢測hADMSCs條件培養基處理后對體外PD細胞模型中MN9D 細胞的凋亡情況。TUNEL結果發現,hADMSCs可減輕MN9D細胞的凋亡程度,此結果提示hADMSCs對于MPP+損傷的MN9D細胞具有神經保護作用。DA能神經元中酪氨酸羥化酶(TH)和DAT的分泌能力是反映DA能神經元生理功能的重要指標。TH催化氨基酸L-酪氨酸轉變為二羥基苯丙氨酸(多巴)的關鍵酶,其表達可決定多巴胺水平。DAT是攝取釋放多巴胺的主要載體。因此,為進一步檢測hADMSCs在共培養系統中對MN9D細胞功能影響,利用Western blot檢測MN9D 細胞中DAT及TH的表達水平。Western blot結果進一步證實,hADMSCs誘導后的BV2細胞可以增加MN9D細胞中DAT及TH的表達水平,此結果提示hADMSCs誘導后的BV2細胞可保護MN9D細胞功能。
以上結果均證實,hADMSCs條件培養基處理后BV2對于MPP+致毒的MN9D細胞具有神經保護作用本課題研究結果與以往研究結果相一致。Constantin 等[9]發現,ADMSCs可通過免疫調節機制緩解EAE動物模型的疾病進程,減少脫髓鞘反應及神經元軸突丟失,并且可誘導T細胞向保護性Th2免疫表型轉化。Tsumuraya 等[10]研究表明,MSCs在鼠脊髓損傷模型中通過激活TNF-a等促炎因子表達降低,而IL-4等抗炎因子的表達增加,從而抑制炎癥反應。此外,Schwerk等[11]將hADMSCs移植于6-OHDA誘導PD動物模型后發現,hADMSCs聚集于黑質部位,并且上調局部抗炎因子的表達。Noh等[12]利用MSCs與小膠質細胞進行的間接培養試驗發現,MSCs通過TGF-β調控小膠質細胞的炎癥活化表型,進而增強MSCs在中樞神經系統臨床試驗中的治療效果。
綜上所述,MSCs進入損傷部位后介導的免疫調節和誘導內源性再生是其治療效果的主要機制,PD等神經退行性疾病發生過程中,小膠質細胞向病灶區域趨化和遷移。為了探索hADMSCs是否能夠調節小膠質細胞遷移,本研究采用小鼠小膠質細胞系BV2 細胞Transwell遷移試驗來驗證hADMSCs對于小膠質細胞遷移的作用及影響。Transwell遷移試驗結果證實,hADMSCs可阻礙PD細胞模型中BV2細胞的遷移。總之,本研究表明,通過hADMSCs調控小膠質細胞在炎癥反應中的作用,進而緩解局部神經炎癥反應,有望成為PD治療的有效靶點。

