基因沉默多配體蛋白聚糖2抑制肺癌A549上皮間質轉化的機制*
華海俠,劉瑞吉,于曉麟,趙 敏
1.秦皇島市第一醫院 腫瘤內科(秦皇島 066000);2.秦皇島市第一醫院 呼吸內科(秦皇島 066000);3.秦皇島市第一醫院 病理科(秦皇島 066000)
上皮間質轉化(epithelial interstitial transformation,EMT)是指上皮細胞失去原有上皮細胞特征,緊密連接消失,極性紊亂,進而獲得間質細胞表型,遷移和侵襲能力提高的生理性和病理性狀態在腫瘤發生、發展中起到重要的調控作用,是腫瘤干細胞的形成和腫瘤放化療耐性的重要因素[1]。主要特征為上皮標記物E-鈣黏蛋白表達減少,間質表型波形蛋白表達上調,并與轉化生長因子β1(transforming growth factorβ1,TGF-β1)相關信號轉導通路關系密切,其中Snail蛋白是公認的EMT發生的重要轉錄調控因子之一[2]。研究[3]表明,作為一種跨膜硫酸肝素蛋白聚糖,多配體蛋白聚糖2(syndecan-2,SDC2)能夠與生長因子及其受體相結合,如TGF-β1促進其與受體結合激活相應信號轉導通路。已有研究顯示,SDC2在結腸癌[4]、食管癌[5]、前列腺癌[6]等惡性腫瘤中高表達,能夠促進腫瘤細胞黏附、遷移和侵襲。因此本研究擬通過合成針對SDC2的小干擾RNA(small interfere RNA,siRNA),觀察基因沉默SDC2對TGF-β1介導的肺癌A549細胞發生EMT的作用及其機制,為研究SDC2參與腫瘤EMT的作用機制,以及其作為潛在的藥物作用靶點提供一定的科學依據和實驗基礎。
1 材料與方法
1.1 主要試劑
A549細胞購置于中科院上海細胞庫;DMEM培養基、胎牛血清購置于美國GIBIO公司;TGF-β1購置于美國peprotech公司;E-鈣黏蛋白、波形蛋白、Snail、GAPDH購置于美國santa cruz公司;siRNA產品購置于廣州銳博生物科技有限公司。
1.2 方法
1.2.1 細胞培養及轉染 A549細胞用含體積分數為10%胎牛血清的DMEM,置于37 ℃,5%CO2孵育箱中培養。實驗前無血清同步化24 h,實驗分組為(每組n=3):1)對照組:無血清培養+siRNA陰性對照;2)TGF-β1誘導組:5 ng/mL TGF-β1誘導+siRNA陰性對照;3)轉染組:5 ng/mL TGF-β1誘導+SDC2-siRNA 2。按照轉染手冊步驟進行,每25 cm2細胞培養瓶加入50 nmol/mL lipofectamine 2000和10 μL siRNA陰性對照或SDC2-siRNA。siRNA序列如下:1)SDC2-siRNA 1:CCACGA CGCUGAAUAUACA dTdT;GGUGCUGCGAC UUAUAUGU dTdT;2)SDC2-siRNA:GUUGG UGUAUCGCAUGAGA dTdT;CAACCACA UAGCGUACUCU dTdT;3)SDC2-siRNA 3:GGAGAACGCAAACCAUCCA dTdT;CCUCU UGCGUUUGGUAGGU dTdT.
1.2.2 細胞劃痕實驗 將A549細胞按照6 000 個/孔種植于24 孔板,次融合后用200 μL槍頭劃痕,按照實驗分組誘導48 h,分別于0、48 h在相同位置拍照,采用IPP6.0圖像分析軟件測量劃痕區域面積,并計算遷移百分比,即(0 h面積-48 h面積)/0 h面積×100%。
1.2.3 明膠酶譜實驗 采用RIPA裂解液提取蛋白,BCA法測定蛋白濃度。按照20 μg/泳道上樣,10%聚丙烯酰胺(含1%明膠)電泳,切膠震蕩洗脫,于孵育液(50 mmol/L Tris-HCL、5 mmol/CaCl2、1 μmol/L ZnCl2和0.02% Brij-35)中37 ℃孵育48 h。染色(0.05% 考馬斯亮蘭R-250、30%甲醇和10%乙酸)3 h,脫色后采用凝膠圖像分析系統分析各條帶灰度值。
1.2.4 免疫印跡 采用RIPA裂解液提取蛋白,BCA法測定蛋白濃度。按照20 μg/泳道上樣,13%聚丙烯酰胺凝膠電泳,轉膜;E-鈣黏蛋白、波形蛋白、Snail、GAPDH一抗(1∶1 000)4 ℃過夜,二抗(1∶3 000)37 ℃孵育45 min,ECL發光。采用IPP6.0圖像分析軟件測定條帶光密度值,以相應內參(GAPDH)的比值作為該蛋白的相對表達量。
1.3 統計學方法
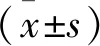
2 結果
2.1 篩選有效的SDC2-siRNA
免疫印跡結果顯示,siRNA陰性對照組SDC含量為0.89±0.10,SDC2-siRNA 1、SDC2-siRNA 2、SDC2-siRNA 3 SDC2的含量分別為0.42±0.19、0.39±0.11、0.21±0.07。與陰性對照組比較差異均有統計學意義(F=17.386,P=0.001;P=0.001;P<0.001)(圖1)。其中SDC2-siRNA3沉默效果最好,因此選擇其進行后續實驗。

圖1 SDC-siRNA有效序列篩選
2.2 SDC2基因沉默抑制TGF-β1介導的A549細胞遷移
與對照組遷移百分比為(9.33±2.08)%比較,TGF-β1誘導組的遷移百分比為(45.67±8.33)%,差異有統計學意義(F=34.270,P<0.001);與TGF-β1誘導組比較,SDC2-siRNA組遷移百分比為(21.33±4.04)%,差異有統計學意義(P=0.036)。
2.3 SDC2基因沉默抑制TGF-β1介導的A549細胞基質金屬蛋白酶(matrix metalloprotein,MMP)2活性
對照組活性MMP2灰度值為31.00±4.00,TGF-β1誘導組為96.33±13.50,兩組差異有統計學意義(F=45.002,P<0.001);與TGF-β1誘導組比較,SDC2-siRNA組為59.33±4.04,差異有統計學意義(P=0.006)(圖2)。
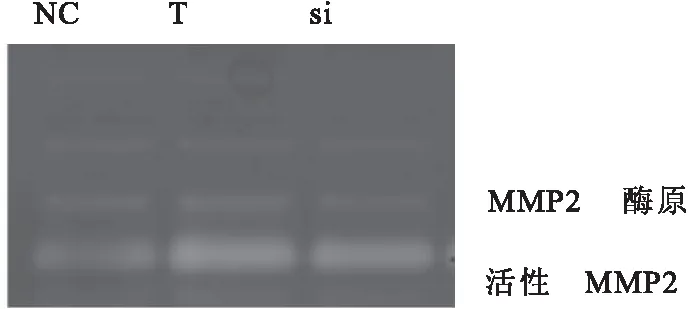
圖2 SDC2-siRNA能夠抑制TGF-β1誘導MMP2活性的上調
2.4 SDC基因沉默抑制TGF-β1介導的A549細胞
與對照組比較,TGF-β1誘導組SDC蛋白表達上調,差異有統計學意義(F=24.217,P=0.001),與TGF-β1誘導組比較,SDC2-siRNA組SDC蛋白表達下調,差異有統計學意義(P=0.002);與對照組比較,TGF-β1誘導組E-鈣黏蛋白表達下調,差異有統計學意義(F=19.232,P=0.001),與TGF-β1誘導組比較,SDC2-siRNA組E-鈣黏蛋白表達上調,差異有統計學意義(P=0.007);與對照組比較,TGF-β1誘導組波形蛋白表達上調,差異有統計學意義(F=35.919,P<0.001),與TGF-β1誘導組比較,SDC2-siRNA組波形蛋白表達下調,差異有統計學意義(P=0.001);與對照組相比較,TGF-β1誘導組Snail蛋白表達上調,差異有統計學意義(F=54.621,P=0.001),與TGF-β1誘導組比較,SDC2-siRNA組Snail蛋白表達下調,差異有統計學意義(P<0.001)(圖3、表1)。

圖3 SDC2-siRNA抑制TGF-β1誘導EMT的發生

表1 SDC2基因沉默對E-鈣黏蛋白、波形蛋白和Snail蛋白表達的影響
注:與對照組相比較,*P<0.05;與TGF-β1誘導組,#P<0.05
3 討論
EMT是腫瘤細胞獲得遷移和侵襲能力的重要因素,也是腫瘤干細胞和腫瘤放化療耐性形成的重要因素[1]。其特征性改變即上皮細胞失去原有表型,其緊密連接蛋白E-鈣黏蛋白等表達缺失,同時表達間質細胞標記物(如波形蛋白等),從而參與了腫瘤的發生與發展[7]。另外,Snail蛋白具有抑制E-鈣黏蛋白轉錄的作用,是促進EMT重要的調控因子之一,其在TGF-β1的誘導下可促進A549細胞發生EMT[8]。在本研究中也發現,經TGF-β1誘導后,A549細胞形態由原有鋪路石樣轉變為成纖維細胞樣,且伴有E-鈣黏蛋白表達的下調,而波形蛋白、Snail蛋白表達上調,同時伴有細胞遷移能力的提高,以及MMP蛋白活性的上調。
有研究[9]表明,SDC2的異常高表達參與了多種惡性腫瘤的發生與發展。在乳腺癌細胞中,基因沉默SDC2能夠誘導乳腺癌細胞發生凋亡,降低乳腺癌移植瘤小鼠模型瘤體體積[10]。其還能通過介導肌動蛋白絲的形成,促進HCT-116結腸癌細胞遷移能力的提高[4]。同時SDC2能夠通過上調MMP-7的活性,促進黏著斑激酶和細胞外信號激酶的磷酸化水平,水解HT-29結腸癌細胞E-鈣黏蛋白,從而促進了上皮細胞解離和遷移[11]。本研究結果顯示,基因沉默SDC2后,能夠抑制TGF-β1誘導的E-鈣黏蛋白表達的下調,同時降低波形蛋白和Snail蛋白的表達水平,進而抑制了細胞遷移能力和MMP2活性,提示SDC2可能是肺癌靶向治療的一個候選指標,深入研究SDC2參與肺癌發生、發展的作用機制,有望為臨床肺癌診療提供一定的科學依據和實驗基礎。

