朗德鵝體組織中MTP基因的發育表達及其在填飼后的變化研究
葉健強 康潤敏
摘要[目的]研究MTP基因在朗德鵝體組織中的表達量及填飼后的變化。[方法]采用RT-PCR方法,以朗德鵝為研究材料,研究了1、10、13、14和16周齡朗德鵝肝臟、小腸、腦、胸肌、腹肌、腹脂、皮脂和心肌組織以及填飼后肝臟與小腸組織中MTP基因的表達量。[結果]1周齡,MTP基因僅在朗德鵝小腸組織中表達;10周齡,除在肝臟和小腸組織中外,首次發現MTP基因在朗德鵝腦組織中也有表達;MTP基因在肝臟和小腸中的表達量隨周齡的增加呈逐步上升的趨勢(P<0.05); 1~13周齡,MTP基因在朗德鵝小腸中的表達量高于肝臟;14~16周齡,MTP基因在朗德鵝小腸中的表達量低于肝臟;填飼后MTP基因在朗德鵝肝組織中的表達量降低,而MTP基因在小腸組織中的表達量升高。[結論]MTP基因在朗德鵝脂肪沉積和轉運過程中具有極重要的調控作用。
關鍵詞朗德鵝;MTP基因;發育階段;表達
中圖分類號S835;Q756文獻標識碼A文章編號0517-6611(2019)02-0075-05
doi:10.3969/j.issn.0517-6611.2019.02.022
開放科學(資源服務)標識碼(OSID):
填飼誘導的鵝肥肝是由于食物中碳水化合物引起的在肝臟中強烈的脂肪生成[1-2],特別是大量的中性脂肪甘油三酯(triglyceride,TG)在肝實質細胞內的異常沉積。微粒體甘油三酯轉運蛋白(microsomal triglyceride transfer protein,MTP)是由大亞基(97 ku)和二硫化合物異構酶(55 ku)(protein disulfide-isomerase,PDI)2種多肽構成的異質二聚復合體,其生理作用是加速細胞膜或亞細胞膜之間甘油三酯、膽固醇脂(cholesteryl ester,CE)和卵磷脂(phosphatidylcholine,PC)等的轉運和合成[3]。研究發現,動物體內肝臟和小腸細胞中形成富含TG的極低密度脂蛋白(very low density lipoproteins,VLDL)和乳糜微粒(chylomicrons,CM)的組裝形成和向血漿分泌過程中主要依賴于MTP(在禽類上,由于小腸淋巴系統不發達,因此小腸中形成的主要是門靜脈微粒)[4]。MTP在載脂蛋白B(Apolipoprotein B,apoB)翻譯和轉移到(endoplasmic reticulum,ER)內質網內膜時,可將體內內源性合成的TG和以CM形式的食物性TG轉運到apoB上,并使其構象折疊恰當,進而可組裝形成一個含有中性脂質中心的脂蛋白顆粒,以便將TG向外周組織分泌。在體內,由于MTP是參與VLDL和CM或門靜脈微粒組裝和分泌過程中的必需因子,因此MTP是調節肝臟和外周組織脂質平衡的一個關鍵因子[5]。
近年來,Lu等[6]和Farese等[7]在小鼠的胚胎發育過程中發現其卵黃囊組織中有MTP基因的表達;同時,Nielsen等[8]和Fournier等[9]發現MTP基因在心臟組織中同樣也有較高地表達,但目前人們在水禽(鵝)脂肪代謝調控機理和基因組織表達上的研究尚未見報道。筆者首次以產肝性能較好的朗德鵝作為試驗材料,對MTP基因在朗德鵝不同組織中的發育表達及其在填飼后的變化進行研究,旨在為研究水禽肝臟脂蛋白合成、組裝與分泌的表達調控機理提供參考依據。
1材料與方法
1.1試驗動物及其飼養管理
選用健康朗德鵝雛鵝(公鵝)60只,隨機分為對照組(45只)和填飼組(15只)進行飼養(四川省原種水禽場提供)。參照Fournier等[9]的飼養方式,整個飼養期采用自由飲水。0~4周,自由采食雛鵝料(代謝能12 351 kJ/kg,粗蛋白20.5%);5~13周,自由采食生長鵝飼料(代謝能10 886 kJ/kg,粗蛋白13.8%)并按照精飼料量的5%添加青飼料。4~5、6~8、9~13周齡飼料添加量分別為150、165和120 g/(只·d)。13周齡填飼組開始預填飼,預填飼時只添加精料且供給量逐漸過渡為自由采食;對照組,繼續飼喂生長鵝飼料,自由采食。14周齡開始填飼,每天機器填飼5次,填飼期2周,其飼料配方如下:煮熟的黃玉米、3%鵝油和1.5%食鹽等(代謝能14 109 kJ/kg,粗蛋白9.0%)。
1.2樣品采集
分別于1、10、13、14和16周齡采集對照組和填飼組中鵝的肝臟、小腸組織樣各5 g,其中10周齡另采集胸肌、腿肌、皮脂、腹脂、腦和心臟等組織樣各5 g。將采集的各組織樣品,先使用DEPC處理水洗去表面血液,然后用剪刀迅速剪成50~100 mg的組織塊,放入2 mL凍存管內并做好標記后迅速存于液氮中速凍,以備總RNA提取,速凍后的樣品于-70 ℃液氮罐中保存,以供各組織總RNA的抽提。
1.3試驗方法
1.3.1各組織總RNA的提取。
取-70 ℃條件下保存的各種組織50 mg,按照Beyozol kit使用說明書分別提取各組織的總RNA,使用紫外分光光度計測定總RNA的濃度和純度(OD260/ OD280為1.8~2.0),利用1.0%變性瓊脂糖凝膠電泳檢測總RNA質量,置于-70 ℃條件下貯存或立即進行反轉錄。
1.3.3半定量分析及數據統計分析。
抽提的總RNA及RT-PCR產物使用1.0%的瓊脂糖凝膠電泳進行;電泳結束后用凝膠成像系統(BTS-20.M,UVItec,Inc.)進行拍照;半定量分析軟件用Quantity one進行,并計算目的基因的相對表達量。試驗數據用SAS 6.12統計軟件進行統計與分析,并采用LSD法進行多重比較。
2結果與分析
2.1總RNA的提取和純化
利用RNA抽屜試劑盒分別對不同發育階段和不同處理間的多種組織總RNA進行提取,取5 mL總RNA進行瓊脂糖凝膠電泳。由圖1A可以看出,抽提總RNA的28S、18S條帶清晰、銳利,且28S條帶亮度約為18S條帶的2倍左右,說明所抽提的總RNA完整;但因未經DNase Ⅰ? 處理,其總RNA中含有大量DNA雜帶,經DNase I處理后(圖1B),說明已經將DNA的污染去除且RNA的完整性沒有被破壞,因此其處理是有效的。通過吸光度定量分析,各組織總RNA OD260/OD280為1.8~2.0,表明抽提RNA具有較高的質量,可進行后續試驗。
2.2MTP基因在朗德鵝各組織中的表達
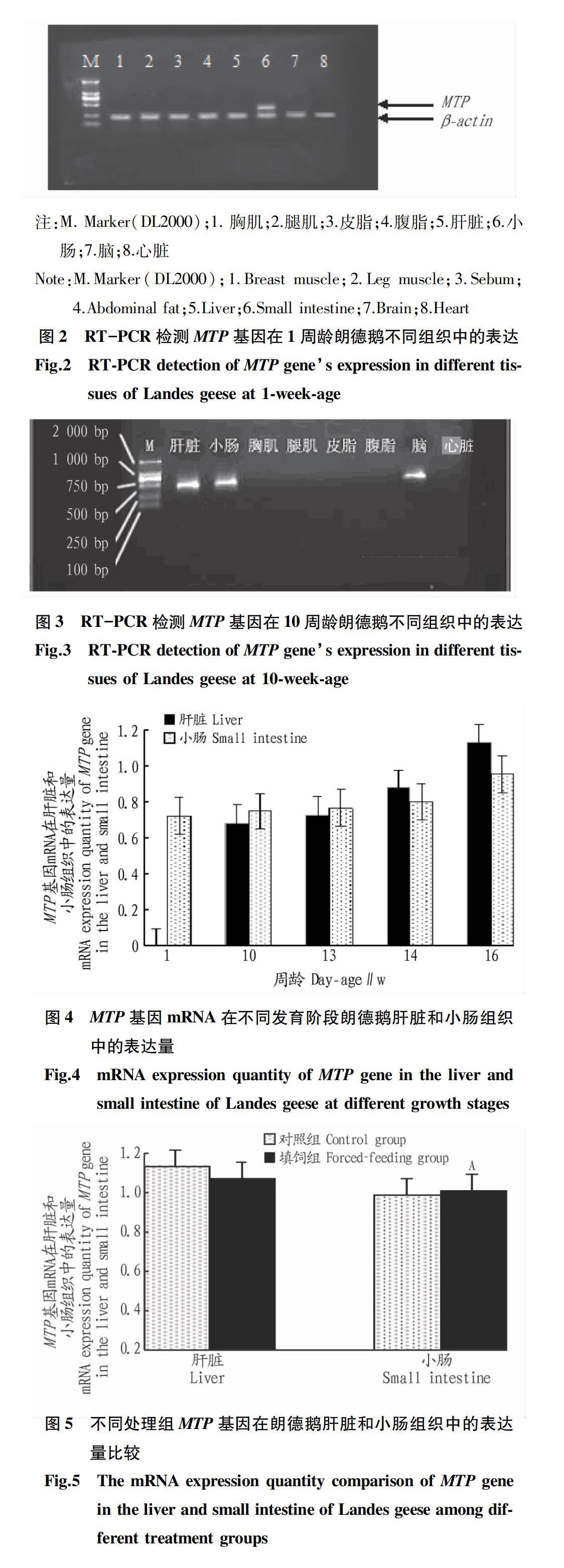
從圖2和圖3可以看出,1周齡MTP基因僅在朗德鵝小腸組織中表達,10周齡MTP基因在朗德鵝肝臟、小腸和腦組織中均有表達,在胸肌、腿肌、皮脂、腹脂和心臟組織中則未檢測到表達。
2.3MTP基因在不同發育階段朗德鵝肝臟和小腸組織中的表達量
MTP基因在朗德鵝肝臟和小腸組織中的表達量隨日齡的增加呈上升趨勢(圖4),且差異均達到顯著水平(P<0.05)。
2.4填飼后MTP基因mRNA在朗德鵝肝臟和小腸組織中的表達量
填飼后,朗德鵝肝臟組織中MTP基因mRNA表達豐度降低,但差異不顯著(P>0.05);小腸組織中MTP基因mRNA表達豐度卻顯著升高(P<0.05)(圖5)。
3討論
3.1MTP基因在朗德鵝不同組織中的表達特性
該研究首次測定了朗德鵝不同組織中MTP基因mRNA表達量,結果發現10周齡MTP基因僅在肝臟、小腸和腦組織中有表達,而在其他脂肪和肌肉組織中(如腹脂、皮脂、胸肌、腿肌和心臟組織)中均不表達;16周齡,肝臟和小腸組織中仍檢測到MTP基因的表達。此表達特點與Davis[10]、Lu等[11]、Farese等[7]和Terasawa等[12]在哺乳動物(豬和小鼠)肝臟和小腸組織中均發現有MTP基因表達的結論一致;這都證實了MTP基因在脂質轉運中的生理作用——MTP基因在ER內膜中將TG、CE和PC等的轉運到apoB上并協同組裝成富含apoB的脂蛋白(VLDL)向血漿中分泌[13-14]。由于在哺乳動物上發現其體內的脂蛋白主要是肝臟組織中合成的VLDL、小腸組織中的乳糜微粒和胎兒的卵黃囊組織中的VTG[15];在禽類上,Bensadoun等[16]認為除肝中能合成VLDL和VTG外,由于其小腸淋巴系統不發達,禽類小腸中合成的脂蛋白被直接轉運至門靜脈系統進行代謝,這種脂蛋白稱為門靜脈微粒(potimicron)。因此,MTP基因在朗德鵝肝臟和小腸組織中發現有表達,反映了禽類上述的生理特點——禽類體內VLDL和門靜脈微粒的合成和分泌主要依賴于MTP基因的脂質轉運功能[17]。
筆者首次發現MTP基因在朗德鵝腦組織中有表達,這與Terasawa等[12]、Nielsen等[18]、Nielsen等[19]、Borén等[20]、Walzem等[21]和Iqbal等[22]在小鼠卵黃囊組織、人類心肌組織和雞腎臟組織中發現有MTP基因表達的特點并不一致;一些研究表明,MTP基因在某組織中表達可能與該組織中脂蛋白的形成和分泌有關,且是該組織中沉積的過多TG向外轉運的一種新途徑,同時也依賴于MTP基因啟動子SREBP1的表達[12,18-20]。因此,根據MTP基因的生理作用推測,MTP基因在朗德鵝腦組織中表達與其腦組織中某種脂蛋白的合成和分泌有關,但MTP基因是否參與腦組織中某種脂類物質的轉運調控有待進一步研究。
47卷2期葉健強等朗德鵝體組織中MTP基因的發育表達及其在填飼后的變化研究
3.2MTP基因在不同發育階段朗德鵝肝臟和小腸組織中的表達特性
目前,對哺乳動物MTP基因不同發育階段的表達特性研究較少。Shelton等[23]、Plonné等[24]和Lu等[6]分別對胚胎期小鼠中MTP基因大亞基、哺乳期大鼠初級肝細胞和不同發育階段豬肝臟和小腸組織中MTP基因的表達進行了初步研究;Levy等[25]研究了人胚胎期小腸組織中MTP基因的表達特性。在禽類脂肪代謝上,不僅缺乏對MTP基因在體內、外的表達特性研究,不同發育階段MTP基因在組織上的表達特性研究未見報道。該研究采用RT-PCR法首次以朗德鵝1、10、13、14和16周齡5個不同發育階段研究了肝臟和小腸組織中MTP基因的表達特性,結果表明1周齡MTP基因僅在小腸組織中表達;10周齡,檢測到MTP基因在肝和小腸組織中均有表達;同時發現MTP基因不僅在不同的發育階段表達豐度存在差異,而且不同組織間其表達豐度也存在差異,即10~16周齡MTP基因在肝臟與小腸組織中的表達量均呈顯著上升趨勢; 1~13周齡小腸組織中MTP基因表達豐度高于肝臟,14~16周齡MTP基因在小腸組織中表達豐度卻低于肝臟。
Lu等[6]研究發現新生乳豬胎兒期MTP基因在肝臟和小腸組織中都有較高表達,但出生后MTP基因在空腸組織中維持較高的表達直到泌乳結束,而在回腸組織中其表達量在出生后2 d降低;出生后,MTP基因在肝組織中的表達一直維持較低的表達水平。Black[26]和Lu等[6]認為此階段MTP基因的表達主要與胎兒期或剛出生時體內脂質的吸收和代謝特點有關,因為此階段主要依靠胎盤或母乳有效地吸收營養和利用食物中的脂類物質(以TG為主),并且體內50%左右的能量供應來源與母乳中的脂質代謝;MTP基因發揮脂質轉運作用形成乳糜微粒,進而向外周組織分泌。Raabe等[27]認為新生動物小腸組織中較高的MTP基因表達是必要的,也反映出其在脂質轉運過程中的重要性,且在缺乏MTP基因表達的小鼠胚胎早期不能成活的研究中得以證實。此外,1周齡雛鵝所利用的營養物質不同于胚胎期和出殼后2~3 d,后者其主要通過卵黃囊將母體的營養成分供給雛鵝;而此階段的雛鵝主要以攝入外源性營養物質在小腸絨毛組織中被分解、組裝成門靜脈微粒直接進入肝臟中[7]來維持體內的能量和蛋白需求;另外,機體發育早期主要是體細胞增長,脂肪沉積較少,則肝組織中合成的脂質相對較少,進而肝組織中脂質通過MTP基因組裝、形成并轉運到血漿中的富含TG的VLDL就更為有限。因此,為了維持和生長發育的需求,此階段雛鵝小腸組織相對肝臟組織的生理作用較大,所以MTP基因在這2個組織間的表達呈差異性。14~16周齡,機體已發育成熟,此時主要是以脂肪沉積為主[15],因此在肝臟中合成的TG量也增大,進而通過MTP基因脂質轉運作用將TG和apoB轉運結合在一起形成能夠分泌到血漿中VLDL的量也有所增加[28],此階段肝組織中MTP基因表達量的提高與滿足自身營養需要是一致的;同時,此階段其采食量加大,則在小腸組織中被分解的脂類物質的量提高,從而加大了MTP基因的轉運作用。
3.3填飼前后朗德鵝MTP基因在肝臟和小腸組織中表達特性
14~16周齡,在肝臟和小腸中的表達都進一步提高且肝組織中的表達量高于小腸,這與飼料成分(高能的碳水化物—玉米)、飼養方式(填飼)和此期間體內脂肪沉積強度有密切關系。此階段,食物中大量碳水化物由小腸消化組織吸收后,使通過血漿運輸到門靜脈的葡萄糖濃度大大提高,進而促進肝內的脂質(TG)合成[29]。肝細胞ER中MTP基因的主要作用是將肝內合成的大量TG轉運到apoB上,并與其一起形成富含TG的VLDL向血漿中分泌,其目的在于調節TG在肝內和肝外脂肪組織之間的平衡,則MTP基因的表達量大幅度提高。同樣,在小腸組織中,隨著采食量的增加,進入到小腸組織中的食物源性脂質含量也加大,小腸中向門靜脈系統分泌的門靜脈微粒的量增加,而MTP基因在門靜脈微粒的形成和分泌中是必需的[15],因此MTP基因在小腸組織中的表達也大幅度提高。然而,小腸組織中MTP基因的表達量低于肝組織,這種差異與家禽的生理特點相一致,因為家禽的脂肪組織發育、脂肪沉積和蛋黃的形成主要取決于血漿中的TG濃度,但其肝外組織合成的脂肪很有限,血漿中的TG主要來源于日糧或肝臟,而日糧中的脂肪含量很有限,因此肝臟在禽類脂類代謝過程中起著至關重要的作用[15]。此外,由于禽類的小腸淋巴系統不發達,小腸絨毛細胞內合成的脂蛋白微粒直接通過門靜脈系統進入肝臟,并在其中代謝;Wetterau等[13]研究發現,MTP基因在肝臟和小腸組織中的表達主要受脂質和胰島素調節,但在2個組織的反應卻不相同,其認為可能是因為MTP的蛋白質水平與其表達水平間的變化敏銳程度不一致,這主要與體內長期適應有關。因此,填飼期間食物中大量的脂肪對肝組織中MTP基因表達的促進作用較小腸大。此特性與在大鼠[30]和豬[31]的研究結果不同,在小鼠和豬中隨著日齡的增長,肝臟和小腸中MTP基因的表達量逐漸降低,直至成年后趨于穩定,這可能是由于不同物種間消化生理和日糧組成在各發育生長階段不同所致。
總而言之,與豬[6]一樣,MTP基因在不同發育階段朗德鵝肝臟與小腸組織中的表達是以一種滿足自身營養需要的方式來進行的。雖然,各物種自身的遺傳特性在MTP基因的表達上起主要作用,但飼料中脂肪的含量和類型同樣在調節其表達上起著重要作用。
4結論
MTP基因的表達具有組織差異性,其優勢組織為肝臟和小腸,特有組織為腦;MTP基因在肝臟和小腸中的表達量隨周齡的增加呈逐步上升趨勢(P<0.05); 1~13周齡,MTP基因在小腸中的表達量高于肝臟;14~16周齡,MTP基因在小腸中的表達量低于肝臟;填飼后MTP基因中肝組織中的表達水平有所降低,而MTP基因在小腸組織中的表達水平有所升高。MTP基因在鵝肥肝形成中具有重要的調控作用。
參考文獻
[1] BNARD G,LABIE C.Evolution histologique du foie des palmipedes au cours du gavage [C]//Troisiemes Joumees de la Recherche sur les Palmipedes a Foie Gras.[s.l.]:[s.n.],1998:31-35.
[2] MOUROT J,GUY G,LAGARRIGUE S,et al.Role of hepatic lipogenesis in the susceptibility to fatty liver in the goose (Anser anser)[J].Comp Biochem Physiol B Biochem Mol Biol,2000,126(1):81-87.
[3] WETTERAU J R,ZILVERSMIT D B.A triglyceride and cholesteryl ester transfer protein associated with liver microsomes[J].J Biol Chem,1984,259(17):10863-10866.
[4] 咼于明.家禽營養[M].2版.北京:中國農業大學出版社,2004.
[5] TSU KAMOTO H.Fat paradox in liver disease [J].Keio J Med,2005,54(4):190-192.
[6] LU S,HUFFMAN M,YAO Y,et al.Regulation of MTP expression in developing swine[J].J Lipid Res,2002,43:1303-1311.
[7] FARESE R V JR,CASES S,RULAND S L,et al.A novel function for apolipoprotein B:Lipoprotein synthesis in the yolk sac is critical for maternal-fetal lipid transport in mice[J].J Lipid Res,1996,37(2):347-360.
[8] NIELSEN L B.Lipoprotein production by the heart:A novel pathway of triglyceride export from cardiomyocytes[J].Scand J Clin Lab Invest Suppl,2002,62(7):35-40.
[9] FOURNIER E, PERESSON R, GUY G, et al. Relationship between storage and secretion of hepatic lipids in two breeds of geese with different susceptibility to liver steatosis[J].Poult Sci, 1997,76(4):599-607.
[10] DAVIS R A.Cell and molecular biology of the assembly and secretion of? apolipoprotein Bcontaining lipoproteins by the liver[J].Biochimica et biophysica acta,1999,1440(1):1-31.
[11] LU S,HUFFMAN M,YAO Y,et al.Regulation of MTP expression in developing swine[J].J Lipid Res,2002,43(8):1303-1311.
[12] TERASAWA Y,CASES S J,WONG J S,et al.Apolipoprotein Brelated gene expression and ultrastructural characteristics of lipoprotein secretion in mouse yolk sac during embryonic development[J].J Lipid Res,1999,40(11):1967-1977.
[13] WETTERAU J R,LIN M C M,JAMIL H.Microsomal triglyceride transfer protein[J].Biochim Biophys Acta,1997,1345(2):136-150.
[14] CARTWRIGHT I J,PLONN D,HIGGINS J A.Intracellular events in the assembly of chylomicrons in rabbit enterocytes[J].J Lipid Res,2000,41(11):1728-1739.
[15] 尹靖東,齊廣海,霍啟光.家禽脂類代謝調控機理的研究進展[J].動物營養學報,2000,12(2):1-7.
[16] BENSADOUN A,ROTHFELD A.The form of absorption of lipids in the chicken,Gallus domesticus[J].Proc Soc Exp Biol Med,1972,141(3):814-817.
[17] HIGASHI Y,ITABE H,FUKASE H,et al.Transmembrane lipid transfer is crucial for providing neutral lipids during very low density lipoprotein assembly in endoplasmic reticulum[J].J Biol Chem,2003,278(24):21450-21458.
[18] NIELSEN L B,SULLIVAN M,VANNIREYES T,et al.The DNA sequences required for apolipoprotein B expression in the heart are distinct from those required for expression in the intestine[J].J Mol Cell Cardiol,1999,31(4):695-703.
[19] NIELSEN L B,PERKO M,ARENDRUP H,et al.Microsomal triglyceride transfer protein gene expression and triglyceride accumulation in hypoxic human hearts[J].Arterioscler Thromb Vasc Biol,2002,22(9):1489-1494.
[20] BORN J,VNIANT M M,YOUNG S G.Apo B100containing lipoproteins are secreted by the heart[J].J Clin Invest,1998,101(6):1197-1202.
[21] WALZEM R L,HANSEN R J,WILLIAMS D L,et al.Estrogen induction of VLDLy assembly in egglaying hens[J].J Nutr,1999,129:467-472.
[22] IQBAL J,RUDEL L L,HUSSAIN M M.Microsomal triglyceride transfer protein enhances cellular cholesteryl esterification by relieving product inhibition[J].J Biol Chem,2008,283(29):19967-19980.
[23] SHELTON J M,LEE M H,RICHARDSON J A,et al.Microsomal triglyceride transfer protein expression during mouse development [J].J Lipid Res,2000,41(4):532-537.
[24] PLONN D,SCHULZE H P,KAHLERT U,et al.Postnatal development of hepatocellular apolipoprotein B assembly and secretion in the rat[J].J Lipid Res,2001,42(11):1865-1878.

