超聲內鏡引導下膽管引流技術中肝胃吻合術與順行技術治療惡性梗阻性黃疸患者的療效及安全性比較
廖 曄, 郭瑾陶
(中國醫科大學附屬盛京醫院 內鏡診治中心, 遼寧 沈陽, 110004)
自20世紀90年代以來,經內鏡逆行性胰膽管造影術(ERCP)已成為良、惡性膽道梗阻患者的首選引流方式,但也存在一定的局限性,如患者壺腹部解剖結構發生改變(如消化道術后或先天異常),即使由經驗豐富的內鏡醫師操作也可能發生乳頭插管失敗。ERCP失敗后緩解膽道梗阻的傳統方法是經皮肝穿刺膽管引流術(PTCD)或外科手術治療,二者均屬于非生理性引流方式,并發癥發生率較高,嚴重影響患者生存質量[1]。
Giovannini M等[2]在2001年首次提出內鏡超聲引導下膽管引流術(EUS-BD), 憑借其經濟、解剖及生理性的優勢,EUS-BD已被視為ERCP失敗后的有效補救治療措施[3]。有研究[4]證實,對于無法切除的惡性遠端膽道梗阻,EUS-BD與PTBD均可作為首選治療方案。根據穿刺位置,EUS-BD可分為肝外途徑與經肝途徑。現有研究[5-6]認為,經肝途徑是存在肝內膽管擴張時的首選引流途徑。根據引流方式的不同,肝內途徑又可分為EUS引導下肝胃吻合術(EUS-HGS)、對接技術(RV)與EUS引導下順行技術(EUS-AG)。由于RV途徑具有不產生永久性瘺道、引流符合正常生理解剖結構、操作與ERCP類似、并發癥發生率低等優勢,多被推薦為EUS-BD的首選方案[7-8], 但其需要逆行支架植入,當內鏡無法到達十二指腸乳頭時, RV無法實現,而HGS和AG是可行的[9]。本研究回顧了15例行EUS-HGS或EUS-AG的惡性膽道梗阻患者的臨床效果及并發癥發生情況,現將結果報告如下。
1 資料與方法
1.1 一般資料
選取2014年10月—2018年12月本院住院期間行肝內途徑EUS-BD的惡性梗阻性黃疸患者共15例,其中11例患者行EUS-HGS(男8例、女3例),4例患者行EUS-AG(男3例、女1例),平均年齡(66.9±9.0)歲。所有手術由具有EUS與ERCP豐富操作經驗的內鏡醫師在麻醉下完成。
1.2 使用器材
日本Pentax EG-3870UTK線陣超聲內鏡, HITACHI EUB-6500超聲主機; 美國Wilson-Cook 19-G穿刺針,美國Boston-Scientific 0.035英寸導絲,美國Wilson-Cook 6Fr囊腫切開刀,美國Wilson-Cook 10 mm×80 mm全覆膜金屬膽道支架,美國Boston-Scientifc 10 mm×60 mm全覆膜金屬膽道支架,美國Boston-Scientific 10 mm×60 mm不覆膜金屬膽道支架。
1.3 治療方法
線陣式超聲內鏡進鏡至胃內,掃查肝臟左外葉,選擇一處與胃壁較近的擴張肝內膽管作為穿刺點(B2或B3), 應用彩色多普勒功能避開穿刺路徑中的血管。穿刺針刺入膽管后,回抽膽汁以確定穿刺針在膽道內,而后注入造影劑進行膽管造影,進一步明確穿刺針位置,顯示擴張的肝內外膽管。
EUS-HGS組通過穿刺針置入導絲,放置于膽總管內。沿導絲制造胃與肝內膽管的瘺道,使用囊腫切開刀形成瘺道,根據狹窄程度置入6~8 cm金屬支架并釋放。EUS-AG組通過穿刺針置入導絲,通過狹窄段或十二指腸乳頭。使用囊腫切開刀形成瘺道,根據狹窄段長度順行置入6~8 cm金屬支架,經乳頭放置或通過惡性狹窄。造影見膽管內造影劑引流通暢,無外溢。
1.4 術后處理
患者治療后臥床休息,禁食、禁水,給予補液、抑酸、經驗性應用抗菌藥物治療,并密切觀察癥狀和生命體征,注意有無消化道出血、膽汁外溢、腹膜炎、胰腺炎等并發癥出現,觀察肝功能、血常規等指標,復查腹部CT以觀察支架位置形態及有無移位等。
1.5 觀察指標
本研究中,操作成功指穿刺成功并放置膽管支架或取石成功,臨床成功指術后總膽紅素較術前下降。觀察2組的操作成功率、臨床成功率、術后第1天血清總膽紅素下降情況、并發癥發生率、住院時間等。
1.6 統計學分析
采用SPSS 25.0統計軟件進行數據分析。計量資料以均數±標準差表示,組間比較采用t檢驗,計數資料采用Fisher′s精確檢驗法,P<0.05為差異有統計學意義。
2 結 果
2.1 2組患者一般資料比較
2組患者原發病、性別、年齡、術前總膽紅素水平比較,差異均無統計學意義(P>0.05)。見表1。
2.2 2組患者相關指標比較
2組操作成功率、臨床成功率、術前及術后第1天總膽紅素、總膽紅素下降率比較,差異無統計學意義(P>0.05), 但2組術后第1天總膽紅素水平均較術前顯著下降(P<0.05), 見表2。EUS-HGS組發生并發癥患者共3例(27.3%), 其中2例菌血癥,1例局限性腹膜炎,保守治療后均緩解; EUS-AG組發生1例感染性休克(25.0%), 患者于術后第12天死亡。EUS-HGS組術后并發癥發生率高于EUS-AG, 但差異無統計學意義(P>0.05)。
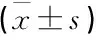
表1 2組患者一般資料比較
2.3 2組患者術后住院時間、生存時間、支架再梗阻情況比較
EUS-HGS組術后住院時間、生存時間依次為(9.0±5.7)、(273.7±64.4) d, 與EUS-AG組的(7.3±4.4)、(55.3±41.2) d比較,差異無統計學意義(P>0.05)。EUS-HGS組有4例患者術后發生支架再梗阻,均由腫瘤進展導致,支架再梗阻率為26.7%, 其中2例行PTCD后黃疸緩解, 1例于支架內留置鼻膽管引流, 1例行EUS-AG后緩解。EUS-AG組未發生支架再梗阻。
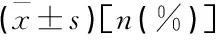
表2 2組患者相關指標比較
與術前比較, *P<0.05。
3 討 論
EUS-HGS與EUS-AG的安全性與有效性已被大量臨床數據所證實,但尚無直接比較二者優劣的研究。內鏡無法觸及十二指腸乳頭是二者相同的手術適應證,且此類患者多為惡性腫瘤晚期,身體狀況差,難以耐受多次手術,因而兩種術式的適宜選擇極為重要。
多數研究[10-19]報道EUS-HGS的技術成功率、臨床成功率要略優于EUS-AG, 與本研究結果基本相符。本研究中, 2組術后第1天血清總膽紅素均較術前顯著下降(P<0.05), 證實二者均有效。本研究中, EUS-HGS組的臨床成功率(90.9%)高于EUS-AG組(75.0%), 但其不良事件發生率(27.3%)亦高于EUS-AG組(25.0%), 這可能是由于EUS-AG的操作更為復雜,但其不產生永久性瘺道且引流符合正常生理解剖結構。
對于惡性膽道梗阻患者, EUS-BD屬于姑息治療手段,通過引流膽汁而改善肝臟功能,延長患者生存時間,改善生活質量。但腫瘤的持續進展常會導致膽道再次梗阻,甚至導致患者死亡,因而支架的通暢情況及術后再發膽道梗阻的多次介入治療對于惡性膽道梗阻患者同樣重要。本研究隨訪中共4例患者發生術后支架再次梗阻(均為HGS組),支架再梗阻率為26.7%, 其中2例行PTCD, 1例于支架內置入鼻膽管引流,另1例患者分別于術后4個月與1年后發生膽道再梗阻,均通過AG手術治療緩解。從解剖結構上考慮, AG支架放置于腫瘤處,而腫瘤的支架內生長是支架再梗阻的主要原因,其支架再梗阻的可能性應大于HGS。本研究中再次梗阻均發生在HGS組,可能與患者術后生存時間長于AG組患者有關。由于沒有穿壁瘺道, AG術后梗阻的內鏡下再次干預較HGS更為困難。有相關報道[20-23]提出,同時行HGS與AG可以延長支架的通暢時間,減少不良事件的發生。
壺腹部解剖結構復雜,惡性膽道梗阻患者由于腫瘤侵襲常合并有消化道梗阻[24]。本研究中共有3例患者出現了膽道合并消化道梗阻,作者嘗試通過同時置入膽道支架與十二指腸支架(EUS-AG組1例, EUS-HGS組1例)或同時行內鏡下胃腸吻合術(EUS-HGS組1例)解決。對于膽道合并十二指腸梗阻的雙支架同時置入,此前曾有許多相關報道。通過ERCP或經皮置入膽道支架,手術總成功率為86.0%~100.0%[24-26]。Canena J等[25]提出,對于雙支架置入的患者,十二指腸支架梗阻是膽道支架梗阻的獨立危險因素。通過EUS-BD置入膽道支架,合并十二指腸支架的成功率為100.0%, 不良事件發生率為27.3%~100.0%[27]。本研究中, 2例膽道支架與十二指腸支架均成功置入,且膽道引流通暢。EUS-AG組1例患者術后第5天出現消化道梗阻、感染性休克、彌散性血管內凝血(DIC), 復查CT示十二指腸末端及近端空腸管腔仍狹窄,術后第12天患者死亡。考慮其死亡原因為消化道梗阻未能完全緩解,且腫瘤進展導致肝功下降,膽汁分泌減少,食物反流入膽道導致感染性休克。該病例提示同時患有膽道與消化道梗阻的患者需在充分緩解消化道梗阻后再行膽道內引流,避免引起膽道感染。本研究結果提示, EUS-HGS比EUS-AG具有更高的臨床成功率與不良事件發生率,但差異無統計學意義。

