十二烷基硫酸鈉毛細管電泳法分析非還原單克隆抗體藥物純度的前處理條件優化
劉振東, 高 鐵, 徐玲麗, 楊 勇, 王慶民*, 陳泓序*
(1. CE & Biopharma, Sciex, 北京 100015; 2. 齊魯制藥有限公司藥物研究院, 山東 濟南 250100)
十二烷基硫酸鈉毛細管電泳法(sodium dodecyl sulfate capillary electrophoresis, CE-SDS)作為當前單克隆抗體(monoclonal antibody, mAb)純度檢測的主要方法,已經收錄到《中國藥典》2015版中,并在單抗藥物的質量研究及放行檢測中用于純度分析。藥典中要求對單抗藥物的還原(reduced, r)和非還原(non-reduced, nr)樣品進行分別檢測,匯報兩種純度結果[1]。還原和非還原單抗純度分析的差別在于樣品前處理[2,3]。兩種分析方法中樣品均需要與十二烷基硫酸鈉(sodium dodecyl sulfate, SDS)絡合,但還原單抗純度分析時需要使用巰基乙醇等還原劑將單抗結構中的二硫鍵斷裂,形成輕鏈和重鏈。而非還原單抗純度分析則需要保持二硫鍵穩定不斷裂,故需加入巰基封閉劑對裸露的巰基進行封閉[4],防止游離巰基介導的鏈間二硫鍵斷裂而產生碎片。
目前大部分生物藥生產企業均采用CE-SDS純度分析試劑盒(Sciex公司)中的標準條件進行前處理[5],即還原和非還原單抗分析均采用0.1 mol/L Tris-HCl+1%SDS (pH 9.0)溶液作為樣品緩沖液對免疫球蛋白G(IgG)進行還原和非還原處理以及與SDS的絡合[6]。而對于非還原單抗純度分析,使用現有的樣品緩沖液(pH 9.0)時,單抗樣品在處理過程中可能會發生抗體鏈間二硫鍵斷裂而產生非預期的降解片段,如輕鏈(light chain, LC)、重鏈(heavy chain, HC)、重輕鏈(heavy chain-light chain, HL)、重重鏈(heavy chain-heavy chain, HH)、重重輕鏈(heavy chain-heavy chain-light chain, HHL)[7]。影響非還原單抗藥物純度分析的準確性,使純度測定結果偏低。
為了保證非還原單克隆抗體CE-SDS純度分析的客觀和準確性,我們對非還原單抗CE-SDS純度分析的樣品前處理條件進行了優化。發現:這些非預期的降解主要來源于巰基封閉劑的效果不佳,使單抗分子鏈間發生了二硫鍵斷裂而產生了額外的降解片段。通過對碘乙酰胺(iodoacetamide, IAM)和N-乙基馬來酰亞胺(N-ethylmaleimide, NEM)兩種常用巰基封閉劑作用機理的研究,我們發現上述兩種巰基封閉劑均產生如下效果:樣品緩沖液的pH會影響封閉反應,進而影響抗體的降解。
1 實驗部分
1.1 儀器、試劑及樣品
毛細管電泳儀(PA800 Plus生物制藥分析系統,Sciex公司);電熱恒溫水槽(DK-8,上海森信實驗室儀器有限公司);分析天平(AL104, Mettler Toledo公司);離心機(Biofuge, Thermo公司)。
IgG純度分析試劑盒(A10663, Sciex公司):包含SDS凝膠緩沖液、樣品緩沖液(pH 9.0)、熔融石英毛細管、0.1 mol/L HCl和0.1 mol/L NaOH; IAM (A14715, Alta Aesar公司); NEM (N808609-5g, Macklin公司);磷酸氫二鈉(Na2HPO4, 20040618,國藥化學試劑公司);檸檬酸(102120170303,湖南爾康公司);十二烷基硫酸鈉(0227-100G, Amresco公司);二次去離子水(Millipore公司)。
mAb A(IgG1)、mAb B(IgG2)、mAb C(IgG1)、mAb 1(IgG1)、mAb 2(IgG1片斷)、mAb 3(IgG1)、mAb 4(IgG2)、mAb 5(IgG4)、mAb 6(IgG2)、mAb 7(IgG1)樣品及其不同批次樣品均由齊魯制藥有限公司藥物研究院生物技術研究所制備。
1.2 溶液配制
1.2.1樣品緩沖液
pH 9.0樣品緩沖液:0.1 mol/L Tris-HCl+1%SDS(取自Sciex IgG純度分析試劑盒)。pH 6.0、7.0、8.0樣品緩沖液:20 mmol/L Na2HPO4-檸檬酸+1%SDS(不同pH由1 mol/L NaOH進行調節)。
1.2.2巰基封閉劑
用二次去離子水分別配制1 mol/L IAM和0.1 mol/L NEM,需在實驗前現用現配。
1.3非還原CE-SDS樣品前處理
取不同pH的樣品緩沖液,加入2 μL 1 mol/L的IAM或5 μL 0.1 mol/L的NEM,再加入100 μg的樣品,使其終體積為100 μL,其中IAM的終濃度為0.02 mol/L, NEM的終濃度為0.005 mol/L。70 ℃溫浴10 min,冷卻,10 000 r/min離心5 min。需在毛細管電泳進樣前現用現配。
1.4毛細管電泳條件
毛細管:20/30 cm(有效/總長度),內徑50 μm;毛細管溫度:25 ℃;樣品儲存溫度:25 ℃;進樣:-10 kV, 20 s;分離電壓:-15 kV,分離時間:35 min;檢測器:二極管陣列檢測器,220 nm。
1.5毛細管電泳沖洗條件
新更換毛細管使用0.1 mol/L NaOH、0.1 mol/L HCl、二次去離子水、SDS凝膠緩沖液分別在0.5 MPa條件下沖洗10 min,再進行-15 kV電壓平衡10 min;針間沖洗為0.1 mol/L NaOH、0.1 mol/L HCl、二次去離子水分別在0.5 MPa下沖洗3 min, SDS凝膠緩沖液0.5 MPa沖洗10 min。
2 結果與討論
2.1 樣品緩沖液pH對非還原單抗純度分析的影響
非還原單抗前處理時使用巰基封閉劑來封閉游離的巰基,防止游離巰基介導的鏈間二硫鍵斷裂而產生碎片[8,9]。據文獻報道,兩種常用的巰基封閉劑IAM和NEM的最佳封閉條件均在pH 6.0~7.0[10,11],而現有商品化試劑盒中的樣品緩沖液pH為9.0。因此我們考察了不同pH (pH 6.0、7.0、8.0、9.0)的樣品緩沖液的封閉效果,對4種樣品緩沖條件下的分析結果進行了比較。
3種單抗樣品(mAb A、mAb B、mAb C)采用兩種烷基化試劑(IAM、NEM)和4種不同pH(6.0、7.0、8.0、9.0)的樣品緩沖液進行前處理,電泳分析后進行主峰純度的對比,主峰純度在不同pH條件下的趨勢如圖1。結果表明,采用IAM或NEM作為巰基封閉試劑,隨著樣品緩沖液pH的逐漸升高,非還原單抗的CE-SDS主峰含量逐漸下降,pH 6.0與pH 9.0時的主峰含量差值可達6.5%之多,且在使用IAM和NEM兩種封閉試劑的條件下具有相同的趨勢。用pH 6.0樣品緩沖液進行前處理時的抗體純度明顯高于用pH 9.0的樣品緩沖液,此結論與之前Zhang等[12]的報道一致。

圖 1 不同pH樣品緩沖液條件下單抗純度的變化趨勢Fig. 1 Purity trend of mAbs under differentsample buffer pHThe purity trend of mAb A/mAb B/mAb C by non-reduced CE-SDS via different sample buffer pH and different alkylation agents.
pH低于6.0的緩沖溶液會影響IAM和NEM封閉游離巰基的效果,且考慮到抗體樣品較為穩定的處理環境,以上對比試驗未采用pH低于6.0的樣品緩沖液。
以mAb C為例,經不同烷基化試劑(IAM、NEM)和兩個pH(6.0、9.0)的樣品緩沖液處理后的電泳圖譜如圖2。在pH 6.0、IAM的單抗前處理條件下,抗體片段LC、HH、HHL的含量明顯低于pH 9.0、IAM的前處理條件;在pH 6.0、NEM的單抗前處理條件下,抗體片段LC、HH、HHL的含量明顯低于pH 9.0、NEM的前處理條件。說明采用pH 6.0樣品處理液前處理條件更能客觀準確地檢測抗體藥物純度;而在相同pH條件下,IAM和NEM兩種封閉試劑在抗體純度檢測中的結果相近,NEM處理的樣品純度略高于IAM,因此后續試驗以NEM為例進行考察。
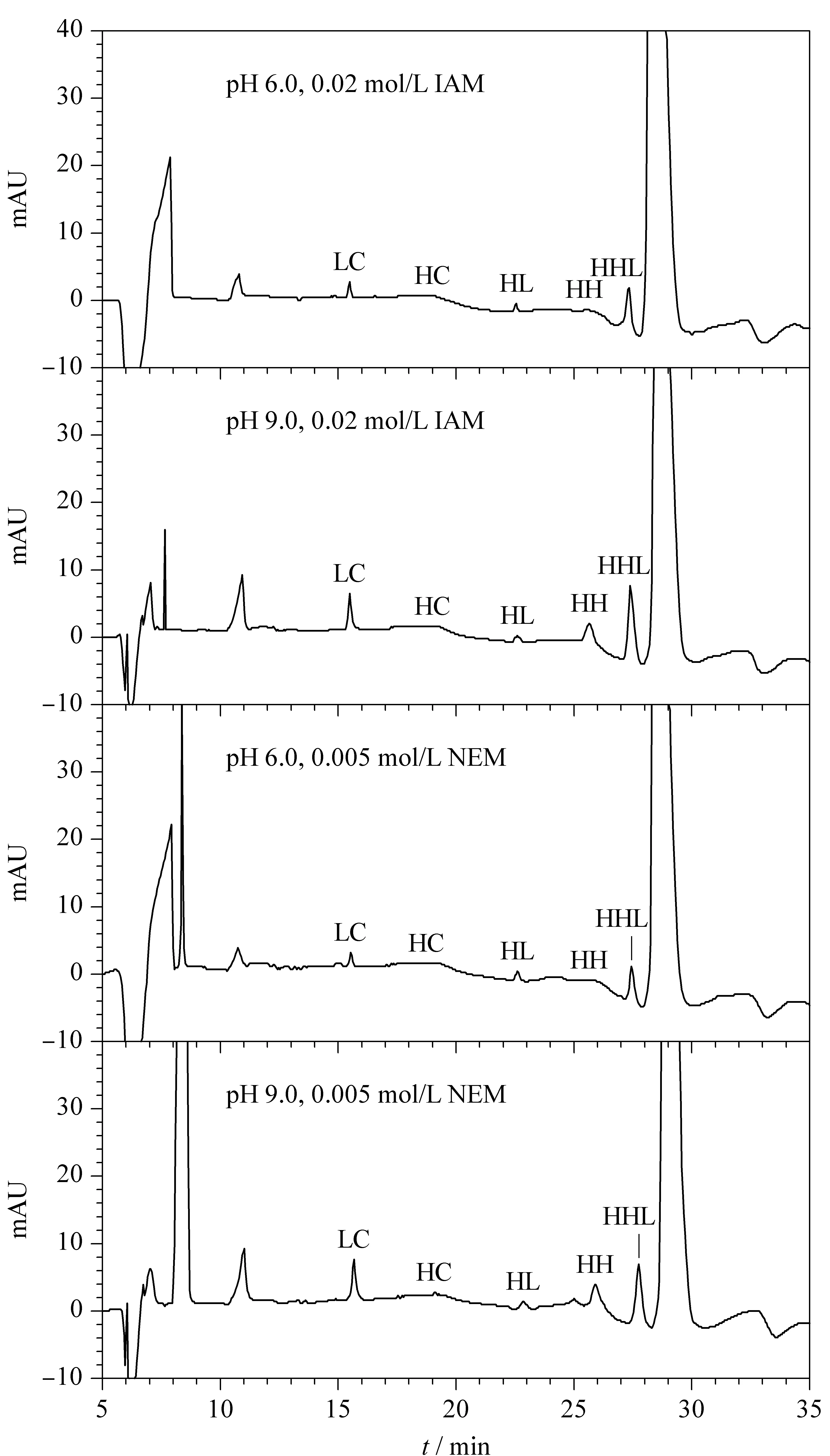
圖 2 不同樣品緩沖液進行非還原mAb C處理的CE-SDS電泳圖Fig. 2 Electropherogram of non-reduced CE-SDS formAb via different sample preparationSample: mAb C; CE-SDS conditions: capillary, 20/30 cm effective/total length, inner diameter 50 μm; capillary temperature, 25 ℃; sample storage temperature, 25 ℃; injection, -10 kV, 20 s; separation voltage, -15 kV; separation time, 35 min; detector, PDA 220 nm.
為了證實該pH影響純度的變化趨勢適用于大部分單抗樣品,我們又使用了16個批次的7種單抗樣品,考察了在pH 6.0和pH 9.0兩個樣品緩沖液條件下的純度。結果與預期的一致,對于考察的所有單抗樣品,pH 6.0的樣品緩沖液兼具了屏蔽游離巰基和保護蛋白質穩定性的作用,均為最佳樣品緩沖液條件,提供單抗產品最真實客觀的純度質量結果。例如,對于兩個批次的mAb 7樣品,pH 6.0樣品緩沖液條件下主峰校正峰面積百分比的平均值比pH 9.0條件下高了4.45%(見表1);對于不同的樣品而言,由于游離半胱氨酸殘基的數量不同,在不同pH條件下的主峰純度差值不同[13]。為了驗證采用pH 6.0樣品緩沖液進行前處理時方法的可靠性,以mAb 1和mAb 6為例,進行了pH 6.0和pH 9.0樣品緩沖液條件下的精密度測試,RSD均在1%以下(0.08%~0.24%)。非還原CE-SDS的結果再次證明,高pH的樣品處理液會導致抗體產生較多的降解片段,進而產生不能反映產品實際質量情況的純度結果。由于巰基封閉試劑的作用是盡最大可能防止抗體在前處理過程中產生降解,因此在下面的工作中我們對不同pH樣品處理液影響巰基封閉試劑封閉游離巰基作用能力的機理進行了探討。

表 1 16個批次的7種單抗樣品的非還原CE-SDS純度分析結果
2.2 pH影響IAM封閉能力的機理探討
IAM在堿性條件下會發生親核取代反應脫碘形成羥基(見圖3),羥基在堿性作用下會解離一個質子,形成帶一個電子的負電荷結構。由此可見,堿性樣品緩沖液會使IAM發生親核取代反應從而影響IAM對巰基的封閉效果。如果用IAM進行巰基封閉,就此反應而言,不適合使用堿性樣品緩沖液。
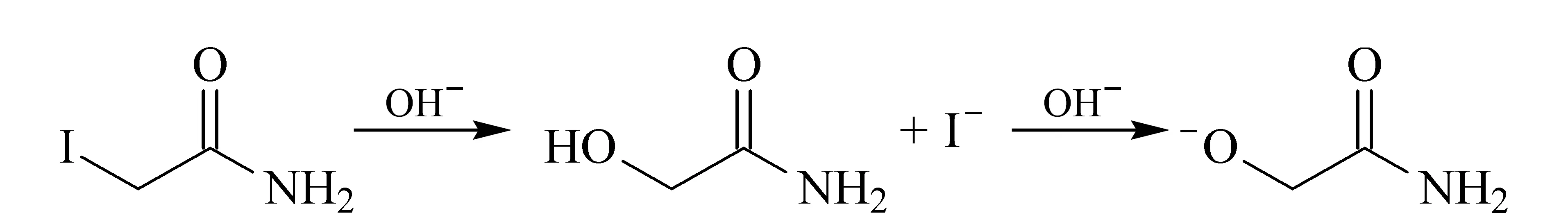
圖 3 IAM在堿性條件下的親核取代反應Fig. 3 Nucleophilic substitution reaction of IAMunder alkaline condition
2.3 pH影響NEM封閉能力的機理探討
NEM封閉巰基的最佳pH是6.0~7.0,在該pH下NEM既能保持巰基的親核活性,又能降低與氨基的副反應。當pH>7.0時,NEM與氨基的反應活性高于巰基,故pH>7.0時大部分NEM被氨基消耗掉,不能起到預期封閉巰基的效果,且產生副產物。在pH<6.0時,NEM也可以用于游離巰基的封閉,只是反應活性稍低。
由圖2電泳圖可知:用NEM封閉劑處理樣品后的電泳圖在8 min左右有個特征峰(IAM作為封閉劑時無此峰)。且使用pH 9.0的樣品緩沖液時該特征峰明顯高于使用pH 6.0的樣品緩沖液時。推測可能發生了如圖4所示的水解反應。NEM在堿性條件下發生開環反應,最終形成帶上一個負電荷的水解產物hNEM,其可隨電動進樣進入毛細管中被檢測到。酸性條件下不會發生該反應。而NEM本身不帶電荷不會被檢測到。因此推斷,NEM發生的開環反應,影響其封閉效果,所以應用NEM封閉游離巰基時,應在pH<7.0的條件下進行。
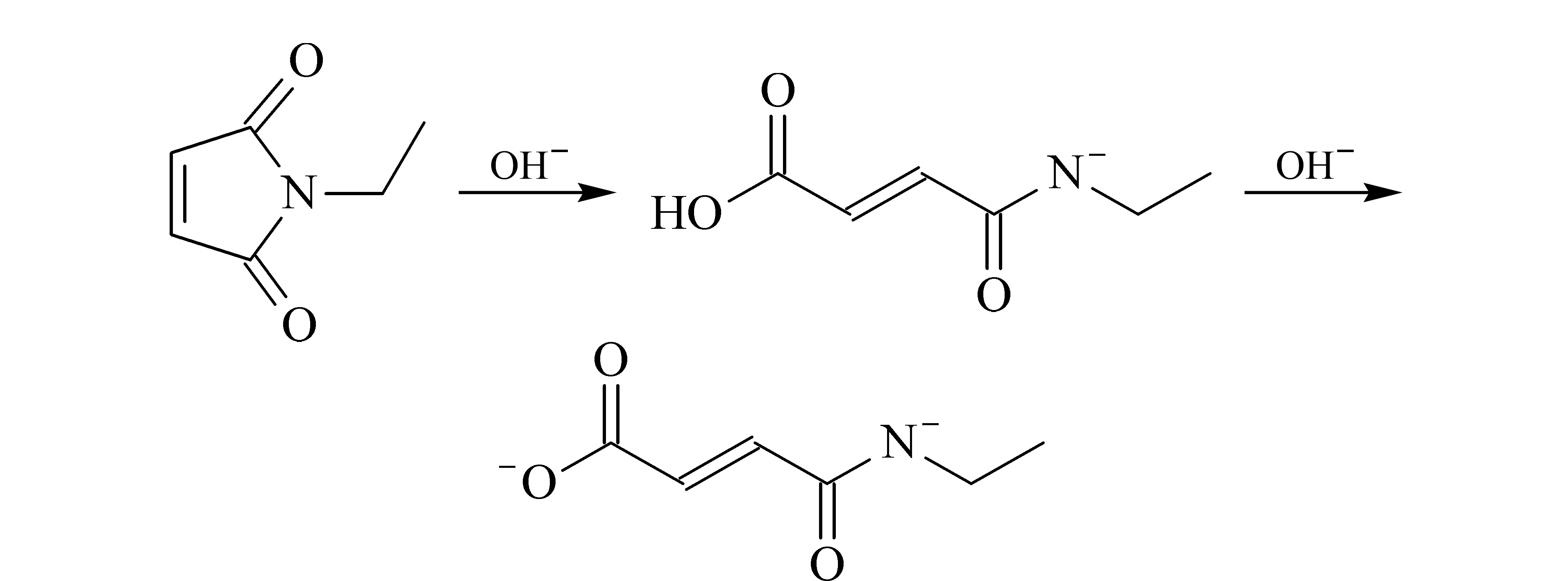
圖 4 NEM的水解反應Fig. 4 Hydrolysis of NEM
經以上分析,IAM和NEM在pH 9.0的樣品緩沖液條件下均出現明顯的降解,失去封閉游離巰基的作用,進而易產生游離巰基介導的鏈間二硫鍵斷裂,導致樣品處理過程中發生降解。
3 結論
通過上述實驗及結果分析,我們發現在非還原單抗的CE-SDS純度分析中,樣品緩沖液的pH會顯著影響純度的分析結果,隨pH增高純度有降低的趨勢。pH 9.0時純度分析結果低于pH 6.0時,主峰純度相差可達6.5%之多。通過封閉試劑的機理研究得出結論:在pH較高的樣品緩沖液中,兩種常用的封閉劑IAM和NEM均出現明顯的降解,降低了封閉游離巰基的作用,易產生游離巰基介導的鏈間二硫鍵斷裂,導致樣品處理過程中發生非預期降解而產生額外的碎片。該降解現象在pH 6.0的樣品緩沖液中明顯好轉。因此,為客觀、準確評價單抗產品的質量及質量變化情況,非還原單抗的CE-SDS純度分析應采用pH 6.0的樣品緩沖液。

