LDL與Raw264.7細胞中腎素-血管緊張素系統表達
劉南 章程 武舒佳 武軍駐(通訊作者)
(武漢大學基礎醫學院生物化學及分子生物學系 湖北 武漢 430071)
動脈粥樣硬化(Atherosclerosis,AS)是心血管系統中最常見的,威脅我國人民健康的慢性疾病[1],在發達國家其發病率和死亡率也很高[2]。AS是受損動脈的病變是從內膜開始的。LDL參與了AS的病變過程,LDL的氧化在慢性炎癥反應中起著極其重要的作用[3-5]。血管緊張素(Angiotensin,Ang)是腎素-血管緊張素系統(RAS)中的多肽,可使血管收縮,進而導致血壓升高。至今為止,4種血管緊張素肽(AngI、AngII、AngIII和AngIV)和四種血管緊張素受體(AT1、AT2、AT3和AT4)已經被鑒定[6]。無活性的AngI通過血管緊張素轉換酶(ACE)轉化為AngII。AngII代謝為AngIII,而后通過兩種氨肽酶轉化為AngIV。AngII和AngIII是AT1和AT2受體的完全激動劑。AngII是最有效的效應因子,通過調節血容量,血壓,外周血管張力,在維持心血管系統的穩態中起重要作用[7-8]。但AngⅡ與LDL氧化之間的相互作用關系尚不清楚,本研究旨在探究LDL氧化過程中對腎素-血管緊張素系統的影響,為研究AngⅡ與LDL氧化之間的相互作用關系提供一定的依據。
1.材料與方法
1.1 主要試劑
實驗室保存有Raw264.7巨噬細胞,LDL購自ProSpec-Tany公司。AT2R抗體來源于Abcam公司,GAPDH抗體來源于美國EarthOx公司。小鼠血管緊張素轉化酶(ACE)試劑盒、小鼠血管緊張素Ⅱ(AngⅡ)試劑盒購自上海仁捷生物科技有限公司。
1.2 細胞培養
小鼠RAW264.7細胞培養在含1%青霉素-鏈霉素,10%胎牛血清,90%DMEM的完全培養基中,置于5% CO2,90% 濕度,37℃的恒溫培養箱中培養。
1.3 LDL處理
Raw264.7細胞達到80%-90%細胞密度時,換成無血清和雙抗的DMEM培養基中同步化過夜,加入LDL(終濃度100μg/ml,含終濃度1μM的Cu2+),在培養箱中孵育不同的時間。用RIPA裂解液裂解細胞,離心取上清。
1.4 小鼠血管緊張素轉化酶(ACE)試劑盒測定
ACE的活性 收集LDL刺激的細胞裂解后的上清,設置標準品孔和樣本孔,分別加入對應的標準品和樣品,空白孔不加;每孔加入檢測抗體-HRP,空白孔除外;37℃孵育60min。洗滌液清洗5遍,每孔加入底物A和B,37℃避光孵育15min。每孔加入終止液,15min 內,在450nm 波長處測OD值。以測得標準品的OD值和濃度值繪制標準曲線,得到直線回歸方程,將ACE的OD值代入方程,計算出ACE的活性。
1.5 小鼠血管緊張素Ⅱ(AngⅡ)試劑盒測定AngⅡ的表達
收集LDL刺激的細胞裂解后的上清,設置標準品孔和樣本孔,分別加入對應的標準品和樣品,空白孔不加;每孔加入檢測抗體-HRP,空白孔除外;37℃孵育60min。洗滌液清洗5遍,每孔加入底物A和B,37℃避光孵育15min。每孔加入終止液,15min 內,在450nm 波長處測OD值。以測得標準品的OD值和濃度值繪制標準曲線,得到直線回歸方程,將AngⅡ的OD值代入方程,計算出AngⅡ的含量。
1.6 Real-Time PCR檢測ACE mRNA的表達
提取細胞總RNA,設計β-actin上游引物為5'-CTCCATCCTGGCCTCACTGT-3';下游引物為5'-GCTGTCGCCTTCACCGTTCC-3', 設 計ACE上 游引物為5'-TACAACTCCAGCGCCGAAC-3',下游引物為5'-GCCAGATCGGTTCATACAGC-3';逆轉錄42℃ 2min,37℃ 15min,85℃ 5sec。隨后上機進行Real-Time PCR檢測。結果處理:相對定量 2–ΔΔCt法。ΔCt(對照組)= Ct(對照組目的基因)- Ct(對照組內參基因),ΔCt(實驗組)= Ct(實驗組目的基因)-Ct(實驗組內參基因),ΔΔCt=ΔCt(實驗組)-ΔCt(對照組)。
1.7 Real-Time PCR檢測
AT2R mRNA的表達 提取細胞總RNA,β-actin引物同上;設計AT2R上游引物為5'-ACAGGATAACCCGTGACCAAG-3',下游引物為5'-ACACTGCGGAGCTTCTGTTG-3';逆轉錄42℃ 2min,37℃15min,85℃ 5sec。隨后上機進行Real-Time PCR檢測。結果處理:相對定量 2–ΔΔCt法。
1.8 Western Blot檢測AT2R的表達
將LDL刺激細胞后的裂解上清進行SDS-PAGE,180mA橫流轉膜2h,脫脂牛奶封閉2h,一抗4℃搖床孵育過夜。TBST洗滌3次,每次15min。二抗室溫孵育2h后,TBST洗滌3次,每次10min。加ECL顯影,隨后用軟件掃描灰度值分析條帶。
1.9 統計學分析
用SPSS軟件分析數據,計量資料用均數±標準差表示,運用Graphpad Prism5作圖,用t檢驗P<0.05為差異有統計學意義。
2.結果
2.1 LDL刺激使ACE活性升高
LDL處理Raw264.7 0、5、10、15min,用ACE試劑盒測定ACE的活性變化:與對照組相比,酶的活性在刺激后5min(1.3667±0.1457,P<0.05)、15min(1.3767±0.1401,P<0.05)增高(圖1)。

圖1.LDL刺激Raw264.7細胞0、5、10、15min后ACE的活性變化n>3,*P<0.05
2.2 LDL刺激使AngⅡ表達升高
LDL處理Raw264.7 0、1、3、5、7、9、12h,試劑盒測定AngⅡ的表達:與對照組(797.6±12.46),相比,刺激后AngⅡ1h(952.5±21.28,P<0.05)、7h(969.63±20.82,P<0.05)表達升高(圖2)。

圖2 LDL刺激細胞0、1、3、5、7、9、12h后AngⅡ的表達變化n>3,*P<0.05
2.3 LDL刺激Raw264.7細胞后檢測ACE mRNA的表達
LDL處理Raw264.7細胞0、1、3、5h:與對照組相比,刺激后3h ACE mRNA的表達升高(1.2533±0.1405,P<0.05),5h下降(0.7000±0.1100,P<0.05)(圖3)。

圖3.LDL刺激細胞0、1、3、5h后ACE mRNA的表達變化n>3,*P<0.05
2.4 LDL刺激Raw264.7細胞后檢測AT2R mRNA的表達
LDL刺激Raw264.7細胞0、1、3、5h:與對照組相比,刺激1h(2.805±1.006,P<0.05)、5h(3.6700±1.0934,P<0.05)后AT2 mRNA表達升高(圖4)。
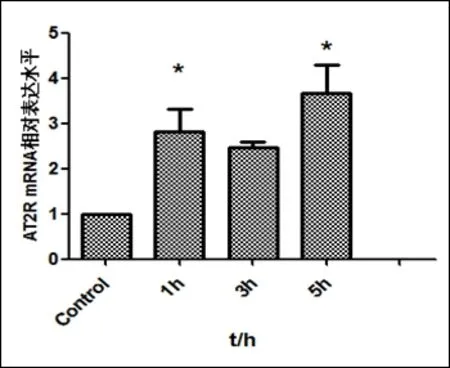
圖4.LDL刺激細胞0、1、3、5h后AT2RmRNA的表達變化n>3,*P<0.05
2.5 Western Blot檢測AT2R的表達
LDL刺激Raw264.7細胞0、1、3、5h后,檢測AT2R的表達:AT2R蛋白表達升高,3h(2.5967±0.7253,P<0.05)、5h(2.5933±0.6886,P<0.05)升高約2.6倍(圖5)。

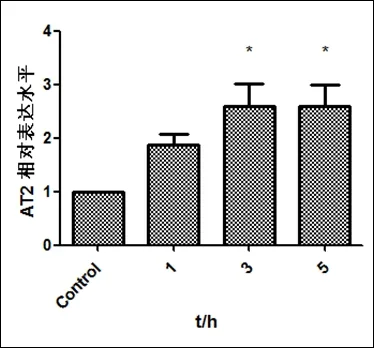
圖5.LDL刺激細胞0、1、3、5h后AT2R的表達變化n>3,*P<0.05
3.討論
研究表明,AngⅡ參與了AS的病理生理過程,血管緊張素II誘導的高血壓會加重ApoE-小鼠中AS的發展[9]。LDL的氧化過程是一個多因子參與的過程,早期的研究已經表明人體注射血管緊張素Ⅱ(AngiotensinⅡ,AngⅡ)后血壓的升高與血清 LDL 水平密切相關。近期研究發現AngⅡ會促進LDL聚集[10]。因此AngⅡ和LDL之間應該存在相互作用。
在本實驗中,在LDL刺激5-15min內ACE的活性提高,從而使AngⅡ的含量在1h后也升高,因此LDL可以促進AngⅡ的表達;并且ACE mRNA、AT2 mRNA與蛋白表達都升高,說明LDL能激活RAS。因此天然LDL粘附于細胞被氧化成oLDL的過程中,血管緊張素轉移酶(ACE)被激活,使AngⅡ表達升高,進一步LDL促進了ACE mRNA和AT2受體的表達,說明LDL激活了腎素-血管緊張素系統。
我們推測天然LDL氧化過程中,AngⅡ可能作為識別標簽,通過識別受體AT1、AT2,介導細胞對LDL的氧化。本實驗可作為AngⅡ與LDL相互作用的部分依據,后面會繼續研究AngⅡ作用于LDL的方式,檢測AngⅡ與LDL的相互作用方式,探究LDL氧化的分子機制。

