硝化抑制劑對酸性紅壤硝化作用及氨氧化微生物豐度和群落結構的影響
黃 瓊,王 慶,吳啟華,李 爽,黃 瑩,陳迪文,江 永
(1廣東省生物工程研究所(廣州甘蔗糖業研究所) 廣東省甘蔗遺傳改良與生物煉制重點實驗室,廣東廣州510316;2國家糖業質量監督檢測中心,廣東廣州510316)
0 引言
硝化過程是指在有氧條件下由硝化微生物參與將 NH3氧化生成 NH2OH和 NO2-,然后氧化生成NO3-的過程。氨氧化過程是硝化過程的限速步驟,它是指在 amoA基因編碼的氨單加氧酶(Ammonia monooxygenase,AMO)的催化下由氨氧化微生物(AOA和AOB)將NH3轉化成NO2-的過程[1]。氨氧化細菌(AOB)大都屬于 β-或者 γ-變形菌綱,而氨氧化古菌(AOA)則屬于奇古菌門[2]。N2O是硝化過程的副產物,它的溫室效應大約是CO2的300倍,引發全球變暖,它同時也是一種能破壞大氣臭氧層的重要的痕量氣體[3]。硝化過程不僅影響土壤氮素供應以及植物的吸收利用,而且過量施用氮肥還會導致土壤酸化,硝化過程產生的NO3-通過地下水滲透以及地表徑流能夠污染水源,危害人類健康。據報道,到 2030年為止,農業生產中氮肥的使用將會增加35%~60%[4]。因此,人們迫切需要探明土壤硝化過程作用機理并尋求一種有效的減排措施用于減少氮肥使用帶來的環境問題以及經濟損失。
在農業生產過程中,氮肥中添加硝化抑制劑可減緩銨態氮在土壤中的氧化過程,對于提高氮肥利用率,降低環境污染風險具有重要的意義。大量研究顯示,硝化抑制劑不僅可顯著降低土壤硝化作用速率和硝態氮累積,減少土壤中硝態氮的淋溶損失,而且可減少N2O等溫室氣體的釋放[5-6]。目前常用的硝化抑制劑有雙氰胺(DCD)和乙炔(C2H2)等。DCD是一種銅離子螯合劑,它能有效地結合氨單加氧酶(AMO)從而使其失去活性。但是它的抑制效果受多種因素的影響如土壤類型[7]、溫度[8]和水分等[9]。C2H2被稱為“自殺性”底物,在低濃度(10 Pa)時就可通過與NH3競爭性的與AMO相結合來抑制自養硝化作用[10]。已有報道發現在酸性土壤中C2H2對硝化作用的抑制效果非常明顯[11],但是它在不同類型土壤中的作用是否保持高效仍舊少有報道。此外,土壤類型和 pH是影響氨氧化微生物分布的重要因素[12]。Jia和Shen研究發現在中堿性土壤中AOB對硝化過程起主導作用,乙炔顯著抑制了 AOB的活性[13-14]。Gubry-Rangin和Zhang研究發現在酸性紅壤中AOA是硝化過程的主要參與者,DCD和C2H2處理抑制了AOA的生長,土壤類型可能是影響硝化抑制劑作用效果的關鍵因素[15]。
本研究選取南方典型旱地土壤(紅壤)開展為期28天的室內培養實驗。運用定量PCR技術和末端限制性片段多態性(T-RFLP)分析技術研究氨氧化微生物群落豐度和群落結構,結合培養過程中硝化速率變化,比較不同硝化抑制劑(DCD和C2H2)對酸性土壤硝化過程的作用機制。
1 材料與方法
1.1 土壤樣品
微宇宙室內培養實驗選取了湖南祁陽地區(26?24?26? N,112?00?45? E)典型酸性旱地土壤(紅壤),該地區為亞熱帶濕潤季風性氣候,年平均降雨量為1288 mm,年平均溫度18.1℃。在每個地點,分別在土壤表層(0~15 cm)采集10個土樣,混合后過2 mm篩,并保存于4℃冰箱以備微宇宙培養實驗用。另外部分樣品在實驗室風干后用于土壤理化性質測定。
1.2 土壤基本理化性質測定
土壤pH值(土壤和水的比值為1:2.5)使用Detla 320 pH 儀(Mettler-Tolede Instruments Co.,Shanghai,China)測定。土壤總氮(TN)和總碳(TC)采用杜馬斯燃燒法利用元素分析儀(Vario EL III,Elementar,Hanau,Germany)測定。土壤銨氮(NH4+-N)和硝氮(NO3--N)濃度采用2 mol/L KCl溶液浸提并利用連續流動分析儀測定(AA3,SEAL analytical)。土壤有機碳(Soil organic carbon,SOC)含量采用低溫外熱重鉻酸鉀氧化比色法進行測定。土壤質地采用快速篩分法進行測定。紅壤的基本性質:pH:6.2;SOC含量:22.4 g/kg;TN含量:1.51 g/kg;NH4+-N含量:3.0 mg/kg;NO3--N含量:27.8 mg/kg;土壤質地:砂粒4.3%,粉粒53.2%,粘粒42.5%。
1.3 試驗設計
培養實驗中,稱取相當于20 g干土重的土壤樣品至120 mL玻璃血清瓶中。向土壤中添加適量的滅菌去離子水,使土壤含水量達到40% WFPS,放置于25℃培養箱中黑暗培養7天。本實驗設置如下4個處理:對照(Control);(NH4)2SO4(NH4+);(NH4)2SO4+DCD (NH4++DCD);(NH4)2SO4+C2H2(NH4++C2H2),其中硫酸銨的施用量是150 mg/kg,DCD的施用量為銨氮施用量的 10%,C2H2的添加量是0.1%(v/v)。每個處理設置3個重復。在進行正式培養時,將處理所需的硫酸銨和DCD溶解于滅菌去離子水中并均勻滴加于土壤表面,最后補充水分使土壤含水量達到55% WFPS。對于乙炔處理的樣品,首先我們把所需要的硫酸銨溶于滅菌去離子水中,然后調節土壤水分使之達到55% WFPS,最后蓋上膠塞密封好后加入低濃度的乙炔(0.1% v/v),并在30℃培養箱中黑暗培養28天。在培養過程中每隔2~3天打開瓶塞通氣20 min,然后補充水分和乙炔。在培養開始后的0、7、14、28天進行土壤破壞性采樣。大約10 g土壤用于NH4+-N和NO3--N的浸提與分析。剩余土樣用于土壤 DNA提取和后續分子實驗。
根據Persson和Wiren(1995)提出的用于計算凈硝化速率的方程[16]。我們計算了前7天、14天和整個28天的土壤凈硝化速率。
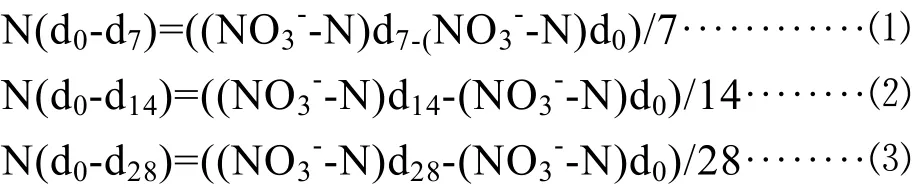
注:(NO3--N)d0,(NO3--N)d7,(NO3--N)d14和(NO3--N)d28分別是第0、7、14和28天土壤NO3--N的濃度。
1.4 土壤DNA提取和定量PCR分析
使用 MoBio PowersoilTMDNA提取試劑盒(MoBio Laboratories Inc,Carlsbad,CA)對 DNA 進行提取,每個樣品稱取0.4 g土壤。DNA的濃度和純度采用 Nanodrop ND-1000 (NanoDrop Technologies,Wilmington,DE,USA)測定。DNA樣品保存在-80℃備用。
定量PCR在Bio-Rad CFX96 optical定量PCR儀(Bio-Rad,USA)上進行,數據由軟件Bio-Rad IQ5 V2.0 進行分析。所有樣品都做了 3個重復。AOA定量 PCR引物為 CrenamoA23f/CrenamoA616r[17],AOB的定量PCR引物為amoA-1F/amoA-2R[15]。反應體系為 25 μL,包含 12.5 μL SYBR Premix Ex Taq(TaKaRa Biotechnology,Otsu,Shiga,Japan),0.5 μL 的前后引物(10 μM),2 μL 5 倍稀釋的 DNA模板(1~10 ng)。PCR反應條件為:94℃預變性 5 min,95℃變性 30 s,55℃(AOA)和 57℃(AOB)退火30 s,72℃延伸1 min;83℃收集數據15 s。每輪定量PCR擴增完成后通過溶解曲線和瓊脂糖凝膠電泳檢測擴增產物的特異性。
1.5 末端限制性片段多態性分析(T-RFLP)
AOA和AOB的群落結構T-RFLP技術進行分析,所用引物分別為 CrenamoA23f(FAM-labelled)/CrenamoA616r和amoA-1F(FAM-labelled)/amoA-2R。反應體系(50 μL)包括:25 μL 2× Premix Taq,2 μL 5倍稀釋的DNA模板(1~10 ng),正反向引物各1μL,最后加滅菌去離子水補足至 50 μL。對于 AOA和AOB,PCR擴增程序為95℃ 5 min,95℃ 40 s,55℃ 30 s,72℃ 1 min,最后再72℃延伸8 min。每個基因的 PCR產物通過 Wizard SV Gel and PCR Clean-Up System(Promega,SanLuis Obispo,CA,USA)純化回收,然后采用限制性內切酶進行酶切。AOA amoA基因 PCR產物采用 HpyCH4Ⅴ酶切,AOB amoA基因采用RsaⅠ酶切。酶切體系為20 μL,大約包括200 ng PCR產物、10 U的限制性內切酶、0.2 μL 的 BSA 和 2 μL 10×NEB buffer。酶切體系在37℃條件酶切1 h,65℃使內切酶失活,然后送至測序公司測序。獲得的數據使用Peak Scan 2.0(Applied Biosystems,Inc)軟件進行 T-RFLP圖譜分析,所選的片段限于50~600 bp之間。每個樣品中低于最高峰高值2%的峰從后續分析中剔除,片段長度差異小于2 bp的2個峰合并為1個峰進行分析。
1.6 統計分析
AOA和AOB amoA基因的豐度轉化成對數進行后續分析。不同處理之間 amoA基因拷貝數和凈硝化速率的差異顯著性通過單因素方差分析(ANOVA)進行檢驗。所有統計分析使用 SPSS 19.0軟件(IBM Co,Armonk,NY,USA)實現。Spearman相關分析用于分析amoA基因拷貝數和NO3--N濃度之前的關系。P<0.05表示他們之間相關性極顯著。不同處理之間微生物群落結構的差異通過計算基于不同TRFs相對豐度的Bray-Curtis相似性指數進行表示,然后利用主坐標分析(PCoA)對樣品之間的Bray-Curtis相似性指數進行可視化分析。
2 結果分析
2.1 NH4+-N和NO3--N以及凈硝化速率的動態變化
在紅壤中,對照處理的土壤 NH4+-N濃度在整個培養過程中保持在很低的水平,并且大約維持在3 mg/kg保持不變(圖 1A)。硫酸銨處理的土壤NH4+-N濃度隨著培養時間的延長而降低。NH4+-N的濃度在第7天時從147.5 mg/kg (m氮/m土壤)降低至102.6 mg/kg (m氮/m土壤),并且NH4+-N的濃度在培養結束時(28天)降低至最低水平。硝化抑制劑DCD和C2H2處理顯著地抑制NH4+-N的降低,但是這2種硝化抑制劑的抑制效果存在明顯差異。乙炔處理土壤的 NH4+-N濃度沒有減少,由于土壤礦化產生的氨源源不斷地釋放出來,反而增加了土壤 NH4+-N的濃度,而DCD的添加顯著地減緩了NH4+-N的消耗速度。
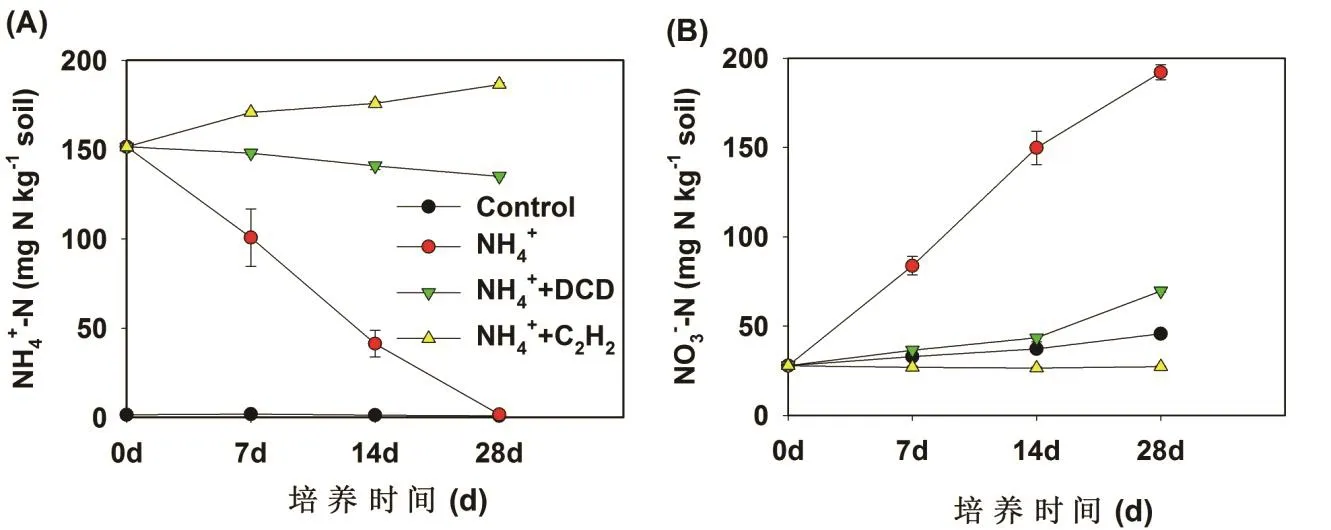
圖1 紅壤(A,B)中銨氮和硝氮在不同處理中的動態變化
在紅壤中,對照處理下NO3--N的濃度隨著培養時間的進行而逐步的增加,這是由于有機氮礦化產生的NH3被氧化成NO3--N(圖1B)。硫酸銨的添加顯著地增加了NO3--N的濃度,并且NO3--N的增加與NH4+-N的降低同時發生,處于此消彼長的動態變化過程。硝化抑制劑的添加明顯地抑制了NO3--N的生成,C2H2和DCD處理的NO3--N含量變化有所差異,C2H2處理完全阻止了NO3--N的增加,而DCD處理
減緩了NO3--N的增加。硫酸銨添加處理的凈硝化速率在第7天時達到9.16 mg/kg/d,DCD處理的土壤硝化速率大約是1.53 mg/kg/d,DCD的抑制效率大概在83.30%(表1)。在整個培養過程中,DCD的抑制率大約是 72.70%。C2H2處理完全抑制了硝化過程,抑制率達到100%。因此,相對DCD來說,C2H2是一種抑制作用更強的硝化抑制劑。
2.2 AOA和AOB amoA基因豐度的變化
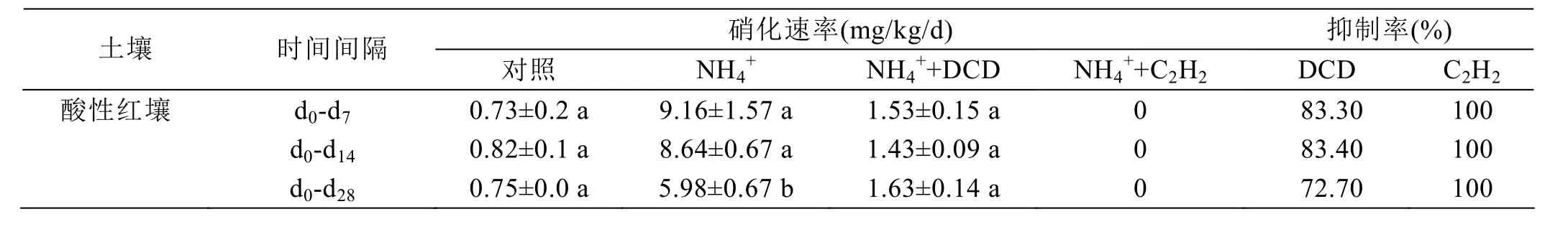
表1 紅壤中硝化抑制劑對硝化活性的抑制效果
本文分別以培養第0、7和28天的土壤樣品作為研究對象,測定氨氧化微生物功能基因的豐度,比較了不同培養時間和不同處理中 AOB和 AOA amoA基因豐度變化(圖2)。培養初期添加硫酸銨處理的 AOB amoA基因豐度顯著高于對照處理(P<0.01),但是硝化抑制劑C2H2與DCD的添加均顯著降低了AOB amoA基因豐度(P<0.01)。硝化抑制劑處理下AOB amoA基因豐度在整個培養過程中與對照相比沒有明顯差異(圖2A)。
AOA amoA基因豐度均高于AOB amoA基因豐度。對照處理中AOA可以利用土壤有機氮礦化產生的微量的NH3作為底物生長,因此,AOA amoA基因豐度在整個培養過程中逐漸的增加,而硫酸銨的添加顯著地降低了AOA amoA基因豐度。AOA amoA基因豐度在DCD和C2H2處理之間沒有明顯差異(圖2B)。
我們將AOB和AOA amoA基因豐度與NO3--N濃度進行線性回歸分析,結果顯示AOB amoA基因豐度與NO3--N濃度呈極顯著正相關關系(r=0.64,P<0.001)(圖3A)。而AOA amoA基因豐度與NO3--N濃度呈極顯著負相關關系(r=-0.43,P<0.05(圖3B)。結果說明在硫酸銨處理下 AOB是土壤硝化過程發生的主要驅動者。
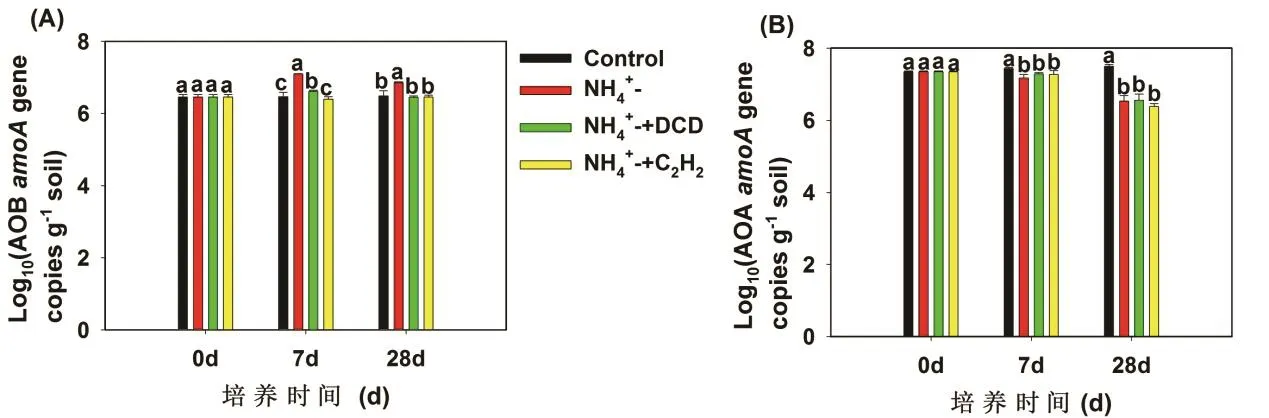
圖2 紅壤中AOA(A)和AOB(B) amoA基因豐度的動態變化
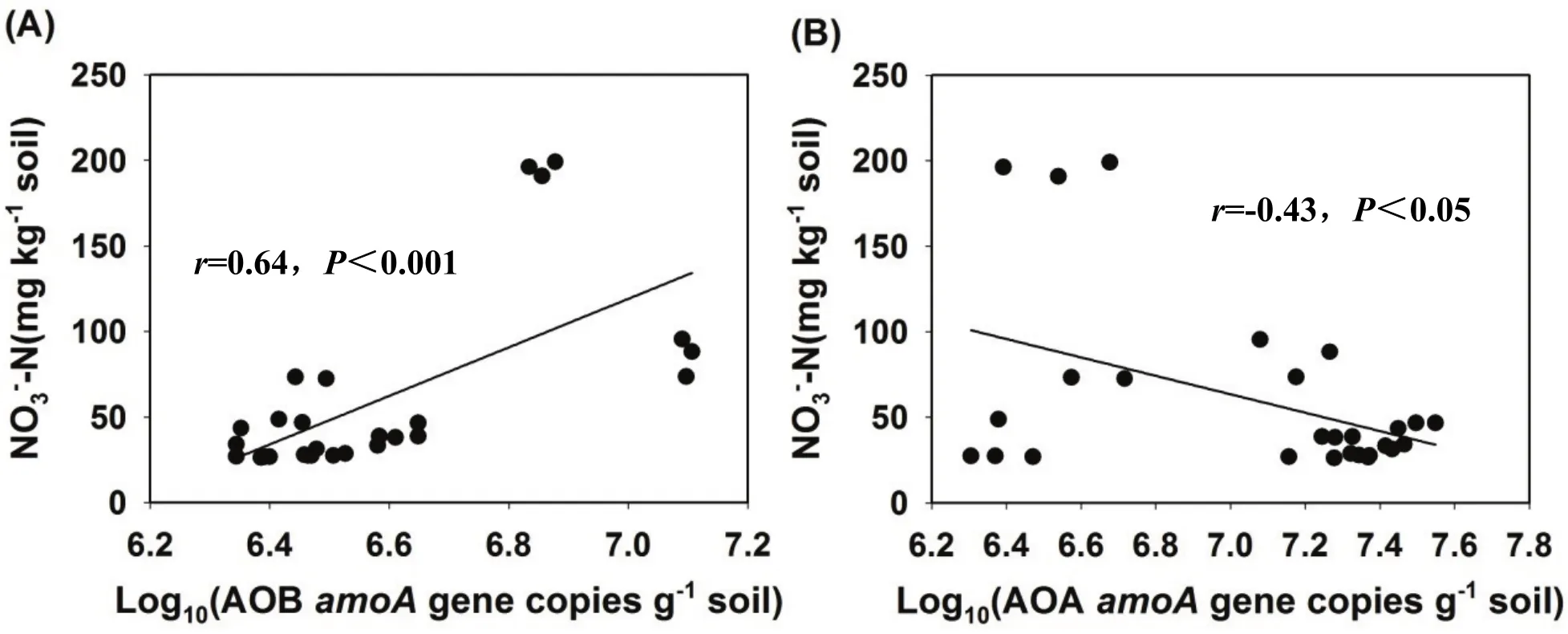
圖3 紅壤(A,B)中NO3-濃度和AOA以及AOB amoA基因豐度之間的關系
2.3 AOB和AOA群落結構分析
在培養結束后,AOB和AOA的群落結構使用T-RFLP手段進行分析(圖4)。在紅壤中,AOB amoA基因的PCR產物采用RsaⅠ限制性內切酶進行酶切分析,分別能夠得到5個不同的TRFs類型(圖4A)。在紅壤中,TRF-211、TRF-251和TRF-255是最主要的片段類型。研究發現不同AOB TRFs對氮肥的影響不同,例如紅壤中TRF-255和TRF-270的相對豐度在是施氮處理中顯著增加,而 TRF-211、TRF-251則顯著降低。基于不同AOB TRFs相對豐度的 Bray-Curtis指數分析發現硫酸銨處理對 AOB群落結構具有明顯影響(圖5A)。而硝化抑制劑處理的土壤 AOB的群落結構與對照處理之間沒有顯著差異。
在 HpyCH4V限制性內切酶的作用下,AOA amoA基因PCR產物被酶切成8個不同的TRFs類型,其中TRF-76、TRF-156和TRF-166是最主要的3個片段類型(圖 4B)。與對照相比,硫酸銨處理的TRF-76、TRF-156和TRF-218片段類型豐度顯著增加,而TRF-90、TRF-166和TRF-204片段類型豐度顯著減少。硝化抑制劑處理的AOA amoA TRFs片段類型的相對豐度與對照處理相比沒有顯著差異,這說明硝化抑制劑施用沒有改變AOA的群落結構。基于不同AOA TRFs相對豐度的Bray-Curtis指數分析發現硫酸銨處理與其他處理中的 AOA群落結構明顯不同(圖5B)。與對照相比,硝化抑制劑處理對土 壤AOA群落結構沒有顯著影響。
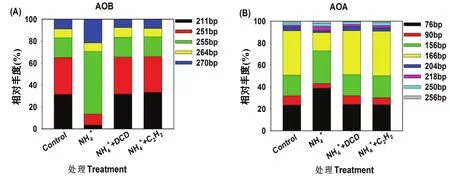
圖4 不同處理下AOB(A)和AOA(B) amoA基因末端限制性片段(T-RF)的相對豐度
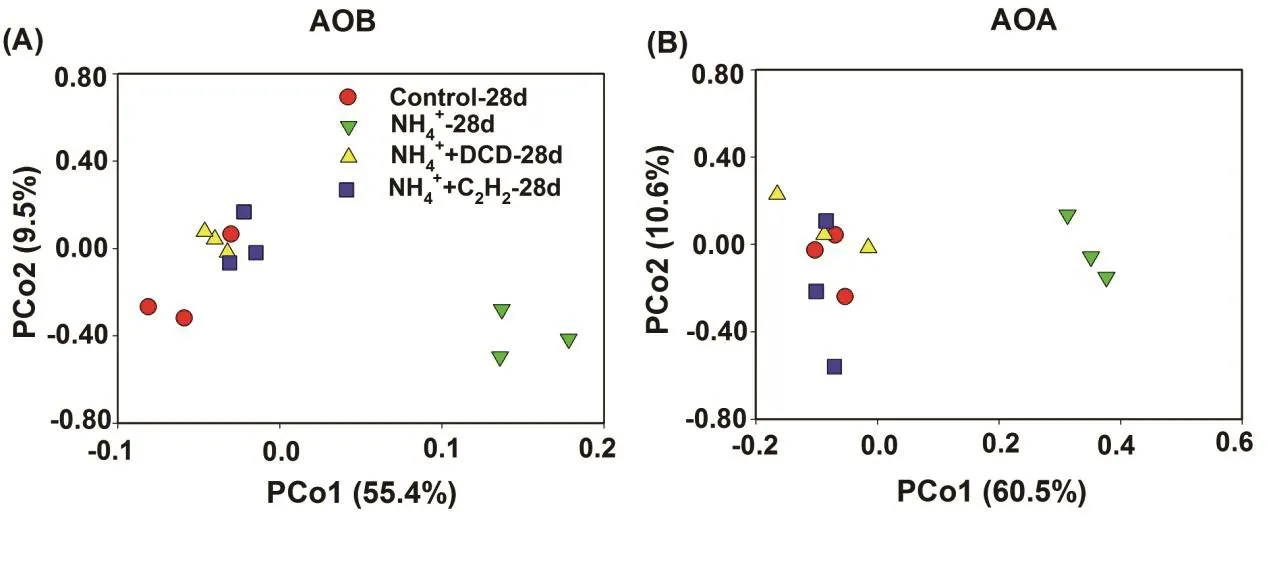
圖5 基于主坐標(PCoA)的氨氧化細菌(A)和古菌(B)群落結構分析
3 討論
3.1 硝化抑制劑DCD和C2H2對酸性土壤硝化速率的影響
NH4+作為硝化作用的第一步氨氧化作用的底物,可通過硝化微生物的作用轉化成NO3-。在選擇研究的紅壤中,硫酸銨處理下 NH4+的減少伴隨著NO3-的增加,這說明土壤發生了硝化反應。硝化抑制劑DCD或C2H2處理有效抑制了NH4+轉化為NO3-的過程,但是這2種硝化抑制劑的抑制效果有所不同。DCD處理部分抑制了硝化反應的進行,NH4+緩慢降低,NO3-逐步升高。而C2H2處理則完全抑制了土壤硝化反應的發生,由于有機氮礦化產生大量的NH3無法被利用,因而累計下來導致NH4+濃度的升高,而NO3-的濃度保持不變,C2H2對硝化過程的抑制效果要顯著強于DCD。這可能歸因于以下幾點原因:首先,C2H2是一種自殺性底物,它能夠和NH3競爭性的與氨氮加氧酶(AMO)相結合,從而達到抑制氨氧化過程的目的。已有報道發現低濃度的乙炔(10 Pa)能夠 100%的抑制自養硝化過程并且持續很長時間[2,20]。其次,DCD極易溶于水以及在土壤剖面中移動性強而易發生與NH4+分離的現象,進而影響其硝化抑制效果[18],而且它可作為氮源被微生物利用,當土壤溫度高于25℃時,極易發生微生物的降解現象[19]。在本研究中,培養溫度設置的是30℃,我們推測DCD的生物降解可能是其低有效性的一個原因[20]。
3.2 硝化抑制劑 DCD和 C2H2對酸性土壤氨氧化微生物豐度的影響
氨氧化過程由AOA和AOB參與完成,而究竟誰在其中扮演更加重要的角色仍舊是討論的焦點,這可能與某種土壤中硝化抑制劑的有效性有關。在本研究的酸性農田土壤中,AOA的豐度要明顯高于AOB的豐度,這與之前的報道相一致[21]。先前的研究表明影響 AOA和 AOB分布的主要因素有 pH、水分、土壤類型以及土壤銨氮含量等。本研究發現施銨氮肥刺激了 AOB而不是 AOA的生長,導致AOB amoA基因豐度增加。Di和Jia指出適合AOB和AOA生長的土壤銨氮濃度不同,AOB生長在高銨氮環境,在營養豐富的中堿性土壤中豐度較高,是硝化作用的主要參與者[9,13];而AOA更加傾向于營養貧瘠的低銨氮與低 pH的環境,它主要利用土壤有機氮礦化釋放的少量的NH3生長,高銨氮環境反而抑制 AOA的活性[22-23]。在本實驗選擇的紅壤中,硫酸銨的施加降低了AOA amoA基因豐度。此外,分析結果顯示 AOB amoA基因豐度與 NO3--N濃度具有極顯著的正相關關系,我們還發現AOA的豐度與NO3--N濃度呈顯著負相關。這表明AOB與硝化作用速率的關系比AOA更緊密,這也與已有研究指出的農田土壤氨氧化作用是由AOB而非AOA主導的觀點一致[13]。此外,C2H2對 AOB豐度的抑制效果要明顯高于DCD,而硝化抑制劑對AOA豐度沒有顯著影響。Shen推測與AOB相比,AOA對硝化抑制劑并不敏感,這是由于它們在細胞結構和代謝途徑上存在明顯的差異[24]。在本研究中,硝化抑制劑通過抑制AOB的生長而抑制硝化過程。本研究初次發現與 DCD相比,C2H2對硝化過程以及AOB的豐度表現出更強的抑制效果。
3.3 硝化抑制劑 DCD和 C2H2對酸性土壤氨氧化微生物群落組成的影響
在本研究中,T-RFLP和PCoA分析發現施氮改變了AOA的群落結構,這一結果表明氮肥濃度可能是影響氨氧化微生物群落結構的重要因素。硝化抑制劑乙炔和DCD的添加并沒有顯著影響AOA的群落組成。Gong研究發現AOA的群落對硝化抑制劑DCD或DMPP響應并不明顯[7]。
T-RFLP和PCoA分析還發現施氮改變了AOB的群落結構。然而,Avrahami則發現在硫酸銨處理下培養4~6周,農田土壤中AOB的群落結構并沒有顯著變化[25]。我們認為導致這一差異的原因是高濃度的銨氮肥能夠刺激AOB的生長從而改變AOB的群落結構[5,13]。但是硝化抑制劑 DCD和 C2H2處理并沒有顯著影響 AOB的群落組成。O’Callaghan同樣也發現草原土壤中 AOB的群落結構對氮肥和硝化抑制劑的處理沒有顯著的響應[26]。已有研究發現硝化抑制劑對 AOB群落的影響與土壤類型有關[7,27]。
4 結論
本研究比較了硝化抑制劑DCD和C2H2對土壤硝化過程以及氨氧化微生物豐度與群落結構的影響。結果發現硫酸銨處理刺激了土壤硝化過程,硝化抑制劑處理顯著抑制了硝化作用并且 C2H2對硝化過程的抑制比DCD更強。本研究還發現AOB的豐度與NO3-濃度呈顯著正相關關系。硫酸銨處理顯著改變AOB和AOA的群落組成。然而,硝化抑制劑處理對氨氧化微生物群落結構沒有影響。這些結果表明AOB是土壤硝化過程的主要參與者,硝化抑制劑通過抑制AOB的生長從而抑制硝化過程。

