呼吸道合胞體病毒感染患兒鼻黏膜拭子樣品微RNA表達
張 偉,王 燕,曾毅文,鄒國濤,羅 勇
(重慶醫科大學附屬永川醫院兒科 402160)
呼吸道合胞體病毒(respiratory syncytial virus,RSV)為包膜負單鏈RNA病毒,RSV感染好發于嬰兒期兒童,大部分患兒呈輕微上呼吸癥狀,而部分患兒將通過宿主免疫應答發展為更嚴重的支氣管炎或肺炎[1]。因此,闡明RSV感染后患兒免疫應答機制對于RSV預防和治療具有重要意義。微RNA(microRNA,miRNA)分子是一種長度為18~25個核苷酸的非編碼小RNA序列,它通過與特異性靶RNA接合抑制信使RNA(mRNA)向蛋白翻譯,實現基因轉錄后水平調節蛋白質表達,進而控制炎性反應和疾病進展[2-3]。近年來,大量研究通過體外培養細胞株和臨床外周血液樣品均證實miRNA能夠調節RSV感染相關的免疫應答[4-5],但針對RSV感染后鼻黏膜上皮脫落細胞的miRNA表達研究較少[6],而事實上RSV優先感染對象為呼吸道黏膜上皮細胞[7]。因此,本研究將以RSV感染陽性患兒鼻黏膜拭子樣品作為研究對象,分析RSV感染患兒鼻黏膜上皮脫落細胞miRNA表達譜,并進一步分析miRNA差異表達與RSV感染導致的疾病嚴重程度間的關系。
1 資料與方法
1.1一般資料 選取2017年9月至2018年2月RSV感染季來本院兒科門診就診兒童。試驗組納入標準:年齡6~12個月,初次就診,臨床表現咳嗽、氣促和喘息;體格檢測顯示心率、呼吸頻率加快,肺部聽診出現哮鳴音或濕羅音;間接免疫熒光試劑盒檢測鼻黏膜拭子樣品呼吸道RSV抗原陽性;其中,將胸部X線片提示支氣管炎或支氣管肺炎的RSV感染陽性患兒作為RSV感染重度組,無影像學特征的作為RSV感染輕度組。對照組納入標準:相同時間段來本院進行兒保的健康兒童,年齡6~12個月,體溫和發育正常,無既往RSV感染史和哮喘史,呼吸音清晰,RSV抗原陰性。排除標準:妊娠期小于34周;支氣管/肺發育不良;慢性肺疾病;唐氏綜合征;神經系統疾病;其他可能導致嚴重免疫反應的疾病類型。本研究經本院倫理委員會批準后實施,入選患兒和對照組兒童均告知監護人并簽署知情同意書。研究共納入26例RSV陽性患兒作為試驗組(其中17例為輕度,9例為重度),12例健康兒童作為對照組。試驗組和對照組之間、RSV重度組和RSV輕度組之間在性別、年齡、身高、體質量,差異均無統計學意義(P>0.05),RSV重度組和RSV輕度組病程周期差異也無統計學意義(P>0.05)。
1.2方法
1.2.1采樣 移除呼吸道分泌物后,將專用Miraclean鼻咽植絨拭子(深圳市麥瑞科林科技有限公司)插入兩側鼻腔中旋轉3~5圈采集鼻黏膜上皮細胞。隨后將拭子放入RNA穩定試劑中,沖洗拭子使上皮細胞分離,-80 ℃保存待進行miRNA分析。選擇5例對照組兒童和5例試驗組患兒的鼻咽植絨拭子在載玻片上制成細胞涂片,用于細胞學分析。
1.2.2RNA純化分離 將-80 ℃保存的上皮細胞離心后通過TRIpure試劑(BioTeke)裂解上皮細胞,隨后使用氯仿和70%乙醇提取細胞樣品總RNA,使用mirVana TM miRNA Isolation Kit(Ambion,Austin)純化,最后采用NanoDrop 2000(Thermo)對獲得的RNA純度和完整度進行分析。
1.2.3miRNA微陣列芯片分析 選擇2例重度,2例輕度RSV感染陽性患兒鼻黏膜樣品和2例健康兒童樣品進行miRNA微陣列芯片雜交。微陣列芯片使用Agilent Human miRNA芯片(V12.0),覆蓋886種人類相關miRNA。按照試劑盒提供的實驗方案完成標記、雜交反應和清洗后,通過Agilent G2565BA微陣列掃描儀(美國)掃描芯片,并使用Agilent Feature extraction software v8.5對掃描數據進行整理和評價芯片的雜交質量。每個miRNA探針的信號強度采用與內參基因信號強度比值表示。
1.2.4qPCR分析 通過miRNA微陣列分析選擇出對照組和試驗組樣品中差異表達的miRNA,并對26例試驗組和12例對照組樣品進行qPCR驗證。將樣品提取的總RNA分別用Ambion mirVanaTM miRNA和mirVanaTM qRT-PCR miRNA 檢測試劑盒進行分離和擴增。采用7900 HT Fast RealTime PCR系統(Applied Biosystems,CA)進行qPCR擴增實驗,所有引物(RT引物和PCR引物)均由Invitrogen(Thermo Fisher Scientific Corp.,CA)公司合成。qPCR反應條件如下:95 ℃ 3 min 變性;95 ℃ 15 s,60 ℃ 30 s循環,共40個循環,每個樣品重復3次。采用ABI Prism SDS2.4 軟件分析,以內源性管家基因U6校準轉錄后表達水平,并采用2-△△Ct方法進行標準化和計算。miRNA微陣列芯片結果通過R語言分析,miRNA的差異表達用倍數變化方法進行評估。以倍數變化大于或等于2視作miRNA表達上調,以倍率變化小于或等于0.5視作miRNA表達下調。miRNA微陣列芯片結果聚類分析使用分層聚類分析。
1.3統計學處理 采用SPSS13.0軟件分析數據,試驗組和對照組之間一般資料學統計采用Mann-Whitney法檢驗。miRNA相對表達水平采用箱圖表示,試驗組和對照組之間、RSV感染重度組和RSV感染輕度組之間miRNA表達差異比較通過完全隨機設計t檢驗。以P<0.05為差異有統計學意義。
2 結 果
2.1一般資料比較 38例樣品總RNA質量和數量均滿足qPCR分析需要。脫落細胞學鏡檢發現5例對照組兒童和5例RSV感染陽性患兒樣品中均含有大量鱗狀和纖毛狀上皮細胞,同時含有部分粒細胞。對照組和試驗組兩組樣品所含細胞類型無明顯差異。
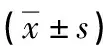
表1 RSV重度組和RSV輕度組患兒miRNA表達差異的qPCR驗證
2.2miRNA微陣列芯片分析結果 2例RSV重度患兒,2例RSV輕度患兒和2例健康兒童miRNA差異化表達熱圖如圖1所示。結果顯示試驗組和對照組中存在24個差異表達miRNA,其中15個miRNA表達上調,9個miRNA表達下調;RSV輕度組患兒和RSV重度組患兒間有8個差異表達miRNA,其中RSV重度組患兒有4個miRNA表達下調,4個miRNA表達上調。表達下調miRNA包括miR-34c、miR-125a、miR-31、miR-130a,表達上調miRNA包括miR-375、miR-205、miR-203a和miR-let-7f。

縱列代表不同分析樣品,橫排代表差異表達探針,紅色代表較高表達水平,藍色代表較低表達水平,白色代表相似表達水平
圖1 RSV感染導致鼻黏膜拭子樣品miRNA差異化表達熱圖
2.3qPCR驗證結果 24個差異表達miRNA qPCR驗證結果如圖2所示。結果顯示,與對照組比較,miR-320d、miR-34b、miR-125a和miR-429表達顯著下調,miR-155、miR-203a和miR-106b表達顯著上調;RSV輕度組患兒和RSV重度組患兒間差異表達的8個miRNAs的qPCR驗證結果如表1所示。結果顯示RSV重度組患兒miR-125a表達較RSV輕度組患兒顯著下調(P<0.05),其余7個miRNA表達水平在兩組間差異無統計學意義(P>0.05)。

圖2 RSV感染患兒鼻黏膜拭子樣品miRNA的qPCR驗證
3 討 論
本研究首先通過miRNA微陣列芯片分析了RSV感染患兒鼻黏膜拭子樣品miRNA表達譜。通過與對照組進行比較,發現24個差異表達miRNA。進一步通過對篩選出的24個miRNA進行qRCR驗證,證實有7個差異表達的miRNA具有統計學意義(P<0.05)。其中miR-320d、miR-34b、miR-125a和miR-429表達顯著下調,而miR-155、miR-203a、miR-106b表達顯著上調。前期研究分析RSV感染患兒外周血miRNA表達譜,顯示RSV感染患兒外周血miR-106b-5p、miR-20b-5p和miR-342-3p表達上調,而 miR-320e、miR-320d,miR-877-5p,miR-122-5p和miR-92b-5p表達下調[5,8];采用鼻黏膜拭子樣品,INCHLEY等[6]發現RSV陽性患兒miR-34b、miR-34c、miR-125b、miR-29c、mir125a、miR-429和miR-27b表達下調,而miR-155,miR-31,miR-203a,miR-16和let-7d表達上調。通過對比發現,本研究能夠驗證部分RSV感染陽性患兒的miRNA表達,但也存在差異,推測其原因可能與分析樣品不同及不同生物學個體間存在miRNA表達高度異質性有關。此外,與INCHLEY等[6]研究不同的是,本研究進一步比較不同疾病嚴重程度患兒的miRNA表達差異,結果顯示miRNA-125a在輕、重度RSV感染陽性患兒間表達水平比較差異有統計學意義。
本研究顯示RSV感染患兒差異表達miRNAs與宿主免疫系統調節密切相關。與對照組相比,miR-320d、miR-34b、miR-125a和miR-429表達下調均超過2倍,提示這些miRNAs表達降低與RSV感染引起的宿主響應密切相關。其中,miR-34b可能與炎癥誘導的呼吸道上皮細胞分化有關。有研究顯示當IL-13和糖皮質激素刺激培養的支氣管上皮細胞時,能夠調控miR-34b,且哮喘患者中支氣管上皮脫落細胞中miR-34b表達下調[9]。在注射脂多糖時,老鼠肺組織中miR-34b表達上調[10];miR-125a已被多個研究證實與免疫系統中多個調控信號通路有關,包括對核因子-κB(NF-κB)信號通路的正向調控[11],抑制趨化因子5(CCL5)產生[12],巨噬細胞激活[13]等。miR-320d在免疫系統報道較少,有研究顯示單純皰疹病毒1(HSV-1)感染能夠下調宿主細胞編碼的miR-320d,miR-320d通過靶向轉錄激活因子(RTA)調控HSV-1誘導的肉瘤相關皰疹病毒(KSHV)下調細胞表達[14];miR-429被證實能夠重新激活B細胞中靜默的EB病毒[15]。INCHLEY等[6]報道RSV感染患兒miR-429表達下調。然而,miR-429在宿主免疫系統中的其他功能目前報道較少,其具體作用機制亟待進一步證實。在表達上調的miRNA中,miR-106b屬于miR-17-92家族,被預測能夠靶向Tgfbr2 mRNA 影響iNKT細胞發育。miR-17-92家族表達上調可抑制轉化生化因子-β(TGF-β)信號通路,進而調節免疫系統反應[16];miR-155常在樹突狀細胞、T和B淋巴細胞中高表達,并調控著這類細胞功能。miR-155由Toll樣受體4(TLR4)介導的NF-κB活化產生,正向調節髓細胞增殖和樹突狀細胞成熟,進而調控樹突狀細胞向淋巴結遷移和抗原呈遞。因此,miR-155表達上調總伴隨著急性的免疫反應[17]。
當RSV抗原與識別受體TLR4和視黃酸誘導基因蛋白1(RIG-1)結合時,激活NF-κB,進而啟動宿主對RSV的免疫響應[18]。然而,過量NF-κB激活將對宿主造成有害效應,因此對NF-κB負調控將變得十分重要。通過對RSV陽性患兒miRNA表達進行分析,發現有4個與NF-κB調控密切相關的miRNAs,包括miR-34b、miR-125a、miR-155、miR-203a。該結果進一步證實RSV感染后,miRNA對NF-κB的精確正、負調控在宿主免疫響應中扮演重要作用。當兒童感染RSV后,大多數兒童癥狀較輕,而部分患兒將進一步進展為支氣管炎或肺炎。因此研究RSV感染后影響病情發展相關因素具有重要意義。因此,本研究進一步鑒別輕度和重度RSV感染陽性患兒間miRNA表達差異,結果顯示miR-125a表達在兩組RSV患兒間存在差異,且輕度患兒表達低于重度患兒。研究顯示,miR-125a通過對TNFAIP3抑制蛋白的負調控成為NF-κB的正向調節因子,而TNFAIP3抑制蛋白為CCL5的負調控因子,也是天然免疫和獲得性免疫系統中的一個重要細胞因子。當NF-κB活化后,miR-125a將在激活的人巨噬細胞中過表達[19]。本研究中,RSV感染輕度患兒鼻黏膜脫落細胞中miR-125a下調可能提示巨噬細胞活化減弱或/和NF-κB信號通路被抑制,從而抑制過度的先天性免疫應答,避免向肺炎或支氣管炎等更嚴重的臨床重度癥狀發展。
本研究通過miRNA微陣列芯片和qRCR對RSV感染患兒的鼻黏膜上皮脫落細胞miRNA表達譜進行分析,發現RSV患兒miRNA譜表達模式與宿主免疫系統調節密切相關,尤其包含了一系列與NF-κB調控密切相關的miRNA。其中,通過對輕、重度RSV患兒miRNA表達譜的分析,發現 miR-125a在輕度患者中表達顯著下調,提示miR-125a為經NF-κB通路的RSV免疫反應的一個重要調節因子,其功能還待進一步研究。此外,RSV感染患兒鼻黏膜樣品中與固有免疫反應有關miRNA的表達動態模式也將在下一步工作中進行研究。

