hUC-MSCs在LPS誘導肺上皮細胞線粒體損傷中的作用
宋 航,陳 霞,楊 艷,姜曉芳,馮 靜
(中國人民解放軍第三二四醫院,重慶 400020)
嚴重感染、有毒氣體吸入、休克等均可導致急性肺損傷,組織學上可表現為不同程度的肺水腫和肺不張等[1]。現臨床治療手段有限,預后差。而間充質干細胞(mesenchymal stem cells,MSCs)移植急性肺損傷模型的體內、體外實驗取得了較大成功[2]。前期課題組也證實了人臍帶間充質干細胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)對內毒素誘導的急性肺損傷(acute lung injury,ALI)小鼠模型的治療作用,但是目前治療機制不明。近年來發現MSCs治療成功的關鍵在于肺泡上皮細胞(alveolar epithelial cell,AEC)的修復[3]。因此探索MSCs修復AEC損傷的主要作用部位意義重大。多項研究表明AEC線粒體功能異常在ALI中起著關鍵作用[4]。但是目前MSCs對ALI患者AEC線粒體功能的影響,國內外相關報道較少。因此,本研究選擇A549細胞作為AEC的代表,希望通過本研究探明hUC-MSC修復脂多糖(LPS)誘導的ALI細胞模型中,hUC-MSC對人Ⅱ型肺泡上皮細胞素A549細胞線粒體功能的影響。
1 材料與方法
1.1材料
1.1.1細胞來源 hUC-MSCs為課題組前期由人臍帶組織成功分離獲得,A549細胞株購自南京科佰生物科技有限公司。
1.1.2主要試劑 DMEM/F12、澳洲胎牛血清(美國Gibco),二甲基亞砜(DMSO,美國Sigma-Aldrich),增強型CCK-8試劑盒、增強型腺嘌呤核苷三磷酸(ATP)檢測試劑盒、活性氧(ROS)檢測試劑盒、線粒體膜電位檢測試劑盒(JC-1)、細胞線粒體分離試劑盒、Western blot制膠試劑盒、脫脂奶粉(杭州碧云天生物技術有限公司),兔多克隆線粒體融合相關蛋白(Mfn1)抗體、兔多克隆線粒體呼吸相關蛋白(Miro1)抗體(英國Abcam公司),兔多克隆線粒體移動基因蛋白(NRF1)抗體(北京博奧森公司),TBS緩沖液(武漢博士德生物制品公司),無水甲醇(重慶川東化工有限公司)。
1.1.3主要實驗儀器 超凈工作臺(蘇州蘇潔凈化設備有限公司),電子天平(Storious公司),CO2細胞培養箱(美國Thermo Fisher Scientific),細胞計數板(上海求精生化試劑儀器公司),倒置顯微鏡(德國Leica公司)。
1.2方法
1.2.1LPS誘導ALI模型的建立 取A549細胞5×106/mL接種于6孔板,待細胞長至80%融合時,DEME培養液中加入10 μg/mL的LPS繼續培養24 h,建立ALI細胞模型。
1.2.2A549和hUC-MSCs直接共培養及實驗分組 取hUC-MSCs懸液500 μL,細胞密度5×106/mL直接加入已加入LPS的A549培養瓶中,5% CO2培養箱中培養48~72 h。實驗分為4組:A549+PBS、A549+LPS、A549+MSCs、A549+MSCs+LPS。
1.2.3流式細胞分選術 無菌條件下采用流式細胞分選術,將混合共培養A549和hUC-MSCs相互分離。上機分選時將共培養的細胞按體積大小明顯分為兩群,分選出體積小的細胞群。再利用增強型綠色熒光蛋白(EGFP)標記,分選出其中EGFP陰性表達的A549,在激光共聚焦顯微鏡下觀察,證實分選出的細胞為EGFP陰性,并且呈現出上皮細胞特征性的大小均一的短梭形狀。分選出的A549用于線粒體提取、免疫熒光標記、功能測定等實驗。
1.2.4細胞線粒體熒光探針染色 加入Mito-Tracker Green染色工作液,與細胞37 ℃共孵育15~45 min。然后去除染色工作液,加入37 ℃預溫育的新鮮細胞培養液。用熒光顯微鏡或激光共聚焦顯微鏡進行觀察。
1.2.5線粒體提取 首先收集A549細胞并洗滌細胞,通過預處理后勻漿,并對勻漿效果進行鑒定。細胞勻漿1 000×g離心10 min后,小心把上清液轉移到另一離心管中繼續3 500×g離心10 min,小心去除上清液。沉淀即為分離得到的細胞線粒體。在分離得到的線粒體樣品中可以加入150~200 μL線粒體儲存液,重懸線粒體。
1.2.6細胞ATP及ROS測定
1.2.6.1細胞ATP測定 吸除培養液裂解細胞。裂解后4 ℃ 12 000×g離心5 min,取上清液,用于后續的測定。每孔加入100 μL ATP檢測工作液及20 μL樣品或標準品,迅速混勻后,用液閃儀測定RLU值。根據標準曲線計算出樣品中ATP的水平。
1.2.6.2細胞ROS測定 收集細胞后裝載探針,稀釋2′,7′-二氯熒光黃雙乙酸鹽(DCFH-DA)使終濃度為10 μmol/L。細胞收集后懸浮于稀釋好的DCFH-DA中,細胞濃度為1×106/mL,繼續孵育20 min。收集細胞后用熒光分光光度計檢測。
1.2.7線粒體膜電位測定 配制JC-1染色工作液后設置陽性對照,把配制好的JC-1染色工作液再用JC-1染色緩沖液(1×)稀釋5倍。加入0.1 mL總量為10~100 μg純化的線粒體。用熒光分光光度計或熒光酶標儀檢測。
1.2.8Western blot方法測定線粒體功能因子(Mfn1、Drp1、Miro1)表達水平 制膠后加樣及電泳,然后轉膜封閉,一抗孵育后二抗孵育,確保抗體均勻孵育在聚偏氯乙烯(PVDF)膜上。并行顯影及圖像分析,以GAPDH 作為內參進行標準化,用ImageQuant TL對圖像進行灰度值半定量分析。
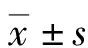
2 結 果
2.1分選后A549行熒光探針染色標記 分選后A549細胞在熒光顯微鏡下滿視野可見明亮的強熒光染色,證實提取后的細胞線粒體活性可,見圖1。
圖1 分選后AEC線粒體熒光探針染色
2.2混合培養后A549細胞的ATP及ROS變化 A549+PBS組與A549+LPS組比較,ATP與ROS水平差異有統計學意義(P<0.05,P<0.01);A549+LPS組與A549+MSCs+LPS組比較,ATP與ROS水平差異有統計學意義(P<0.05,P<0.01),而A549+MSCs+LPS組與A549+PBS組比較,差異無統計學意義(P>0.05)。可以看出,LPS刺激下A549細胞單獨培養組ATP下降,ROS升高;而與hUC-MSCs混合培養后,細胞ATP升高,ROS下降,見圖2。
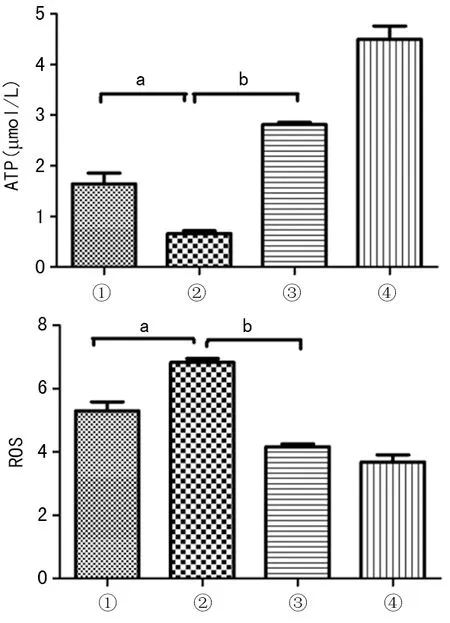
①:A549+MSCs+LPS組;②:A549+LPS組;③:A549+PBS組;④:A549+MSCs組;a:P<0.05,b:P<0.01
圖2 LPS誘導下A549的ATP及ROS水平
2.3混合培養后A549線粒體膜電位變化 A549+PBS組線粒體膜電位與A549+LPS組比較,差異有統計學意義(P<0.05),而A549+MSCs+LPS組與A549+PBS組比較,差異無統計學意義(P<0.01);A549+LPS組與A549+MSCs+LPS組比較,差異有統計學意義(P<0.01)。證實LPS刺激下AEC線粒體膜電位顯著下降,hUC-MSCs可有效提高AEC線粒體膜電位,見圖3。
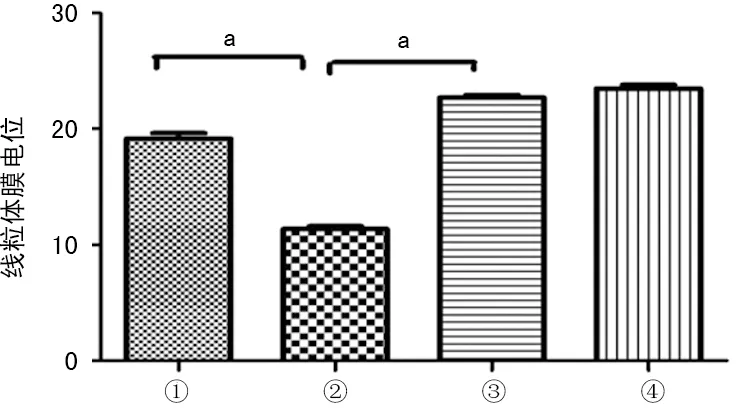
①:A549+MSCs+LPS組;②:A549+LPS組;③:A549+PBS組;④:A549+MSCs組;a:P<0.01
圖3 LPS誘導下A549的線粒體膜電位
2.4Western blot測定混合培養后AEC線粒體功能因子的變化 與A549+PBS組比較,LPS+A549組Mfn1、Miro1、NRF1明顯降低(P<0.01)。A549+LPS組Mfn1、NRF1、Miro1表達水平顯著低于A549+MSCs+LPS組(P<0.01)。A549+PBS組與A549+MSCs組比較Mfn1、Miro1蛋白表達水平顯著減低(P<0.01),而NRF1差異無統計學意義(P>0.05)。

A:Western blot結果;B:Mfn1定量分析;C:NRF1定量分析;D:Miro1定量分析;①:A549+MSCs+LPS組;②:A549+LPS組;③:A549+PBS組;④:A549+MSCs組
圖4 LPS刺激下AEC 線粒體相關功能蛋白變化
3 討 論
近年來有關ALI致病機制的研究及治療手段都取得較大進步,但是其發病率及病死率仍然很高。ALI主要表現為肺血氣交換屏障破壞,伴有體內炎癥因子和趨化因子水平明顯升高[5]。AEC作為肺泡壁的重要組成成分,主要構筑肺血管內皮-肺泡上皮屏障,在ALI進程中起著穩定肺泡結構,減輕全身炎性反應,維持凝血/纖溶平衡,促進肺泡內液體的清除及免疫調節的作用。因此AEC的完整性與ALI的預后和生存密切相關[6]。而線粒體做為一個結構和功能復雜的重要細胞器,在細胞能量代謝和信號通路傳導等方面發揮關鍵作用[7]。研究發現AEC在ALI進程中線粒體發生酶活性改變,鈣超載及通透性轉換等,隨之線粒體融合/分裂、移動、能量代謝等功能受到嚴重影響,加重AEC的損傷[8]。由此可見,ALI觸發的炎性反應與AEC線粒體功能完整性明確相關,修復AEC線粒體的功能將成為ALI治療的新目標[9]。
截止目前,針對AEC修復的臨床治療策略非常有限,主要集中在MSCs移植治療[10]。MSCs治療肺損傷的療效及安全性已得到了國內外學者一致認可[11]。多項研究認為MSCs治療ALI的機制主要為3個方面:抗炎作用、旁分泌作用及免疫調節作用[12]。但是MSCs對AEC線粒體功能的影響尚不明確。
研究已證實線粒體通過融合和分裂實現動態變化,融合和分裂間的平衡與氧自由基產生量有關[13]。介導機體線粒體融合的蛋白主要包括Mfnl、Mfn2,其中以Mfn1最常見,位于線粒體外膜[14]。核呼吸因子NRF1的表達受到PRARr-1共激活因子-1α(PGC-1α)的誘導,而且PGC-1α和NRF1二者結合能夠直接調控DNA編碼過程線粒體氧化磷酸化復合物的表達[15]。另Miro1通過支持膜突出和病灶黏附性的穩定,調節線粒體在前緣位置,以提供局部能量生成促進細胞移動。故認為Miro1做為線粒體動力學相關蛋白,可調控線粒體移動促進細胞修復[16]。
本研究發現:A549細胞與hUC-MSCs直接混合培養后,采用流式細胞儀對A549成功分選,分選后A549細胞線粒體染色呈明亮的強熒光。hUC-MSCs可以調控A549線粒體的能量代謝功能,保護LPS刺激下A549線粒體膜電位,可明顯提高A549線粒體Miro1水平,而且此作用與LPS刺激無關,且hUC-MSCs對A549線粒體損傷的修復是多方面的,包括移動、融合分裂、呼吸鏈功能。
本研究證實了hUC-MSCs可能通過調控AEC的線粒體功能,修復LPS誘導的AEC損傷,但其調節機制還需進一步研究探索。

