肝細胞自體熒光光譜研究
(長春理工大學 光電工程學院,長春 130022)
在最新的調查報告中顯示,我國癌癥發病率近些年不斷攀升。目前,我國癌癥患者已超過全球患者的四分之一,每天爆增癌癥病例一萬人以上,隨著人口老齡化加重,癌癥的發病率還將不斷攀升。肝癌是死亡率最高的惡性腫瘤之一,因為肝癌早期癥狀不明顯,診斷觀察難度大,往往會貽誤病機,錯過最佳的治療時間[1]。現有的診斷方式往往是提取腫瘤組織直接進行檢測,這種方法只能在病情將要甚至轉為惡性腫瘤時才能有所發現,面對我國目前肝癌患者增長趨勢,有效的檢測手段是必須而且有價值的[2]。
熒光分析法是根據物質熒光譜線的位置及其強度進行物質鑒定和含量測定的分析方法。隨著對熒光光譜的觀察方法及對后期數據處理方式的改進,熒光光譜技術得以不斷發展,很大程度上拓寬了熒光分析法的使用范圍,逐漸延伸至石油勘測、食品安全、環境保護和生命醫學等應用領域[3-4]。對肝細胞的研究是攻克肝癌必不可少的環節,而熒光光譜技術由于其準確性高,穩定性強,且方便易測等優勢,已經廣泛應用于醫學檢測領域,在多種癌癥細胞診斷領域獲得極大發展,已經成為一種極具影響力的有效檢測方法[5-8]。
本文通過顯微熒光光譜成像實驗獲取肝細胞的特異性熒光光譜特征及分析熒光強度變化趨勢。為了證明細胞的熒光飽和強度與細胞的直徑大小的關系,結合熒光顯微鏡實驗和流式細胞實驗,來估算肝細胞平均直徑,并分析肝細胞熒光飽和趨勢變化。本文將細胞形態學與光譜學有機的融合,能夠提高肝癌診斷的準確性和有效性。同時,為實現肝癌早期篩查提供光譜學依據,以及為接下來研究肝癌細胞的對比實驗奠定基礎。
1 實驗過程
1.1 樣品配置
肝細胞選用:HL-7702[L-02]人肝細胞。細胞培養環境選用37℃、5%CO2飽和濕度的無菌培養箱。培養體系選擇PMll640培養基、10%新生牛血清、1%雙抗。正常細胞培養相對困難,因其增殖少,生長慢,選擇傳代方式為1∶2傳代,傳代時間在36~48h,且細胞貼壁時間4~6h,過程中利用光學顯微鏡觀察生長狀態[9]。消化離心處理,獲得足夠數量的肝細胞后,加入PBS溶液,用細胞槍吹散搖勻,通過顯微計數,配置所需濃度的細胞懸浮液。計數調節配置細胞濃度為1×106cells/ml、7.5×105cells/ml、5.0×105cells/ml、2.5×105cells/ml、1.25×105cells/ml肝細胞懸浮液,每種濃度3組,減小實驗誤差及偶然性。配置3組5×104cells/ml肝細胞懸浮液,用于流式細胞實驗。16孔板×2,每個孔分別種2×104cells細胞,放入孵箱中培養12h,用于熒光顯微鏡實驗。
1.2 熒光光譜實驗
1.2.1 實驗原理
自體熒光是由細胞內固有的熒光團吸收特定波長的光而引起的熒光發射。由于基態具有不同的振動能級,因而每種物質可激發出多個波長的特征發射光譜,當然,隨著細胞代謝及病變過程進行中產生的不同物質也可產生不同的特征熒光[10]。細胞內光敏物質受到激發后,產生不同譜線形狀或強度的熒光光譜,由此分析細胞的種類和細胞內部代謝物質多種基團變化。正常細胞在發生病變的過程中,由于自身增殖方式和代謝水平都發生變化,細胞內固有熒光團產生差異,通過自體熒光光譜的特異性能夠有效分析細胞情況,這是細胞自體熒光光譜用于生命醫學領域的理論基礎。
1.2.2 實驗過程
在實驗中,將配置好的細胞懸浮液放入離心管中,用細胞槍吹散,確保肝細胞在熒光激發過程中處于懸浮狀態,細胞槍取出懸浮液置入0.9ML比色皿中。使用FL6500熒光光譜儀測量細胞懸浮液,狹縫的光譜帶寬為10.0nm,激發波長488nm,發射波長530~900nm,激發波長間隔1nm,掃描速度600nm/min,平均時間0.1s。細胞懸浮液配置好后在30min之內完成測量,共三次檢測確保結果可信。
1.3 流式細胞實驗
流式細胞儀主要由四部分組成,包括流動室和液流系統;激光源和光學系統;光電管和檢測系統;計算機和分析系統。結合流式細胞儀對肝細胞進行分析,獲得前向角散射光和側向角散射光雙參數散點圖,來觀察肝細胞。前向散射角與細胞的大小有關,確切的說與細胞直徑平方密切相關,選擇FSC作為閾值可以排除樣品碎片以及鞘液中小液滴的干擾。利用圖像輔助流式細胞儀,可以一次觀察大數量細胞情況,實驗過程中選用了3組5×104cells/ml肝細胞懸浮液,用于流式細胞實驗,來觀察肝細胞直徑特點。
1.4 熒光顯微鏡實驗
熒光探針的作用是與本身熒光較弱或者無熒光的物質特異性復合,產生熒光光譜,因其具有體積小、成本低、無需預處理、不受外界電磁場影響等特性,成為當前一個重要的研究熱點[10]。在熒光顯微實驗中,加入了兩種探針,分別與細胞核及細胞膜結合,通過特定波長光源激發,拍攝細胞的熒光圖像[11]。實驗前的預處理基本操作:將探針加載入孔板中,放入孵箱靜置半小時,等待探針和作用位點充分結合染色,洗去浮色,防止干擾增強拍攝效果。
2 實驗結果
2.1 熒光光譜結果
肝細胞懸浮液在488nm波長的光激發下,獲得特異性熒光發射譜,如圖1所示,為3組50Wcells/ml細胞懸浮液的熒光光譜。可以發現,肝細胞在550~900nm之間,位于588nm和660nm處存在特異性熒光峰,588nm處為最大激發強度。3組結果近乎相同,造成差異的原因可能是細胞懸浮液配置不均勻造成,實驗先后順序不同,細胞狀態有略微差異也會干擾實驗結果,但結果具備可靠性。為了研究肝細胞的飽和強度趨勢,檢測不同濃度的細胞懸浮液,如圖2所示,為不同濃度懸浮液的熒光光譜。在不同濃度下,兩個明顯峰值位置基本不變,分別在588nm和660nm處,最大熒光強度隨著濃度增加而增強,但是增長趨勢放慢。
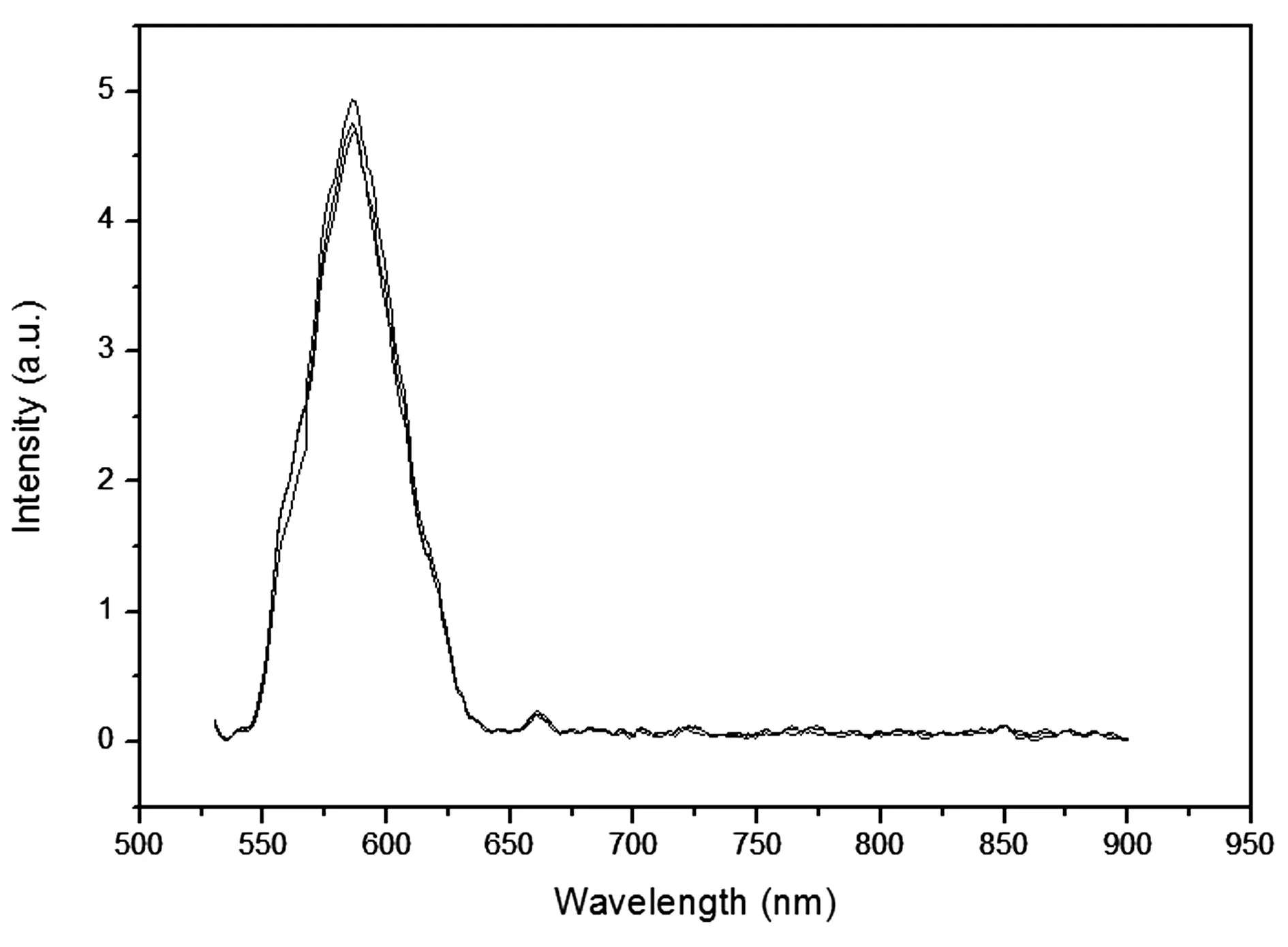
圖1 細胞濃度50Wcells/ml熒光光譜
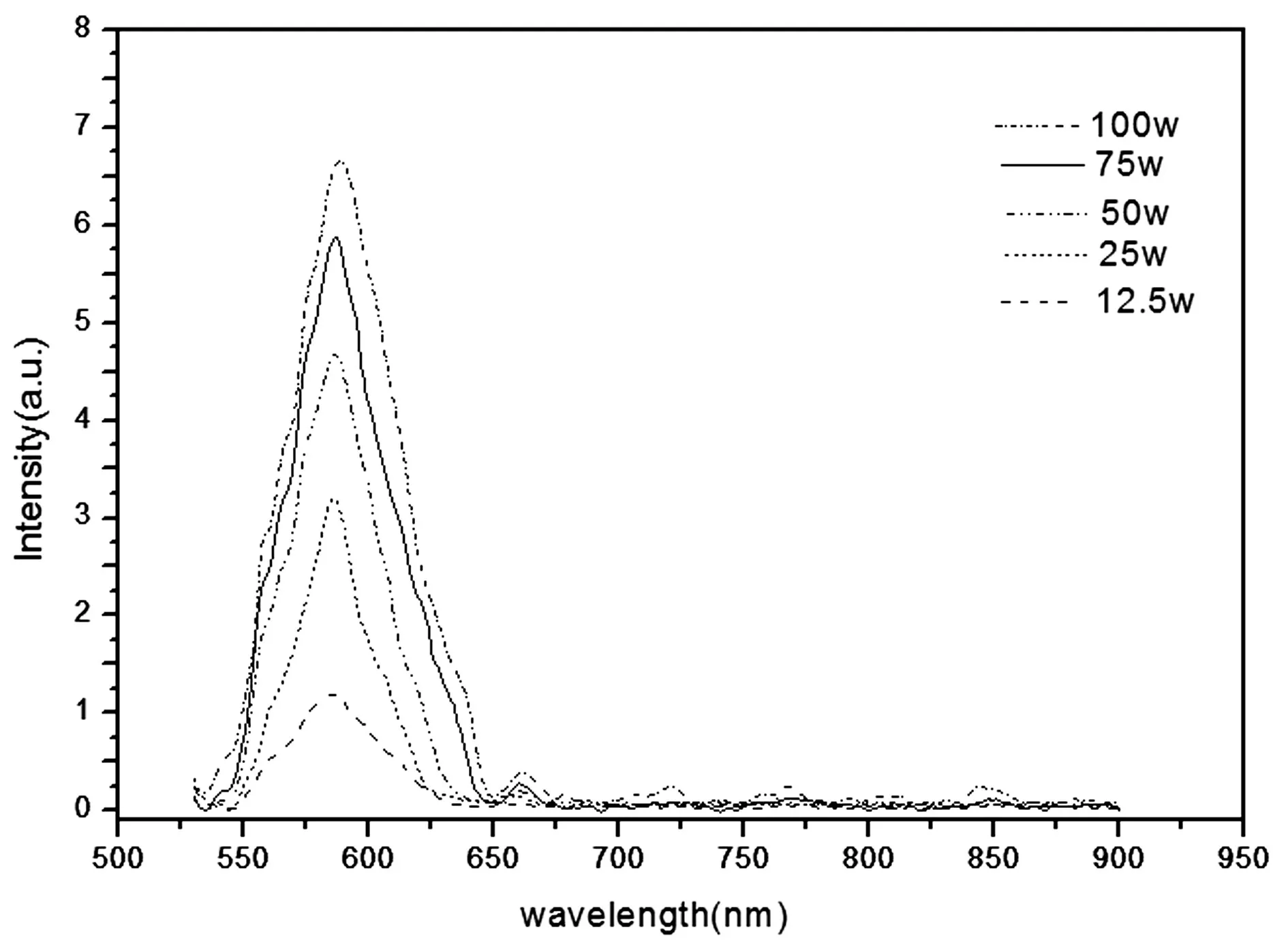
圖2 細胞多種濃度熒光光譜圖
2.2 流式細胞儀結果
圖3是利用流式細胞儀分析組5×104cells肝癌細的熒光信號結果,圖上每一個點均代表一個細胞,并設置門來進行觀察,結果顯示肝細胞直徑比較集中,絕大部分的細胞群落集中在設置門內。
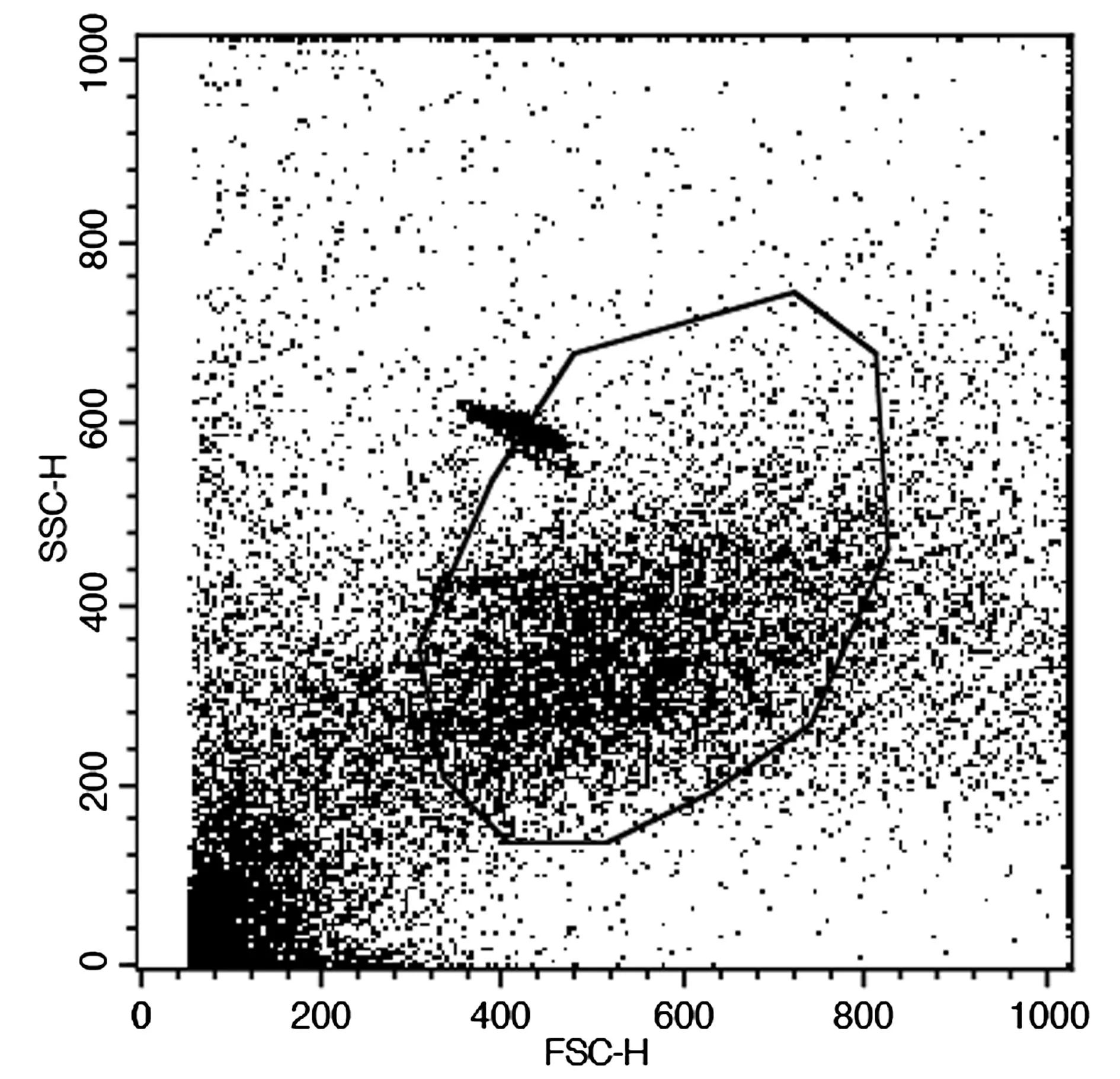
圖3 流式細胞儀分析結果
2.3 熒光顯微鏡結果
選擇兩種探針,型號分別為,核探針DAPI,C001激發/發射波長:358nm/461nm,以及膜探針DID,C018,激發/發射波長:485nm/502nm。
如圖4所示,此為加入核探針后的肝細胞熒光圖像,利用核探針染色可以對粘連的細胞團實現優化計數[12]。圖5為加入膜探針后的肝細胞熒光圖像,通過熒光顯微鏡進行觀察,可以發現肝細胞呈現梭型,利用膜探針可以更好地觀察細胞的大小和形態。
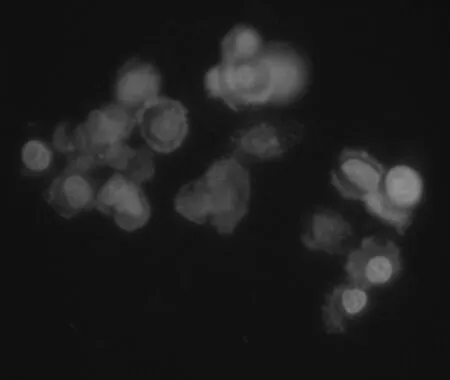
圖4 細胞核熒光圖像
圖5 細胞膜熒光圖像
同等放大倍率下,選擇30個不同視野下拍攝肝細胞的熒光圖像,與標準長度對比,統計結果并計算肝細胞平均直徑。在同等的放大倍數下,隨機統計30個視野下的熒光圖片,可以計算出肝細胞的直徑大概在13.1μm左右。
2.4 熒光飽和強度分析
圖6中橫軸表示不同濃度梯度,縱軸表示不同濃度下的最大熒光強度,對折線圖進行分析,結果發現細胞的最大熒光強度會隨著細胞濃度增大而增強,但是逐漸會呈現熒光飽和狀態,單個細胞自激發熒光效率降低。肝細胞熒光飽和強度在未達到5×105cells/ml前接近線性增加,但隨著濃度增大熒光強度增速降低,明顯呈現出飽和趨勢。
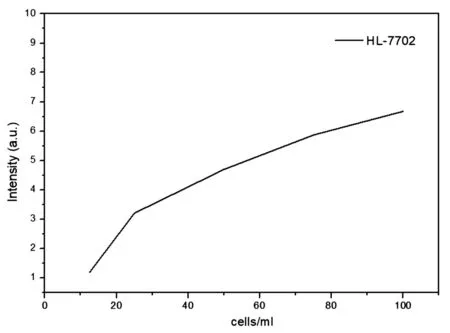
圖6 熒光飽和趨勢分析
3 結論
肝細胞培育過程中發現,正常肝細胞極易發生污染,應注意好滅菌工作。正常肝細胞的貼壁較慢,生長速度較癌細胞低,生長周期長,培育過程適宜1:2傳代。熒光光譜儀檢測結果顯示,在488nm光源激發下肝細胞懸浮液獲得特異性熒光發射光譜,肝細胞在550~900nm之間,位于588nm和660nm處存在特異性熒光峰,588nm處為最大激發強度。在不同濃度下,兩個明顯峰值位置基本不變,分別在588nm和660nm處,最大熒光強度隨著濃度增大而增強,但是增長趨勢放慢。
熒光顯微結果顯示在同等的放大倍數下,隨機統計30個視野下的熒光圖像,可以計算出肝細胞的直徑大概在13.1μm左右。流式細胞儀實驗結果證明肝細胞直徑比較集中。對于肝細胞平均直徑,細胞熒光飽和強度在未達到5×105cells/ml前接近線性增加,但隨著濃度越大熒光強度增速降低,逐漸呈現出飽和趨勢明顯的結果。
進一步工作將是對比肝癌細胞,檢測肝癌細胞的熒光光譜,并通過流式細胞實驗和熒光顯微實驗來獲取肝癌細胞的直徑,觀察熒光飽和趨勢的變化。本文的工作不僅探索了肝細胞的熒光特性,還計算了肝細胞的平均直徑,分析了肝細胞熒光飽和強度變化趨勢,為肝癌的早期診斷和篩查提供了光譜學依據。

