巧用“試劑—雜質—操作—產品”四線法突破工藝流程題
湖南 周學興 楊 華
1.背景分析
1.1 高考背景分析
高考的功能——立德樹人、為國家選拔人才,高考題以真實問題的解決為背景考查所學知識,常以實際生產工藝為背景,以元素化合物基礎知識為主線,著眼于學生接受、吸收、整合信息能力的考查。新課改后的高考有很強的時代感和實踐性,化工生產技術的“工藝流程題”已成為新亮點和主流題型,突出考查學生對元素化合物知識的運用,以能力與核心素養考查為根本,著眼于學生對化學信息的接受、吸收、整合能力的考查,以化學核心知識、概念為題干,以知識模型建構為落腳點,跳出了讓學生陷入題海戰的桎梏。
2017年教育部公布的高考考綱發生了很大的變化,對化學而言,刪去“化學與技術”模塊,選考部分由原來的“三選一”改為“二選一”,工藝流程題在13、15、16、17年高考全國卷Ⅰ中均有考查,近三年高考化學考查工藝流程題的情況,見表1。

表1 近三年高考工藝流程題的考查情況
學生遇到工藝流程題時,畏懼心嚴重,得分率較低。2017年湖南省學生得分情況抽樣表明,27題工藝流程題得分率最低,該題對學生整理、吸收、分析化學信息要求較高,平均得分情況見表2。

表2 2017年全國卷Ⅰ部分非選擇題抽樣平均得分情況
1.2 學生學情分析
學生應對高考,大多同學把“考點”作為復習依據,用“突破考點”“狂練考點”“強化訓練”等為主要手段,進行大量的機械重復勞動,盡管花費了大量學習時間,但收效甚微。具體存在以下困難:①閱讀困難,審題過程不能迅速捕捉有用信息。②答題語言不規范。③元素化合物知識不扎實,不能夠辨析微觀反應。④思考不全面,雜質選擇性屏蔽。⑤思維定勢,死記硬背,不能靈活運用化學原理分析問題。⑥流程的全面分析與題設解決的辯證與統一,有的時候,工藝流程并不需要各個階段都詳細分析,而應“粗”“細”結合,游刃有余。
筆者閱讀了許多關于工藝流程題解題技巧的文章,本文基于模型認知的構建,提出“試劑—雜質—操作—產品”四線法,舉例說明該法能幫助高三學生高效理解工藝流程,有效提高學生處理信息、分析問題、解決問題等方面的能力。
2.“四線法”介紹
“四線法”顧名思義,通過分析四條主線,突破工藝流程題的整體把握,四條主線分別為試劑線、雜質線、操作線、產品線。根據工藝流程題的類型不同,四條主線具體呈現的內容不同。
利用“試劑—雜質—操作—產品”四線法解工藝流程題的模型認知,見圖1。
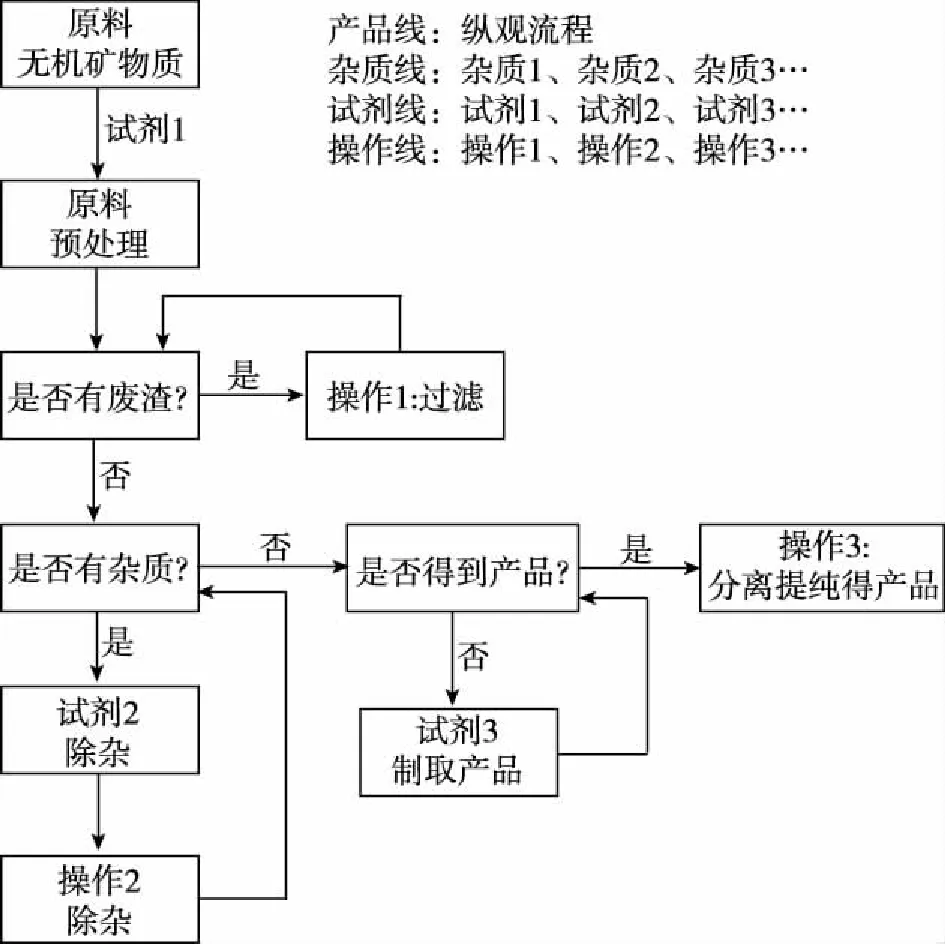
圖1 四線法解工藝流程題的模型認知
四線法,符合真實化工流程的目的,更快更好地得到更純的產品,有利于提升學生宏觀辨識與微觀探析的素養。
2018年全國卷Ⅰ工藝流程題的四線呈現情況、信息呈現形式,見表3。
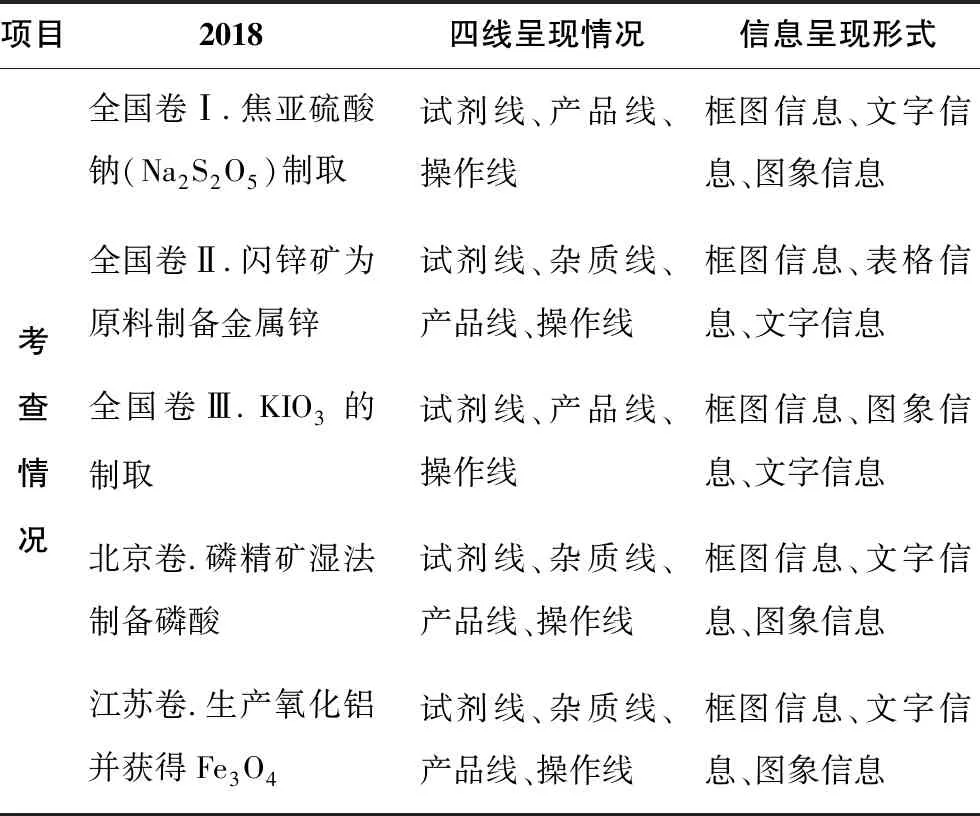
表3 基于四線法的工藝流程題分析
粗看工藝流程框圖,迅速把握“四線”,能夠整體把控整個化工流程的框架,儲備一些常見教材工藝流程,比如高中教材中涉及的化學工業:①候氏制堿法,②氯堿工業,③硅酸鹽工業,④工業制硫酸,⑤合成氨工業,⑥工業制硝酸,⑦金屬Na、Mg、Al、Fe、Cu等的冶煉,⑧海水中提取物質等。
2.1 試劑線
需要掌握常見試劑的類型、作用和相關反應,也可稱為反應線。常見試劑及其作用,見表4。

表4 常見試劑及其作用
2.2 雜質線
對于礦物質而言,測定元素組成后,即可確定雜質,需要積累常見試劑的處理方法、常見雜質及其除雜方式,見表5。

表5 常見雜質及除雜方式
工藝流程分析過程中,需要抓住雜質的去向分析,切勿因為思維的不嚴謹,導致某雜質還未除去卻茫然不知。違背了化工生產的目的。同時雜質的去除離不開試劑線的分析。
2.3 操作線
主要指的是分離提純操作,每加一次試劑,便需要思考是否需要過濾、蒸發、冷卻結晶、蒸餾、萃取等分離提純操作,見表6。

表6 常見操作及目的
2.4 產品線
試劑線、雜質線、操作線展開是為了獲取產品,產品的獲取主要通過除去雜質,發生核心反應而獲取產品。通過總結近幾年全國卷Ⅰ高考化學工藝題產品的獲取方式(見表7),不難發現產品的獲取具有以下特點:①主要圍繞金屬元素的相關工藝品進行考查;②工藝產品具有多樣性,體現了經濟需要實效性;③產品的獲取可能在流程的前半部分;更多是后期才得到產品;④產品的獲取,需要試劑參與反應轉化,可能發生的是氧化還原反應;⑤產品的獲取,所涉及的分離提純操作及方法,離不開產品自身的性質,由于大部分產品是固體,故基本上離不開結晶的相關操作。

表7 工藝產品的獲取
3.習題感悟
基于四線法,能夠全面了解工藝流程框圖的過程,理解如何除雜、試劑如何使用、產品如何獲取、如何操作等。
【案例1】鍶(Sr)為第五周期ⅡA族元素,高純六水氯化鍶晶體(SrCl2·6H2O)具有很高的經濟價值,61℃時晶體開始失去結晶水,100℃時失去全部結晶水。用工業碳酸鍶粉末(含少量Ba、Fe的化合物)制備高純六水氯化鍶的過程如圖2。
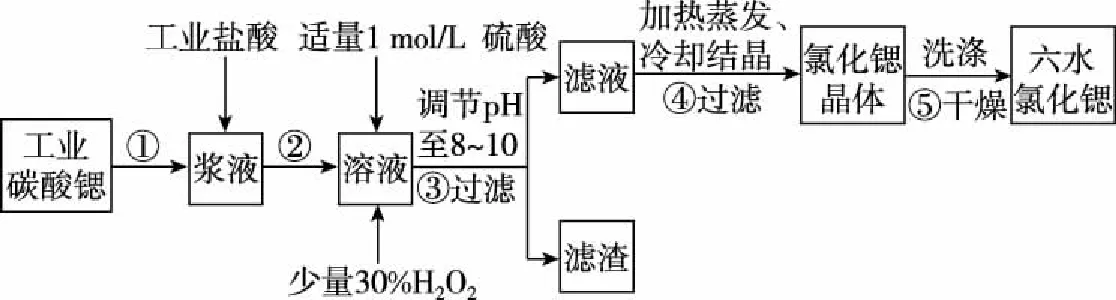
圖2
請回答:
(1)寫出步驟②在漿液中加入鹽酸時發生反應的離子方程式:________________。
(2)步驟③中調節溶液pH至8~10,宜選用的試劑為________。
A.稀硫酸 B.氫氧化鍶粉末
C.氫氧化鈉 D.氧化鍶粉末
所得濾渣的主要成分是________(填化學式)。
(3)步驟⑤中,洗滌氯化鍶晶體最好選用________。
A.水 B.稀硫酸
C.氫氧化鈉溶液 D.氯化鍶飽和溶液
(4)工業上用50~60℃熱風吹干六水氯化鍶,選擇該溫度的原因是________________。
(5)若濾液中Ba2+濃度為1×10-5mol·L-1,依據表8中數據可以推算濾液中Sr2+物質的量濃度為________。

表8
【工藝流程分析】


(2)BD BaSO4和Fe(OH)3
(3)D
(4)溫度高于61℃,SrCl2·6H2O失去結晶水
通過試劑線、雜質線、操作線、產品線四線并進的分析方法,有序有效地突破了工藝流程題的難點,解決了學生思考不全面的問題。關注題目的每一條線,但不必將每一條線都推出,問什么推什么,要帶著問題去精心研究某一步或某一個物質。
【案例2】(2018·全國卷Ⅰ·27,節選)焦亞硫酸鈉(Na2S2O5)在醫藥、橡膠、印染、食品等方面應用廣泛。回答下列問題:
(1)生產Na2S2O5,通常是由NaHSO3過飽和溶液經結晶脫水制得。寫出該過程的化學方程式:__________________________。
(2)利用煙道氣中的SO2生產Na2S2O5的工藝如圖3所示:
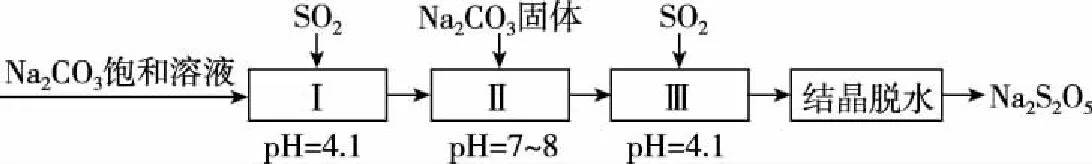
圖3
① pH=4.1時,Ⅰ中為________(寫化學式)溶液。
② 工藝中加入Na2CO3固體并再次充入SO2的目的是________________。
【工藝流程分析】整合吸收化學信息:工業上通過NaHSO3過飽和溶液結晶脫水制得Na2S2O5。分析流程可知,該題的主線為試劑線、產品線、操作線,并未體現試劑線與雜質線的關系。

直接切中要害,通入SO2即可得到產品,結合已知信息,其目的不言而喻,是為了得到NaHSO3過飽和溶液。

(2)①NaHSO3②得到NaHSO3過飽和溶液
【案例3】某科研小組以難溶性鉀長石(K2O·Al2O3·6SiO2)為原料,提取Al2O3、K2CO3等物質,工藝流程如圖4所示:
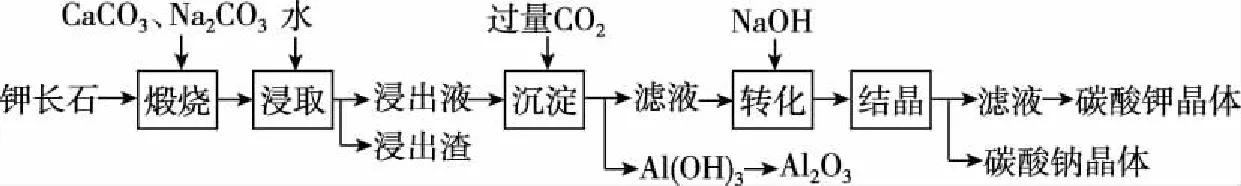
圖4
上述工藝中可以循環利用的主要物質是________、________和水。
【工業流程分析】
既消耗又生成的物質,通過試劑線分析可知還有Na2CO3和CO2能夠循環利用。
【答案】Na2CO3CO2
【案例4】(2017·全國卷Ⅰ·27,節選)Li4Ti5O12和LiFePO4都是鋰離子電池的電極材料,可利用鈦鐵礦(主要成分為FeTiO3,還含有少量MgO、SiO2等雜質)來制備,工藝流程如圖5所示:

圖5
(3)TiO2·xH2O沉淀與雙氧水、氨水反應40 min所得實驗結果如表9所示:
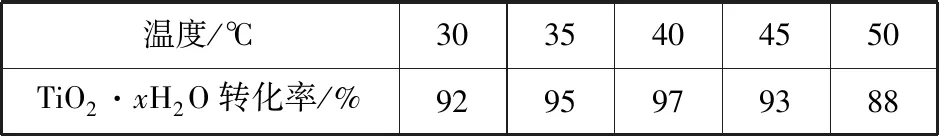
表9
分析40℃時TiO2·xH2O轉化率最高的原因:________________________________。
【化工流程分析】
基于中間產物高效獲取這一目的,結合產品線及操作線的分析,可知在該流程中溫度為何選擇40℃,需要從過高過低角度分析原因,低于40℃時,TiO2·xH2O轉化率隨溫度升高而增加,超過40℃,雙氧水分解與氨氣逸出導致TiO2·xH2O轉化反應速率下降。
【答案】低于40℃,TiO2·xH2O轉化率隨溫度升高而增加,超過40℃,雙氧水分解與氨氣逸出導致TiO2·xH2O轉化反應速率下降。
4.練后提煉——特殊設問及其解決策略
工藝流程題,往往需要在四線基礎上,積累特殊設問的應對策略,這樣工藝流程題不再會是高中生的“攔路虎”,近幾年高考易錯的熱點設問如下:
4.1 分析循環利用的物質和可回收的物質
循環利用和回收利用,是工業生產提高經濟效益、降低污染、提高物質的利用率等的必要手段。
①理解物質循環利用目的是節能減排,“綠色化學”,降低成本等,提煉出一定不會用于循環的物質:目標產物、雜質,可以用于循環的物質:輔助試劑、母液。
②可回收的物質:副產品(非目標產品)。
應對策略:弄清楚每一步的反應物、產物,對比“投入”“輸出”,消耗又生成即為循環利用物質。
4.2 分析調節溶液的pH
①目的:使溶液中的某金屬陽離子形成氫氧化物完全沉淀下來而除去。
②需要的物質:含主要陽離子的難溶性氧化物或氫氧化物或碳酸鹽,即能與H+反應,使pH增大的物質,如MgO、Mg(OH)2等。
③原理:加入的物質能與溶液中的H+反應,降低了H+濃度,增大pH。
④pH控制的范圍:大于除去離子的完全沉淀值,小于主要離子開始沉淀的pH。
4.3 分析洗滌沉淀
實際工業生產過程中,沉淀的洗滌主要圍繞洗滌什么雜質、怎么洗(洗滌操作)、用什么洗滌、為什么用這個洗滌劑等問題展開分析,考題亦如此。
(1)沉淀洗滌的目的:除去沉淀表面附著或沉淀中包夾的可溶性離子。
(2)洗滌方法:向漏斗內加蒸餾水至浸沒沉淀,待水自然流出后,重復操作2~3次。
(3)沉淀劑是否過量的判斷方法答題模板。
①加沉淀劑:靜置,向上層清液中繼續滴加少量沉淀劑,若無沉淀產生,則證明沉淀劑已過量。
②加入與沉淀劑反應的試劑:靜置,取適量上層清液于另一潔凈試管中,向其中加入少量與沉淀劑作用產生沉淀的試劑,若產生沉淀,證明沉淀劑已過量。注意:若需稱量沉淀的質量而進行有關定量計算時則只能選用方法(1)。
(4)判斷沉淀是否洗凈的操作答題模板(一般考查氯離子和硫酸根離子等沉淀型的離子檢驗)取最后一次洗滌液,滴加……(試劑),若沒有……現象,證明沉淀已洗凈。
4.4 分析控制溫度
溫度的控制,實際生產過程中主要基于反應速率、物質的溶解度(溶解度曲線)、物質的熱分解與揮發(物質的性質分析)、弱離子的水解(平衡)、能源的利用(耗能)、副反應的發生、催化劑的活性、生產安全性等方面的思考。一般需要考慮溫度過高、過低會有怎樣的效果。具體如下:
(1)加熱:加快反應速率或溶解速率
促進平衡向吸熱方向移動;除雜,除去熱穩定性差的雜質,如NaHCO3、Ca(HCO3)2、KMnO4、I2、NH4Cl等物質。使沸點相對較低的原料氣化。
(2)降溫:防止某物質在高溫時溶解(或分解)
使化學平衡向著題目要求的方向移動(放熱方向),使某個沸點較高的產物液化,使其與其他物質分離,降低晶體的溶解度,減少損失,尤其是減壓蒸發、減壓烘干,通過降低溫度需求,防止目標物質的分解。
(3)控溫:(用水浴或油浴控溫)
防止某種物質溫度過高時分解或揮發,為了使某物質達到沸點揮發出來,使催化劑的活性達到最好,防止副反應的發生,降溫或減壓可以減少能源成本,降低對設備的要求,達到綠色化學的要求。
4.5 分析化工流程的評價
實際工業生產過程中,評價化工流程,需要考慮速率、產率、產品純度、成本、污染、循環利用等方面,其中污染主要指的是:廢渣、廢液(酸、堿、重金屬鹽)、廢氣(Cl2、Br2、硫和氮的氧化物等)。
教學中注重化工流程的評價,引導學生關注社會生產、社會環境等問題,激發學生探究潛質。
5.總結
利用“試劑—雜質—操作—產品”四線法可以快速地理解工藝流程題的流程模型,通過常見問題認知模型的構建,能夠真正了解工藝流程的框架,掌握“四線”及常見設問的解決方式,高三學子便可不用對工藝流程題“望而生畏”。
但在教學過程中不能只強調解題,通過解題引導學生體會真實工藝的復雜性、綜合性,比如雜質的去除可以選擇方案Ⅰ也可以選擇方案Ⅱ,需要綜合考慮整個流程最終確定最佳方案,同時應該注重真實工業工藝的介紹,創設條件讓學生走進生產一線,切實體會“紙上得來終覺淺”,提供有利條件,創設實驗條件,拋出問題,讓學生通過“四線法”自主設計如何綜合利用礦物質或廢渣的實驗方案,并實施實驗。最終讓學生明白高考化學所考查的是一道工藝的簡化模式,還需要有化工專業知識、實踐經驗、經濟效益等方面的分析,才能夠真正批量生產。通過利用四線法幫助學生從具體知識的掌握到實際問題的解決,最終到知識素養化的轉變。通過“四線法”分析工藝流程題教學,讓學生順利地邁出認識化學工藝的第一步,并不斷引導學生關注日常的生產實際問題,創設真實情境,提高學生分析、解決問題的能力。

