2019年高考化學《考試大綱》分析及考向預測
湖北 文麗娟 楊恩健
2019年高考化學《考試大綱》已經發布,經與2018年高考化學《考試大綱》進行逐字對比,可以發現基本沒有變動,考核目標與要求、考試范圍與要求均沒有什么變化,這也符合《考試大綱》修訂原則的一貫特征。在新一輪高考改革到來之前,將以平穩過渡的方式進入新改革。
一、2019年高考化學命題基本方向
2018年6月8日高考結束當天,教育部考試中心推出《2018年高考各科試題評析》。文章評述2018年高考各科試題,很好地體現了“立德樹人、服務選才、引導教學”的核心功能,特別突出“立德樹人”和“素質教育”為首要功能。化學試題的要求:貫徹改革要求,推動素質教育;展現成果,突出貢獻,發揮學科育人功能;情境真實,應用導向,聚焦學科核心素養;形式多樣,數據詳實,測評學科關鍵能力;依據大綱,回歸教材,考查學科必備知識。
高考化學考試內容改革:基礎性,注重對學科基礎知識和基本方法的考查;綜合性,不斷加強模塊的綜合,探索學科間的綜合;應用性,加強與社會、生產、生活實際的聯系,考查應用能力;創新性,加強探索設計型創新思維能力的考查、自主學習創新思維能力。
2019年的高考化學命題會保持穩定性和一定的發展性,考查的主干知識、核心能力以及題型基本沒有變化,結合《考試大綱》和近幾年高考命題的特點及變化趨向,現對2019年高考進行合理預測。
二、高考化學試題預測
1.立德樹人、服務選拔、素養導向考查
在不同情景下利用知識和技能完成任務、應變能力,學科觀念、學科視野,體現實踐能力和創新精神;運用知識能力:獨立思考、分析問題和解決問題、交流合作,適應社會發展;在知識積累、能力提升和素質養成的過程中,逐步形成正確的核心價值觀。命題注重考查中學化學的基礎知識,突出對中學化學主干知識的考查,引導中學化學教學注重形成完整的學科體系。
預測2019年高考化學試題,就選擇題而言,融合多個模塊內容考查綜合性,每一題一個主題思想,每個選項則圍繞主題涉及不同知識內容或同一知識點的不同認識角度,有效考查學生對主干知識的深度理解能力及其對于學科體系的掌握程度,進而考查思維的深刻性、獨特性與敏捷性,體現對學科素養的考查。就非選擇題部分而言,每一道題都力爭以一個完善的整體出現,不再是知識零散的堆積。盡量展示一個完整的工業過程、完備的研究方法、系統的實驗設計,使學生感受一個完整的知識體系,以及各個階段處理的目的,培養學生看問題、解決問題的系統性和完整性。體現化學知識的應用,體現科學研究的一般規律。
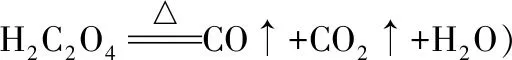
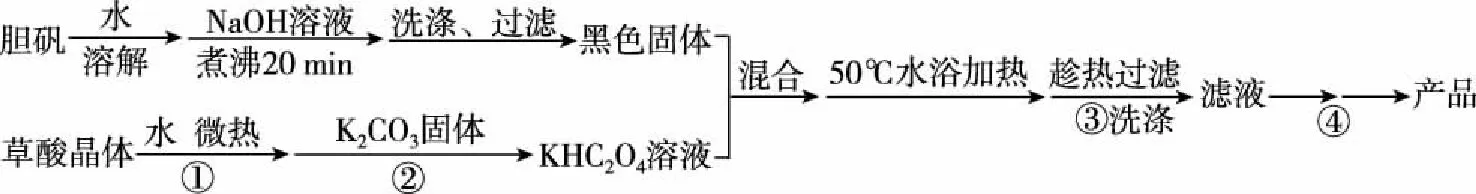
下列說法不正確的是
( )
A.第①步操作要微熱溶解,其原因是適當加快溶解速率并減少H2C2O4的分解
C.步驟③所用的洗滌劑最合適的是冷水
D.步驟②固體K2CO3需適量,防止KHC2O4被消耗
【答案】C
【解析】本題是考查化學工藝流程,盡量展現一個完整的工藝流程,培養學生看待問題的整體意識。A選項,草酸受熱易分解,故A正確;B選項,CuO和KHC2O4反應生成二草酸合銅(Ⅱ)酸鉀晶體和水,故B正確;C選項,根據題中所給信息,二草酸合銅(Ⅱ)酸鉀微溶于冷水,可溶于熱水,微溶于酒精,根據流程,③得到的是濾液,因此所用的洗滌劑應為熱水,故C錯誤;D選項,步驟②K2CO3需適量,原因是K2CO3可以與KHC2O4反應生成K2C2O4,故D正確。
2.注重實驗,側重方法,體現學科特點
①加強了對基礎實驗操作和現象等過程的考查
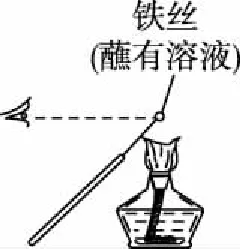
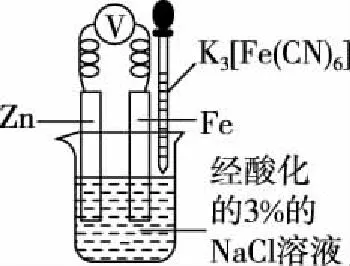
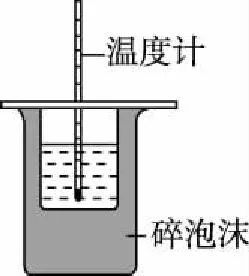
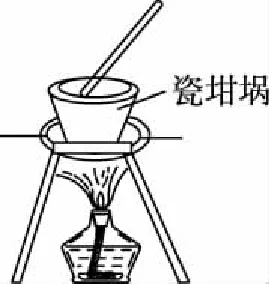
【例2】用下列實驗裝置進行相應實驗,能達到實驗目的的是(夾持裝置未畫出)
( )
甲
乙
丙
丁
A.用裝置甲檢驗NaCl溶液中是否有K+
B.用裝置乙驗證犧牲陽極的陰極保護法
C.用裝置丙進行中和熱的測定
D.用裝置丁加熱熔融Na2CO3固體
【答案】B
【解析】觀察K元素的焰色反應需要透過藍色的鈷玻璃,由圖可知,缺少藍色的鈷玻璃,故A錯誤;Fe為正極,鋅為負極,鐵被保護,屬于犧牲陽極的陰極保護法,故B正確;為了使反應物充分反應,需要環形玻璃攪拌棒,由圖可知,缺少環形玻璃攪拌棒,故C錯誤;瓷坩堝中的二氧化硅與Na2CO3反應,儀器選擇不合理,應使用鐵坩堝,故D錯誤;故選B。
②設置新情境考查實驗技能的遷移能力
命題素材貼近學生學習體驗并適度把教材中實驗情境組合或創新,本例題就很好的將教材上對基礎實驗技能的考查遷移至了考題(氫氣還原氧化銅實驗原理的遷移、實驗安全操作原理的遷移、Fe3+檢驗的遷移、中和滴定終點判斷的遷移),學生若能在解題過程中看出教材的原型,知識的遷移能力會逐漸提升。
【例3】(2018年·全國卷Ⅱ·28,改編)K3[Fe(C2O4)3]·3H2O(三草酸合鐵酸鉀)為亮綠色晶體,可用于曬制藍圖。回答下列問題:
(1)將FeC2O4和H2O2依次加入到K2C2O4溶液中,微熱攪拌至溶液呈亮綠色,并有紅褐色沉淀生成,過濾后將濾液重結晶制備K3[Fe(C2O4)3]·3H2O,請寫出制備方程式:____________________。
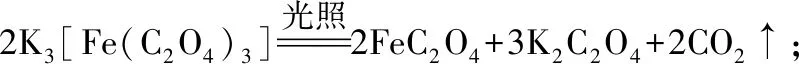
(3)某小組為探究三草酸合鐵酸鉀的熱分解產物,按如圖所示裝置進行實驗。
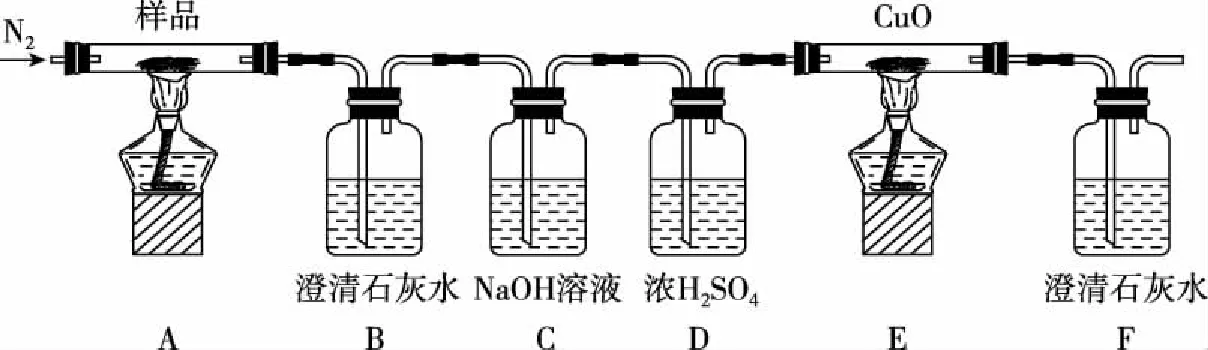
①通入氮氣的目的是________________。
②證明分解產物中有CO2和CO的現象是________________。
③樣品完全分解后,裝置A中的殘留物含有FeO和Fe2O3,檢驗Fe2O3存在的方法是:________________。
(4)測定三草酸合鐵酸鉀中鐵的含量。
①稱量mg樣品于錐形瓶中,溶解后加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至終點。滴定終點的現象是________________。
②向上述溶液中加入過量鋅粉至反應完全后,過濾、洗滌,將濾液及洗滌液全部收集到錐形瓶中。加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至終點,消耗KMnO4溶液VmL。該晶體中鐵的質量分數的表達式為____________________。


(3)①隔絕空氣、使反應產生的氣體全部進入后續裝置
②B中澄清石灰水變渾濁,E中黑色固體變紅且F中出現白色沉淀 ③取少許固體粉末于試管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液變紅色,證明含有Fe2O3

命題通過設計新穎的實驗情境,要求考生根據實驗目的,以問題為導向,將基礎實驗知識、基本操作技能和研究方法與新情境相結合,自主選擇儀器、藥品,設計實驗步驟、推測實驗現象、處理實驗數據、歸納總結得出結論等,在較高層次考查“證據推理與模型認知”“科學探究與創新意識”等學科素養。
【例4】某同學在實驗室實驗時的記錄如下:
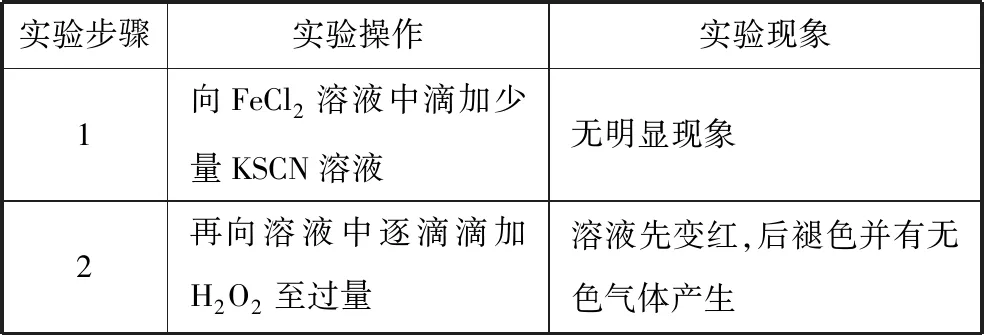
實驗步驟實驗操作實驗現象1向FeCl2溶液中滴加少量KSCN溶液無明顯現象2再向溶液中逐滴滴加H2O2至過量溶液先變紅,后褪色并有無色氣體產生
現對產生現象的原因進行了探究。
[提出假設]
假設一:產生的氣體是O2
假設二:產生的氣體是N2、SO2、CO2等氣體
(1)H2O2與FeCl2酸性溶液反應的離子方程式:____________________。
[實驗設計]課題小組設計如圖實驗裝置驗證假設二氣體成分。
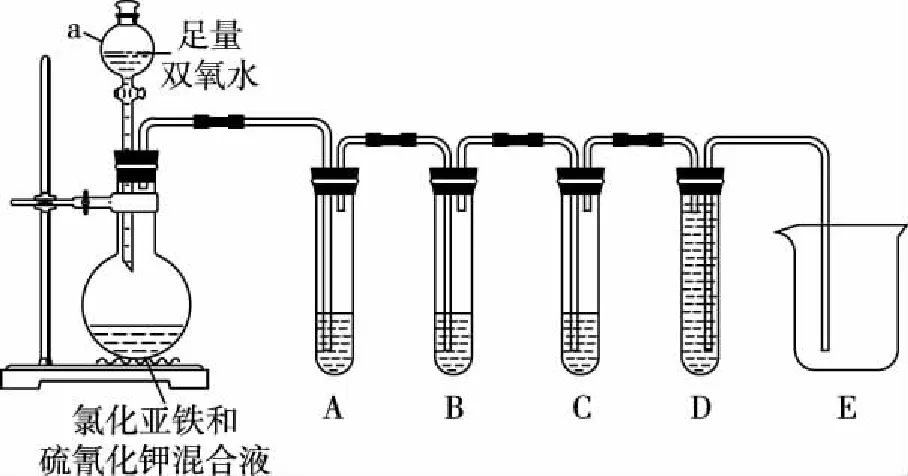
所用試劑:H2O2溶液、FeCl2溶液、KSCN溶液、品紅溶液、KMnO4(H+)溶液、Ca(OH)2溶液、NaOH溶液、蒸餾水。
回答下列問題:
(2)儀器a的名稱是________。
(3)A、B、C、D試管中的試劑分別是________、________、________、________。
(4)氣體中含有CO2的現象是________________。
;
氣體中含有N2的現象是________________。
(5)還原性的強弱順序:Fe2+________(填“>”或“<”)SCN-,理由是________________。
【答案】

(2)分液漏斗
(3)品紅溶液、KMnO4(H+)溶液、Ca(OH)2溶液、NaOH溶液
(4)B中的酸性KMnO4溶液變淺,而C中Ca(OH)2溶液變溶液渾濁 D中NaOH溶液排入到F中
(5)> 向FeCl2和KSCN混合溶液中滴加少量H2O2至過量,溶液先變紅,說明H2O2優先氧化Fe2+

3.關注與化學相關的社會熱點和科技前沿
從試題素材、考核知識點以及情景設置等角度,著力引導學生關注我國社會、經濟和科學技術的發展,弘揚社會主義核心價值觀。通過挖掘歷史文獻和頂級科研論文尋找合適資料,以中國古代科技文明、我國科學家最新研究成果編制試題,體現中國傳統科技文化對人類發展和社會進步的貢獻,引導學生熱愛化學,為國奉獻。減緩因陌生感帶來的難度增加,探究相關物質的結構性質制法很有必要。2018年全國卷Ⅰ部分題目取材背景:
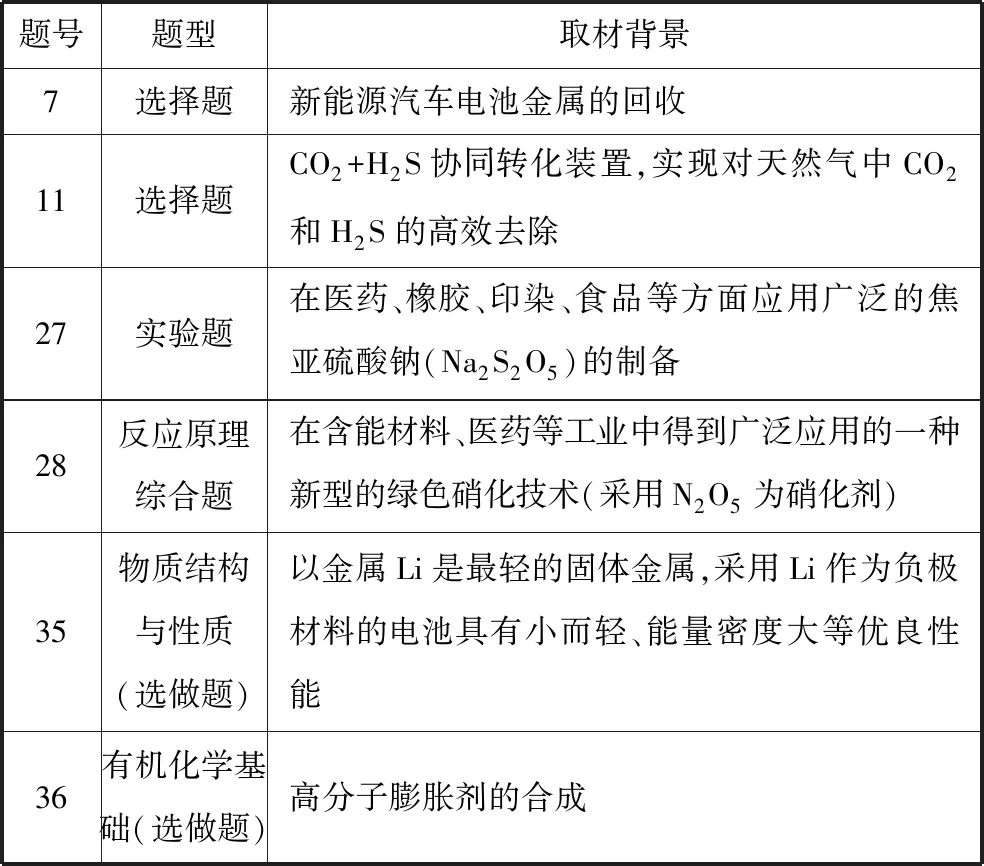
題號題型取材背景7選擇題新能源汽車電池金屬的回收11選擇題CO2+H2S協同轉化裝置,實現對天然氣中CO2和H2S的高效去除27實驗題在醫藥、橡膠、印染、食品等方面應用廣泛的焦亞硫酸鈉(Na2S2O5)的制備28反應原理綜合題在含能材料、醫藥等工業中得到廣泛應用的一種新型的綠色硝化技術(采用N2O5為硝化劑)35物質結構與性質(選做題)以金屬Li是最輕的固體金屬,采用Li作為負極材料的電池具有小而輕、能量密度大等優良性能36有機化學基礎(選做題)高分子膨脹劑的合成
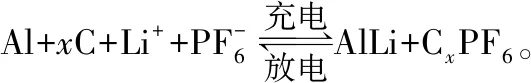
( )

C.充電時,兩個電極增加的質量相等
【答案】D

【例6】2018年11月在法國凡爾賽召開的國際計量大會第26次會議將阿伏加德羅常數的定義修改為“1摩爾包含6.022 140 76×1023個基本單元,這一常數被稱為阿伏加德羅常數,單位mol-1”。基于這一定義,阿伏加德羅常數的不確定度被消除了,新定義將于2019年5月20日正式生效。NA為阿伏加德羅常數的值,下列說法錯誤的是
( )
A.22.4 L(標準狀況)氖氣含有的電子數為10NA
B.0.4 mol NH3與0.6 mol O2在催化劑作用下充分反應,得到NO的分子數為0.4NA
C.27 g Al中加入足量1 mol/L的NaOH溶液,轉移電子數為3NA
D.一定條件下,水蒸氣通過Na2O2使其增重2 g時,反應中轉移的電子數為NA
【答案】B
【解析】A.Ne為單原子氣體,質子數為10,電子數為10,標況下22.4 L氣體的物質的量為1 mol,故其所含電子數為10NA,故A正確;B.氨氣的催化氧化為可逆反應,氨氣不可能完全反應,所以生成的NO的分子數小于0.4NA,故B錯誤;C.27 g Al為1 mol,與NaOH充分反應生成NaAlO2,轉移電子數為3NA,故C正確;D.水蒸氣與Na2O2的反應,生成NaOH和O2,固體增加的重量可看成是H2O中“H2”的質量,增重2 g,參加反應的H2O為1 mol,轉移電子數是NA,故D正確。
4.重用圖表,巧設情境,考查化學素養
化學是信息、能源、材料、生命和環保等科學的重要基礎,化學與生活、生產、科技等領域息息相關。試卷體現了“以化學知識及真實問題為依托,著力考查化學學習能力”的指導思想,許多試題的情境源于社會生活和科技前沿等熱點問題,引導學生認識化學與人類社會和諧發展之間的關系,體現學科價值;體現學以致用;注重考查實踐能力、創新意識和“科學精神與社會責任”的化學素養。
關注《考試大綱》中保留或新增的題型示例的圖表信息,信息圖文符號豐富、陌生情境下信息獲取能力和分析解決能力。所謂無圖不成題,圖表類信息在近幾年高考試題中出現的越來越頻繁,涉及分值不斷加大,對能力要求越來越高。
【例7】炭黑是霧霾中重要的顆粒物,研究發現它可以活化氧分子,生成活化氧,活化過程的能量變化模擬計算結果如圖所示,活化氧可以快速氧化二氧化硫。下列說法錯誤的是
( )
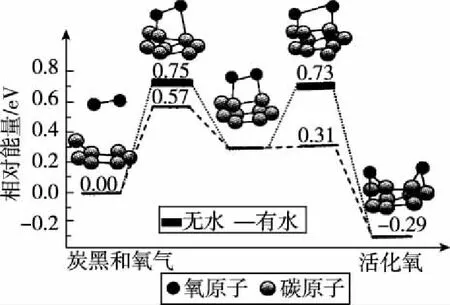
A.氧分子的活化包括O—O鍵的斷裂和C—O鍵的生成
B.每活化一個氧分子放出0.29 eV的能量
C.水可以使氧分子活化反應的活化能降低0.42 eV
D.炭黑顆粒是大氣中二氧化硫轉化為三氧化硫的催化劑
【答案】C
【解析】本題從化學反應勢能圖的角度考查化學反應活性中間體和催化劑的催化過程。由圖可知,炭黑和氧氣在生成活化氧的過程中,活性中間體有C—O鍵的生成,生成活化氧時有O—O鍵斷裂,故A正確;反應物的相對能量為0,活化氧的相對能量為-0.29 eV,所以每活化一個氧分子放出0.29 eV的能量,故B正確;有水參與時(虛線)活化能從0.75 eV降低為0.57 eV,降低值為0.18 eV,故C錯誤;題中信息可以理解成:O2+炭黑→炭黑-2[O]([O]表示活化氧),活化氧可以快速氧化二氧化硫,發生反應:2SO2+炭黑-2[O]→2SO3+炭黑,所以炭黑顆粒是大氣中二氧化硫轉化為三氧化硫的催化劑,故D正確。
5.突出概念、原理的深度理解和應用,注重能力考查
高考命題的出發點是知識,但落腳點是考查獲取知識、鑒別知識的能力和運用知識分析解決實際問題的能力,知識是作為考查能力的載體。試題命制首先確定要考查的能力,然后以實際問題為素材,確定考查的主干知識體系,在此基礎上設置問題情景和設問方式。設問要體現認識、分析和解決實際問題的思維過程、態度、觀點和方法,關注對學生綜合科學素養的考查。
【例8】廢舊光盤金屬層中的少量Ag,某科研小組采用如下方案進行回收(金屬層中其他金屬含量過低,對實驗的影響可忽略)。
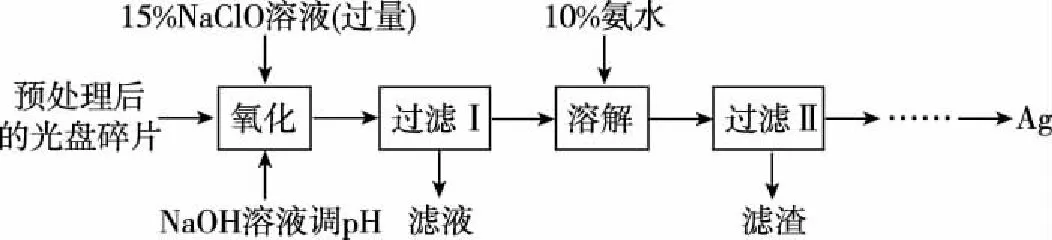

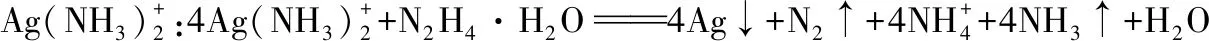
(1)“氧化”階段需在80℃條件下進行,最適宜的加熱方式為____________________。
(2)NaClO溶液與Ag反應的產物為AgCl、NaOH和O2,該反應的化學方程式為____________________;HNO3也能氧化Ag,從反應產物的角度分析,以HNO3代替NaClO的缺點是____________________。
(3)為提高Ag的回收率,需對“過濾Ⅱ”的濾渣進行洗滌,并________________。
(4)從“過濾Ⅱ”后的濾液中獲取單質Ag的過程中,在加入2 mol·L-1水合肼溶液后,后續還需選用的試劑有________(①1 mol·L-1H2SO4、②10%氨水、③1 mol·L-1NaOH溶液,填序號)。反應完全后獲取純凈的單質銀再進行的實驗操作過程簡述為________________________________。
【答案】(1)水浴加熱

(3)將洗滌后的濾液合并入過濾Ⅱ的濾液中
(4)① 過濾、洗滌、干燥


