對氫氧化鋁沉淀圖象問題的深度探究
安徽 張茹英 湯 偉
一道好的經典習題,不僅可以錘煉學生的基礎知識,還可以較好地提升學生的學習能力,但隨著新課標的不斷深化和實施,教學過程中我們還要逐步滲透學科素養,過去僅僅注重知識與能力已經不能夠跟上時代的步伐,一些經典習題可能不再經典,甚至還可能會誤導學生或對學生傳播一些錯誤的、不科學的知識。例如關于Mg2+、Al3+離子在堿性條件下形成沉淀的圖象題可謂“經典”中的“經典”,下面我們重點針對該經典問題做出剖析。
一、問題提出
關于Mg2+、Al3+離子在堿性條件下形成沉淀的圖象問題,目前為止,在各教輔資料中特別常見,筆者做了市場調研,在10個不同教輔資料中均出現了如下相同或類似的習題(看來是因為“經典”,所以大部分編者會選編該試題)。
【“經典”題】1:將一定質量的鎂、鋁混合物投入200 mL稀硫酸中,固體全部溶解后,向所得溶液中加入5 mol·L-1的NaOH溶液,生成沉淀的物質的量與加入NaOH溶液的體積的變化如圖1所示:

圖1
則下列說法不正確的是
( )
A.鎂和鋁的總質量為9 g
B.最初20 mL NaOH溶液用于中和過量的硫酸
C.硫酸的物質的量濃度為2.5 mol·L-1
D.生成的氫氣在標準狀況下的體積為11.2 L
【答案】D
【“經典”題】2:在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量與滴入NaOH溶液的體積關系如圖2所示:

圖2
則原混合液中Al2(SO4)3和MgSO4的物質的量濃度之比為
( )
A.6∶1 B.3∶1 C.2∶1 D.1∶2
【答案】D

圖3
請填寫下列空白:
(1)在該溶液中含有的離子是,它們的物質的量濃度之比為。
(2)所加的淡黃色固體是(化學式)。
(2)Na2O2
分析上面圖象特點,我們可以發現Mg2+、Al3+在共存條件下滴加燒堿溶液,命題者認為二者會同時形成沉淀,事實果真如此嗎?
二、問題剖析
Mg2+、Al3+在共存條件下滴加燒堿溶液,是否能夠同時形成沉淀,我們借助化學的學科觀念“宏觀辨識與微觀探析”、“變化觀念與平衡思想”,借助化學的學科思維“證據推理與模型認知”,憑借化學的學科實踐“科學探究與創新意識”,本著化學的學科價值取向“科學態度與社會責任”,對該類經典的問題做出進一步剖析。因為試題特點一致,涉及反應本質相同,下面我們僅僅針對“經典”題1做出詳細剖析,其他訓練題類推即可。

事實果真如此嗎?
根據定量計算,我們會發現其結果會遠遠超出我們的預料之外。查閱教材,可以得出難溶性電解質的溶度積常數Ksp[Al(OH)3]=1.3×10-33,Ksp[Mg(OH)2]=5.6×10-12,針對上述試題,鎂、鋁混合物溶解于200 mL稀硫酸中,若溶液的體積變化忽略不計,我們容易得出溶液中離子的濃度:c(Al3+) ≈1.0 mol·L-1,c(Mg2+) ≈0.75 mol·L-1,由此我們可以計算出兩種離子開始形成沉淀和完全沉淀時的pH。首先我們可以計算推理得出該溶液各離子開始形成沉淀時的pH。
滴加NaOH溶液的過程中,顯然二者并非同時沉淀。
兩種離子完全形成沉淀時的pH又會是什么樣的結論呢?通常情況下,當離子濃度達到1.0×10-5mol·L-1時,我們一般認為沉淀完全。
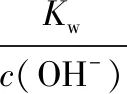
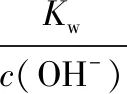
結合以上計算結果,我們可以發現,當鋁離子完全沉淀后,鎂離子還沒有開始沉淀!以上經典的習題常常會錯誤認為滴加NaOH溶液時,二者會同時形成沉淀,于是命題人常常會想當然的編寫出了圖象!
針對Al(OH)3沉淀物,如果繼續滴加NaOH 溶液,二者能夠發生如下反應:Al(OH)3+NaOH=Na[Al(OH)4],此時沉淀又發生溶解,查閱大學教材相關內容,可以得出Al(OH)3沉淀物開始溶解時的pH約為8.0,Al(OH)3沉淀完全溶解時的pH約為12.0。有些大學教材針對鋁鹽溶液中滴加NaOH溶液,溶液的pH與體系中鋁的各種微粒關系給出了如圖4所示的結論:
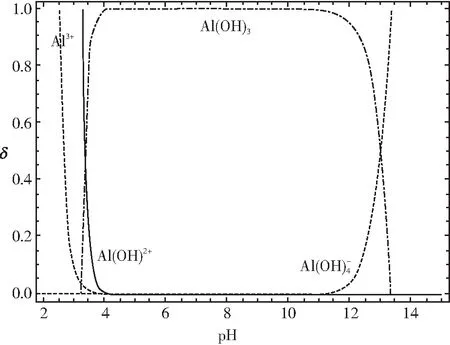
圖4
這與我們上面的定量計算結果基本上是一致的結論。
根據以上的剖析,我們可以進一步推斷得出,上述“經典”題1的沉淀變化曲線應該如圖5所示(或更為復雜):
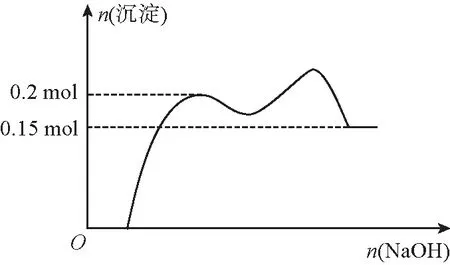
圖5
三、教學建議
經典試題本質上應該通過學生的訓練,達到鞏固基礎知識的同時還能夠進一步提升學生的學科素養和能力,一定不應該傳播錯誤的或偽科學知識。針對以上Mg2+、Al3+在堿性條件下形成沉淀的話題,我們希望在以后的教學過程中,教師不要想當然的選編上述習題供學生訓練,在學生學習過程中讓學生認識到沉淀反應也存在競爭!要能夠辯證的看待該類反應,訓練過程中針對學生的認識層次,可以選編近年來高考出現的類似試題,引導學生分析高考命題者是如何回避該問題的,例如以下幾道高考試題:
2012年安徽高考13題:已知室溫下,Al(OH)3的Ksp或溶解度遠大于Fe(OH)3。向濃度均為0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下面圖6中表示生成Al(OH)3的物質的量與加入NaOH溶液的體積的關系,合理的是
( )
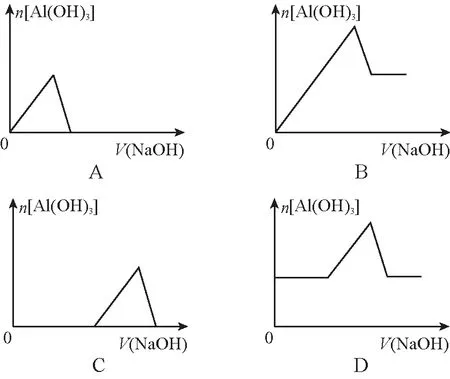
圖6
該試題B、C選項是站在常規的思維模式,考查學生的邏輯推理能力,而命題者在命制該試題時一定考慮了鐵離子、鋁離子共存時滴加NaOH溶液二者沉淀的先后順序問題。
【答案】C
再如下面安徽與廣東的兩道高考試題:
2014年安徽高考13題:室溫下,在0.2 mol·L-1Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1NaOH溶液,實驗測得溶液pH隨NaOH溶液體積變化曲線如圖7所示,下列有關說法正確的是
( )

圖7

B.a~b段,溶液pH增大,Al3+濃度不變
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d點時,Al(OH)3沉淀開始溶解
【答案】C
2009年廣東高考24題:超細氧化鋁是一種重要的功能陶瓷原料。
(1)實驗室常以NH4Al(SO4)2和NH4HCO3為原料,在一定條件下先反應生成沉淀NH4AlO(OH)HCO3,該沉淀高溫分解即得超細Al2O3,NH4AlO(OH)HCO3熱分解的化學反應方程式為。
(2)NH4Al(SO4)2·12H2O的相對分子質量為453。欲配制100mL 、pH為2、濃度約為0.1 mol·L-1的NH4Al(SO4)2溶液,配制過程為:
①用托盤天平稱量NH4Al(SO4)2·12H2O固體g;
②將上述固體置于燒杯中。
(3)在0.1 mol·L-1NH4Al(SO4)2溶液中,鋁各形態的濃度(以Al3+計)的對數(lgc)隨溶液pH變化的關系如圖8所示:

圖8
NaOH溶液調節(2)中溶液pH至7,該過程中發生反應的離子方程式有。

(2)①4.5 ②再向燒杯中加入100 mL蒸餾水,充分攪拌至固體溶解
2014年安徽高考13題是在真實的數字實驗下測定出來的圖象,具有真實性、科學性,2009年廣東高考試題是在理論計算的前提下得出的圖象。仔細研究該試題,我們還能夠看出在不同的pH條件下,鋁元素是以不同微粒形式存在的,命題者這樣設計,才是真正的結論。


