籃狀菌Talaromyces leycettanus JCM12802來源的高溫葡萄糖淀粉酶性質與結構
郭玉杰,涂濤,邱錦,彤麗格,羅會穎,姚斌
?
籃狀菌JCM12802來源的高溫葡萄糖淀粉酶性質與結構
郭玉杰,涂濤,邱錦,彤麗格,羅會穎,姚斌
中國農業科學院飼料研究所,北京 100081

郭玉杰, 涂濤, 邱錦, 等. 籃狀菌Talaromyces leycettanus JCM12802來源的高溫葡萄糖淀粉酶性質與結構. 生物工程學報, 2019, 35(4): 616–625.Guo YJ, Tu T, Qiu J, et al. Characterization and structure of a novel thermostable glucoamylase from Talaromyces leycettanus JCM12802. Chin J Biotech, 2019, 35(4): 616–625.
葡萄糖淀粉酶作為淀粉糖化的關鍵用酶之一,廣泛應用于食品、醫藥和發酵工業等行業。由于整個制糖過程都是在高溫下完成的,因此對葡萄糖淀粉酶的反應溫度和熱穩定性有較高要求。本研究從嗜熱籃狀菌JCM12802中克隆到一個糖苷水解酶第15家族 (GH15) 葡萄糖淀粉酶基因 () 并在畢赤酵母GS115 中實現異源表達。重組葡萄糖淀粉酶GA的最適pH為4.5,在75 ℃下表現出最高酶活。GA熱穩定性好,65 ℃條件下處理1 h剩余70%以上酶活力;70 ℃處理30 min后仍有43%酶活力。GA有較強的離子抗性和寬泛的底物特異性,GA水解可溶性淀粉、支鏈淀粉、糖原、糊精和普魯蘭的比活力分別為 (255.6± 15.3) U/mg、(342.3±24.7) U/mg、(185.4±12.5) U/mg、(423.3±29.3) U/mg和(65.7±8.1) U/mg。從葡萄糖淀粉酶GA的一級結構、二級結構和三級結構3個層面對其進行比較分析,發現一級結構中較少的Gly組成和三級結構中較低的非極性基團溶劑可及表面積可能是維持葡萄糖淀粉酶GA溫度穩定性的主要原因。綜合其性質特點和對結構的分析,葡萄糖淀粉酶GA在工業葡萄糖生產中有較大應用潛力。
籃狀菌,高溫葡萄糖淀粉酶,克隆表達,性質特點,結構分析
葡萄糖淀粉酶 (EC 3.2.1.3) 又稱糖化酶,它能夠從淀粉糖鏈的非還原末端切下葡萄糖分子,是一種典型的外切酶[1]。葡萄糖淀粉酶在食品、醫藥和發酵工業等行業都有廣泛應用[2-4],尤其是對于葡萄糖的生產。葡萄糖的工業生產主要分為淀粉液化和糖化兩步。首先是高溫α-淀粉酶在95–105 ℃、pH 5.5–6.5的條件下將淀粉分解成寡糖和麥芽糖,降低黏度;然后冷卻降溫到60–65 ℃、調整pH至4.0–4.5后,添加葡萄糖淀粉酶分解寡糖和麥芽糖,最終生成葡萄糖[5]。工業生產中所用的α-淀粉酶有極好的溫度穩定性,在95–105 ℃條件下能夠快速完成淀粉的液化。但是葡萄糖淀粉酶的最適反應溫度相對較低,在進行糖化反應之前需要進行降溫處理。提高糖化過程的反應溫度不僅可以減少降溫過程的處理時間,而且還能夠增加底物溶解度,降低底物黏度,有效降低染菌風險和加快反應速率[4]。但是,一直以來糖化酶的最適反應溫度和熱穩定性距離期望值還有一定的差距[6-7],因此高溫葡萄糖淀粉酶的研究一直都備受關注。
目前,工業普遍應用的葡萄糖淀粉酶主要來源于黑曲霉、泡盛曲霉和米根霉等絲狀真菌。這些葡萄糖淀粉酶在碳水化合物活性酶 (Carbohydrate- active enzymes, CAZy) 數據庫中屬于GH15家族。在三維結構上,它們通常含有一個催化域(Catalytic domain, CD) 和一個淀粉結合域 (Starch- binding domain, SBD);兩個結構域之間通過富含-糖基化的Linker連接,也有一些葡萄糖淀粉酶只存在催化域[8]。糖化酶的催化區域是一個通過(α/α)6形成的漏斗狀活性中心,主要負責底物的水解[9];淀粉結合域可以有效地結合淀粉顆粒協同催化域水解不溶性底物,它通常位于葡萄糖淀粉酶的C端,但是來源于稻根霉菌葡萄糖淀粉酶的SBD位于其催化結構域的N端[10]。有關葡萄糖淀粉酶結構的研究起始較早,當前被PDB (Protein Data Bank) 數據庫收錄的葡萄糖淀粉酶晶體結構有很多[11],但是早期報道的葡萄糖淀粉酶結構只有催化結構域。Li等[12]對紅褐肉座菌來源的葡萄糖淀粉酶HjGA進行了晶體結構的解析,成功報道了第一個涵蓋了催化域、淀粉結合域和連接域完整的葡萄糖淀粉酶的晶體結構 (2VN4)。近來,工業上應用最廣泛的3種葡萄糖淀粉酶HrGA、PoGA和AnGA完整的晶體結構也相繼被成功解析并報道[13]。以上研究主要分析了葡萄糖淀粉酶整體的結構特點及其與催化底物反應的關系,針對其與溫度穩定性相關的結構分析尚未見報道。由于高溫葡萄糖淀粉酶資源相對匱乏和與溫度穩定性相關的結構特點尚不清楚,當前提高葡萄糖淀粉酶溫度穩定性的研究主要通過定向進化的方法[14-15]。該方法需要建立龐大的突變體庫,篩選過程耗時較長且工作量大。因此,新穎高溫葡萄糖淀粉酶的基因資源挖掘和結構特點的分析對于高溫葡萄糖淀粉酶的研究具有重要意義。
嗜熱真菌是高溫葡萄糖淀粉酶的重要來源之一[5],目前報道的產葡萄糖淀粉酶的嗜熱真菌有籃狀菌屬[16]、嗜熱真菌屬[17]和毛殼菌屬[18]等。JCM12802的最適生長溫度為40 ℃,屬于典型的嗜熱真菌。該真菌來源的眾多酶資源已被發掘和研究,且大多具有較高的溫度特性,例如淀粉酶、木聚糖酶、葡聚糖酶、甘露聚糖酶和果膠酶等[19-23]。本研究中,我們從嗜熱真菌JCM12802基因組中檢索到一個葡萄糖淀粉酶基因,并命名為。將其成功克隆后在畢赤酵母中進行高效異源表達和基本性質研究,發現其具有較高的反應溫度和溫度穩定性,在工業葡萄糖生產中有較大應用潛力。最后,我們針對高溫葡萄糖淀粉酶GA的結構特點進行了初步分析,為今后的突變研究提供了思路。
1 材料與方法
1.1 菌株、載體及試劑
菌株JCM12802購自日本微生物保藏中心 (Japan Collection of Microorganisms, JCM),活化和培養所選用的培養基均為馬鈴薯葡萄糖培養基 (PDA),培養溫度為40 ℃。用于基因克隆的載體為pEASY-T3,宿主菌為大腸桿菌Trans-T1,均購自北京全式金生物技術有限公司。葡萄糖淀粉酶基因的表達載體為pPIC9,表達宿主為畢赤酵母GS115。試驗中所用的總RNA 提取試劑盒和反轉錄試劑盒分別購自天根生化科技有限公司和東洋紡生物科技有限公司;DNA高保真聚合酶FastPfu Fly購自北京全式金生物技術有限公司;質粒提取試劑盒購自Omega,限制性內切酶均購自NEB。用于酶活測定的可溶性淀粉、支鏈淀粉、直鏈淀粉、糖原、糊精、普魯蘭酶、α-環糊精、β-環糊精、γ-環糊精等底物均購自Sigma-Aldrich。其他常見化學試劑均為分析純。
1.2 培養基的配制
實驗中所用的培養基有馬鈴薯葡萄糖固體培養基 (PDA)、馬鈴薯葡萄糖液體培養基 (PDB)、LB液體培養基、LB固體培養基、MD固體培養基、BMGY培養基、BMMY培養基和YPD培養基。其詳細制備方法可參照文獻[24]。
1.3 基因序列信息的獲取及分析
根據JCM12802的全基因組測序結果,查找到一個GH15家族葡萄糖淀粉酶基因并命名為,然后對該基因進行生物信息學分析。將葡萄糖淀粉酶GA的基因序列通過Blast (http://blast.ncbi.nlm.nih.gov/Blast/) 檢索同源序列,從而對該基因的新穎性進行評估,然后提交Softberry (http://linux1.softberry.com/ berry.phtml),對基因的內含子和外顯子進行預測。利用Vector NTI Advance 10.0軟件將基因序列翻譯成氨基酸序列后,并分析其編碼蛋白質的序列長度、等電點和分子量等信息。利用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/) 預測其編碼蛋白質的信號肽序列。
1.4 葡萄糖淀粉酶基因Tlga15A的克隆與畢赤酵母表達載體構建
將菌株JCM12802在40 ℃搖瓶培養活化,48 h后轉接以淀粉為唯一碳源的誘導培養基中培養3–4 d,12 000 r/min離心收集菌體。根據總RNA 提取試劑盒使用說明提取菌體的總RNA,然后參照東洋紡ReverTra Ace-a-TM kit反轉錄試劑盒方法,將RNA反轉錄合成cDNA。通過分析基因的全長序列和編碼的成熟氨基酸序列,去除信號肽序列后,設計分別含有RⅠ和Ⅰ酶切位點的引物GAF (5′-GGGGAAT TCGCACCACAGCCTGTGCTTCCCAGAG-3′) 和GAR (5′-GGGGCGGCCGCCTATCTCCAGGTAT CGTTCTCCGTC-3′),然后以cDNA為模板進行PCR擴增。將擴增產物用RⅠ和Ⅰ雙酶切后連入pPIC9載體轉化Trans1-T1大腸桿菌感受態,挑選陽性克隆并測序驗證。
1.5 葡萄糖淀粉酶TlGA的表達與純化
將經測序驗證正確的表達載體pPIC9_用限制性內切酶Ⅰ線性化處理,電擊轉入畢赤酵母GS115感受態細胞中;將轉化子涂布組氨酸缺陷型的MD平板于30 ℃培養箱培養2 d,然后挑取48個單克隆菌落于3 mL BMGY液體培養基中培養 (30 ℃、250 r/min),培養2 d后4 500 r/min離心5 min,棄上清培養基并收集菌體,然后重懸于1.0 mL的 BMMY誘導培養基中誘導培養2 d。最后,通過酶活檢測挑選出活性最高的克隆子進行搖瓶放大培養。
將篩選的高酶活轉化子用YPD培養基活化后接種于300 mL BMGY液體培養基中,接種量為1% (/)。30 ℃條件下培養48 h后,4 500 r/min離心5 min收集菌體,轉入200 mL含有0.5%甲醇的BMMY液體培養基繼續培養48 h,期間每隔12 h補加1 000 μL甲醇,使甲醇終濃度控制在0.5%左右。
培養結束后,將粗酶液1 2000 r/min離心10 min收集上清液,并用截留分子量為10 kDa的膜包(Vivascience) 濃縮至10 mL,然后于pH 6.5、10 mmol/L檸檬酸-磷酸鹽緩沖液中過夜透析。將透析處理的酶液通過陰離子交換層析 (HiTrap Q XL) 進行純化,獲得單一組分的目的蛋白。將純化后的蛋白用Endo H (NEB) 處理去除-糖基化修飾。最后,將純化后的蛋白與去除-糖基化修飾的蛋白進行SDS-PAGE分析。
1.6 TlGA的酶活力測定及性質研究
葡萄糖淀粉酶GA活力測定所使用的底物為1%可溶性淀粉,在由900 μL底物和100 μL的酶液組成的反應體系中 (pH 4.5),75 ℃條件下反應30 min,使用3,5-二硝基水楊酸 (DNS) 法檢測還原糖生成量[25],每分鐘產生1 μmol葡萄糖所需要的酶量即為一個酶活力單位,符號為U/mL。
測定葡萄糖淀粉酶的最適pH時,將純化的葡萄糖淀粉酶GA分別置于不同pH的反應環境中,75 ℃條件下反應30 min,然后測定還原糖的生成量,分別計算不同pH條件下的酶活,其中酶活最高時對應的pH值即為該酶的最適pH。pH穩定性的測定方法為將純化的酶液調至在pH 1.0–12.0范圍內,37 ℃下孵育1 h,然后于pH 4.5條件下75 ℃反應30 min 測定其剩余酶活,計算不同pH處理下的相對剩余酶活。
葡萄糖淀粉酶GA最適溫度測定方法為將純化的酶用pH 4.5的檸檬酸-磷酸氫二鈉緩沖溶液 (50 mmol/L) 稀釋到合適的濃度,添加到相同pH的底物溶液中;分別檢測其在30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、75 ℃、80 ℃、85 ℃條件下酶活力,其中酶活最高時的反應溫度即為該酶的最適反應溫度。將純化的葡萄糖淀粉酶分別在60 ℃、65 ℃和70 ℃條件下孵育2–60 min不同時間,然后測定其剩余酶活。以0 ℃處理的樣品為參照 (100%),分別計算不同溫度條件下處理不同時間后樣品的剩余酶活。
1.7 不同金屬離子和化學試劑對葡萄糖淀粉酶TlGA活力的影響
Na+、K+、Ag+、Cu2+、Mg2+、Mn2+、Ca2+、Ni2+、Pb2+、Zn2+、Fe3+、Cr3+、SDS、EDTA和-巰基乙醇等金屬離子及化學試劑對GA活力的影響。在酶促反應體系中加入以上金屬離子和化學試劑,使其終濃度為5 mmol/L。然后,在標準反應條件下測定葡萄糖淀粉酶活力;以未添加任何試劑的反應體系為對照組;最終,計算金屬離子及化學試劑對酶活性的影響,每組試劑設置3個平行反應。
1.8 TlGA的酶學動力學及底物特異性研究
用pH 4.5的檸檬酸-磷酸氫二鈉緩沖溶液配制濃度為1–10 mg/mL不等的可溶性淀粉,糊化后作為反應底物。然后在pH 4.5、75 ℃條件下反應5 min并測定不同底物濃度下的酶活。將酶活數據使用GraphPad Prism 5.01進行處理分析。
分別選取支鏈淀粉、糖原、普魯蘭、糊精、直鏈淀粉、α-環糊精、β-環糊精、γ-環糊精為底物,用pH 4.5的檸檬酸-磷酸氫二鈉緩沖溶液配制濃度為5 mg/mL。將酶液稀釋到合適的濃度后,分別測定葡萄糖淀粉酶GA對不同底物在75 ℃條件下的酶活力。以可溶性淀粉為底物時的酶活為100%,分別計算其他底物的相對酶活力。
1.9 TlGA同源建模與結構分析
為了探究葡萄糖淀粉酶GA的高溫機制和與之對應的結構特點,需要通過同源建模的方法獲得葡萄糖淀粉酶GA三維結構。首先,將GA的氨基酸序列輸入PDB數據進行檢索;其次,綜合考慮一致性和覆蓋度兩個指標挑選適合的模板;最后,利用軟件Discovery Studio 2017進行三維結構的預測和構建。
2 結果與分析
2.1 葡萄糖淀粉酶基因Tlga15A的克隆與序列分析
從JCM12802成功克隆葡萄糖淀粉酶編碼基因并提交GenBank數據庫,序列注冊號為MH730064。該基因全長為2 186 bp,包含4個內含子,長度分別為88 bp、57 bp、66 bp和64 bp。葡萄糖淀粉酶基因的cDNA全長為1 911 bp,能夠編碼636個氨基酸。對其編碼的氨基酸序列進行信號肽預測分析結果表明,其N端的前20個氨基酸殘基是其信號肽序列。成熟肽部分的理論分子量為63.3 kDa,預測等電點為4.76。網站預測有3個潛在的-糖基化修飾位點,分別為N183、N443和N572。葡萄糖淀粉酶GA的氨基酸序列與絲衣霉來源的葡萄糖淀粉酶GAD95639最為相似,一致性為76%;與已報道過性質的葡萄糖淀粉酶P69328[26]的序列一致性為70.6%;并與來源于泡盛曲霉的葡萄糖淀粉酶晶體結構1GAI_A的序列一致性為75%。
2.2 葡萄糖淀粉酶TlGA同源建模與結構分析
在PDB數據庫中,GA與泡盛曲霉來源的葡萄糖淀粉酶晶體結構1GAI_A有最高的序列一致性 (75%),但是覆蓋度僅有74%;而與黑曲霉來源的葡萄糖淀粉酶晶體結構6FRV_A的序列一致性為70%,其覆蓋度可高達95%。因此,我們以1GAI_A和6FRV_A同時作為模板進行同源建模。從結構上來看 (圖1),GA由2個結構域組成:底物結合域 (SBD) 和催化結構域 (CD),二者之間為連接域 (Linker)。從序列比對的結果來看,GA的底物結合域屬于CBM20,位于葡萄糖淀粉酶的C-末端。該區域在序列上富含苯丙氨酸、酪氨酸和色氨酸等芳香族氨基酸殘基,其二級結構主要是由7段β-折疊片反向平行折疊形成的β-卷筒結構。葡萄糖淀粉酶催化域含有440個氨基酸殘基,是由13股α-螺旋組成的 (α/α)6桶狀結構。Glu188和Glu409組成葡萄糖淀粉酶催化中心,Glu188作為質子供體將H+傳遞給淀粉鏈中易斷裂鍵的糖苷鍵上形成含氧碳正離子,然后水分子在Glu409協助下發起親核攻擊,從而使糖苷鍵斷裂。葡萄糖淀粉酶的連接域是一段高度-糖基化的多肽鏈,長度為73個氨基酸。該區域富含Ser和Thr殘基并且容易發生-糖基化。糖基化作用能夠有效穩定蛋白質骨架,避免蛋白酶水解,增強糖化酶親和力和增加糖化酶熱穩定性等作用。

圖1 TlGA的三維結構
2.3 重組葡萄糖淀粉酶TlGA的表達和純化
將轉化了基因的GS115畢赤酵母菌株進行搖瓶發酵,獲得粗酶液后進行濃縮、純化和SDS-PAGE分析。結果顯示GA的目的條帶大小為75 kDa (圖2A),Endo H酶處理后,目的條帶有輕微減小,但仍舊比63.3 kDa的理論分子量大。可能的原因是連接催化域 (CD) 和底物結合域 (CBM) 的Linker區存在大量的糖基化位點,從而導致電泳條帶遠大于理論分子量。為了進一步確認純化得到的蛋白是編碼葡萄糖淀粉酶GA的目標蛋白,將條帶進行質譜檢測,檢測結果顯示有5個片段能與目的序列完全匹配,其覆蓋度為39% (圖2B)。質譜結果充分證明了75 kDa附近的蛋白條帶是目的蛋白。

2.4 酶學性質的分析
與多數真菌來源的葡萄糖淀粉酶相似,GA在酸性條件下有較高的酶活力。其最適pH為4.5 (圖3A),在pH 3.0–5.5范圍內保持40%以上的酶活力;在pH 7.0的中性條件和堿性條件下葡萄糖淀粉酶完全喪失活力。葡萄糖淀粉酶GA在較寬的pH范圍內均能保持穩定,在pH 3.0–9.0范圍內37 ℃處理1 h,都有80%以上的剩余酶活 (圖3B)。在40–75 ℃的溫度范圍內,重組的葡萄糖淀粉酶GA隨著反應溫度升高,糖化酶活性逐步增加,75 ℃時達到最高酶活力;當反應溫度超過75 ℃時,酶活驟降;反應溫度為80 ℃時,僅有不到20%的酶活 (圖3C)。GA具有較好的熱穩定性,65 ℃處理1 h,酶活損失在30%以內;70 ℃條件下處理30 min,仍有43%的剩余酶活;75 ℃條件下處理5 min的剩余酶活約為40% (圖3D)。
2.5 金屬離子及化學試劑對酶活的影響
盡管很多α-淀粉酶都存在金屬離子激活效應,但是一些常見的離子對葡萄糖淀粉酶GA促進作用并不明顯。Na+、Ca2+、Cu2+和Zn2+對葡萄糖淀粉酶有一定的促進作用;而Ag+(62.2%)、Mn2+(82.2%)、-Mercaptoeth (61.8±0.98)、EDTA (89.7±1.41) 和SDS (24.3±0.75) 能有效抑制其酶活力 (表1)。
2.6 底物特異性及動力學分析
純化的葡萄糖淀粉酶GA以可溶性淀粉為底物時,在75 ℃、pH 4.5的條件下的比活力為(255.6±15.3) U/mg;m值為(1.79±0.11) mg/mL,max值為(276.0±3.5) μmol/(min·mg)。葡萄糖淀粉酶GA不僅可以高效地催化可溶性淀粉的水解,對其他底物也表現出較高的水解活性。對支鏈淀粉、糖原、糊精、普魯蘭的比活力分別為(342.3±24.7) U/mg、(185.4±12.5) U/mg、(423.3±29.3) U/mg和(65.7±8.1) U/mg (表2)。對于直鏈淀粉、α-環糊精、β-環糊精、γ-環糊精等底物未檢測到活性。

圖3 TlGA的基本酶學性質(A:最適pH;B:pH穩定性;C:最適溫度;D:溫度穩定性)

表1 金屬離子及化學試劑對TlGA活性的影響
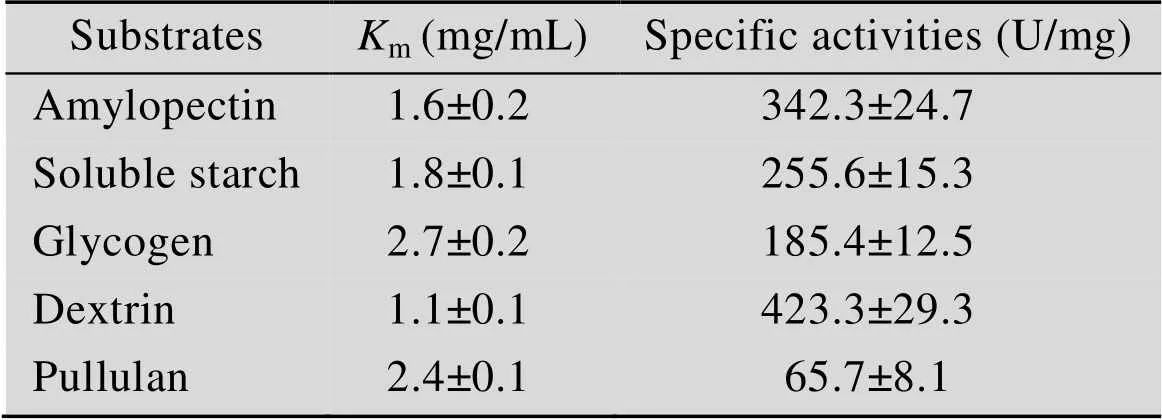
表2 TlGA對不同底物的Km和比活力
3 討論
工業制糖過程通常是在較高的溫度條件下完成的,因此要求葡萄糖淀粉酶要有較高的溫度穩定性。目前黑曲霉的葡萄糖淀粉酶AnGA應用最為廣泛[4,27],其最適反應溫度為65–70 ℃,通常在60 ℃條件下能夠保持穩定[4]。在本研究中,從嗜熱真菌JCM12802中獲得了一個高溫葡萄糖淀粉酶GA,其最適溫度為75 ℃,65 ℃處理1 h仍剩余70%以上的酶活,在最適溫度和溫度穩定性上優于當前工業上廣泛應用的葡萄糖淀粉酶。通常真菌來源的葡萄糖淀粉酶溫度穩定性較差[8],而嗜熱真菌一直以來都是高溫糖化酶的重要來源之一[28]。Nielsen等從嗜熱真菌克隆了一個耐熱葡萄糖淀粉酶基因,并在黑曲霉中進行了表達[16]。該葡萄糖淀粉酶的最適溫度為70 ℃,低于來源的葡萄糖淀粉酶GA (75 ℃);但是二者在溫度穩定性方面差距并不明顯,可能的原因是由表達宿主差異導致糖基化程度不同造成的。結合高溫葡萄糖淀粉酶GA的性質特點,以低溫葡萄糖淀粉酶AmyT1[29]和中溫葡萄糖淀粉酶HjGA[12]為參照,從蛋白的一級結構、二級結構和三級結構這3個層面進行了比較分析。
分析葡萄糖淀粉酶一級結構時,主要從特殊氨基酸組成、-糖基化位點和形成二硫鍵數目這3個特點進行比較分析。Arg和Pro在3種不同葡萄糖淀粉酶序列中出現的頻率差異不大,但是Gly在GA中所占的比例明顯低于HjGA和AmyT1 (表3)。Gly作為柔性最強的氨基酸,它在蛋白分子中出現的頻率與整個蛋白分子的柔性密切相關,這在以往的研究中已被廣泛證實[30]。根據報道,蛋白的糖基化程度和二硫鍵數目也與其穩定性密切相關[31,32];我們對其進行了比較分析,發現在不同葡萄糖淀粉酶分子的-糖基化位點與其溫度特點沒有明顯規律;但是在二硫鍵組成方面,低溫葡萄糖淀粉酶AmyT1和中溫葡萄糖淀粉酶HjGA均有4對二硫鍵,而高溫葡萄糖淀粉酶GA僅有3對。眾所周知,二硫鍵是維持蛋白酶穩定的重要作用力;在蛋白的熱穩定性改良時,引入二硫鍵也是一個重要的策略。但是在高溫葡萄糖淀粉酶GA材料中二硫鍵缺失的生物學意義尚不清楚。因此,從氨基酸組成上來看,低頻率的Gly是葡萄糖淀粉酶GA高溫耐受性的重要原因之一。

表3 葡萄糖淀粉酶TlGA、HjGA、AmyT1的結構比較
蛋白的二級結構原件主要包括α-螺旋、β折疊和無規則卷曲,蛋白二級結構的組成往往會影響蛋白整體的穩定性[30]。因此,我們對高溫葡萄糖淀粉酶GA、中溫葡萄糖淀粉酶HjGA和低溫葡萄糖淀粉酶AmyT1的二級結構進行了統計。從結果可以看出,高溫葡萄糖淀粉酶GA在二級結構組成和占比上與HjGA和AmyT1沒有明顯差異 (表3)。可能的原因是3種葡萄糖淀粉酶在序列上有很高的相似性,從而其二級結構的差異也不明顯。因此,從二級結構層面并不能很好地解釋葡萄糖淀粉酶GA的高溫機制。
在三級結構層面上,我們主要分析不同葡萄糖淀粉酶分子的溶劑可及表面積并比較它們的差異。與中溫葡萄糖淀粉酶HjGA和低溫葡萄糖淀粉酶AmyT1相比,高溫葡萄糖淀粉酶GA的非極性殘基的溶劑可及表面積明顯小于HjGA和AmyT1 (表3)。疏水作用力是維持蛋白質三級結構穩定的主要因素,因此,過多的疏水殘基暴露在溶劑環境是影響蛋白穩定的重要原因。非極性殘基的溶劑可及表面積越小,整個蛋白分子在三級結構上越穩定。因此,從氨基酸組成上來看,較小的非極性殘基的溶劑可及表面積是葡萄糖淀粉酶GA高溫耐受性的又一重要原因。
綜上所述,本研究獲得了一個新穎的高溫葡萄糖淀粉酶基因,并在畢赤酵母中成功進行了高效表達。該葡萄糖淀粉酶有較高的最適反應溫度和溫度穩定性,同時對普魯蘭有較好的降解活性。這些特點使其在工業制糖中有很好的應用前景。另外,我們分析了GA的結構特點,對葡萄糖淀粉酶的分子改造具有重要的指導意義。
[1] Sauer J, Sigurskjold BW, Christensen U, et al. Glucoamylase: structure/function relationships, and protein engineering. Biochim Biophys Acta, 2000, 1543(2): 275–293.
[2] Nguyen QD, Rezessy-Szabó JM, Claeyssens M, et al. Purification and characterisation of amylolytic enzymes from thermophilic fungusstrain ATCC 34626. Enzyme Microb Technol, 2002, 31(3): 345–352.
[3] Pandey A, Nigam P, Soccol CR, et al. Advances in microbial amylases. Biotechnol Appl Biochem, 2000, 31: 135–152.
[4] Kumar P, Satyanarayana T. Microbial glucoamylases: characteristics and applications. Crit Rev Biotechnol, 2009, 29(3): 225–255.
[5] Saha BC, Zeikus JG. Microbial glucoamylases: biochemical and biotechnological features. Starch-Starke, 1989, 41(2): 57–64.
[6] Liu Y, Li QS, Zhu HL, et al. Purification and characterization of two thermostable glucoamylases produced fromB-30. Chem Res Chin Univ, 2013, 29(5): 917–923.
[7] Wu J, Duan XG. Research progress of enzymes involved in starch processing. J Chin Inst Food Sci Technol, 2015, 15(6): 14–25 (in Chinese). 吳敬, 段緒果. 淀粉加工用酶研究進展. 中國食品學報, 2015, 15(6): 14–25.
[8] Hostinová E, Ga?perík J. Yeast glucoamylases: molecular-genetic and structural characterization. Biologia, 2010, 65(4): 559–568.
[9] Coutinho PM, Reilly PJ. Glucoamylase structural, functional, and evolutionary relationships. Proteins, 1997, 29(3): 334–347.
[10] Lin SC, Liu WT, Liu SH, et al. Role of the linker region in the expression ofglucoamylase. BMC Biochem, 2007, 8(1): 9.
[11] Li ZL, Wei PY, Cheng HR, et al. Functional role of β domain in theglucoamylase. Appl Microbiol Biotechnol, 2014, 98(5): 2091–2099.
[12] Bott R, Saldajeno M, Cuevas W, et al. Three-dimensional structure of an intact glycoside hydrolase family 15 glucoamylase from. Biochemistry, 2008, 47(21): 5746–5754.
[13] Roth C, Moroz OV, Ariza A, et al. Structural insight into industrially relevant glucoamylases: flexible positions of starch-binding domains. Acta Crystallogr Sect D Struct Biol, 2018, 74(5): 463–470.
[14] McDaniel A, Fuchs E, Liu Y, et al. Directed evolution ofglucoamylase to increase thermostability. Microb Biotechnol, 2008, 1(6): 523–531.
[15] Wang Y, Fuchs E, da Silva R, et al. Improvement ofglucoamylase thermostability by directed evolution. Starch-Starke, 2006, 58(10): 501–508.
[16] Nielsen BR, Lehmbeck J, Frandsen TP. Cloning, heterologous expression, and enzymatic characterization of a thermostable glucoamylase from. Protein Express Purif, 2002, 26(1): 1–8.
[17] Thorsen TS, Johnsen AH, Josefsen K, et al. Identification and characterization of glucoamylase from the fungus. Biochim Biophys Acta, 2006, 1764(4): 671–676.
[18] Chen J, Zhang YQ, Zhao CQ, et al. Cloning of a gene encoding thermostable glucoamylase fromand its expression in. J Appl Microbiol, 2007, 103(6): 2277–2284.
[19] Wang XY, Ma R, Xie XM, et al. Thermostability improvement of axylanase by rational protein engineering. Sci Rep, 2017, 7(1): 15287.
[20] Shuai Y, Tao T, Zhang L, et al. Improvement of the thermostability and catalytic efficiency of a highly active β-glucanase fromJCM12802 by optimizing residual charge-charge interactions. Biotechnol Biof, 2016, 9(1): 124.
[21] Zhang DD, Tu T, Wang Y, et al. Improving the catalytic performance of aα-amylase by changing the linker length. J Agric Food Chem, 2017, 65(24): 5041–5048.
[22] Wang CH, Luo HY, Niu CF, et al. Biochemical characterization of a thermophilic β-mannanase fromJCM12802 with high specific activity. Appl Microbiol Biotechnol, 2015, 99(3): 1217–1228.
[23] Li YQ, Wang Y, Tu T, et al. Two acidic, thermophilic GH28 polygalacturonases fromJCM 12802 with application potentials for grape juice clarification. Food Chem, 2017, 237: 997–1003.
[24] Li XL, Tu T, Yao B, et al. A novel bifunctional xylanase/cellulaseXyn10A fromJCM12803. Chin J Biotech, 2018, 34(12): 1996–2006 (in Chinese). 李曉麗, 涂濤, 姚斌, 等. 嗜熱子囊菌JCM12803來源的雙功能木聚糖/纖維素酶. 生物工程學報, 2018, 34(12): 1996–2006.
[25] Miller GL. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal Chem, 1959, 31(3): 426–428.
[26] Svensson B, Larsen K, Gunnarsson A. Characterization of a glucoamylase G2 from. Eur J Biochem, 1986, 154(3): 497–502.
[27] Rezaul Karim KM, Husaini A, Hossain MA, et al. Heterologous, expression, and characterization of thermostable glucoamylase derived fromNSH9 in. BioMed Res Int, 2016, 2016: 5962028.
[28] Ben Abdelmalek-Khedher I, Urdaci MC, Limam F, et al. Purification, characterization, and partial primary sequence of a major-maltotriose-producing α-amylase, ScAmy43, from. J Microbiol Biotechnol, 2008, 18(9): 1555–1563.
[29] Carrasco M, Alcaíno J, Cifuentes V, et al. Purification and characterization of a novel cold adapted fungal glucoamylase. Microb Cell Factor, 2017, 16(1): 75–85.
[30] Vieille C, Zeikus GJ. Hyperthermophilic enzymes: sources, uses, and molecular mechanisms for thermostability. Microbiol Mol Biol Rev, 2001, 65(1): 1–43.
[31] Fonseca-Maldonado R, Vieira DS, Alponti JS, et al. Engineering the pattern of protein glycosylation modulates the thermostability of a GH11 xylanase. J Biol Chem, 2013, 288(35): 25522–25534.
[32] Min R, Li JF, Gao SJ, et al. Correlation between thermostability of the xylanaseXyn11TSand its N-terminal disulfide bridge. Acta Microbiol Sin, 2013, 53(4): 346–353 (in Chinese). 閔柔, 李劍芳, 高樹娟, 等. 木聚糖酶Xyn11TS耐熱性與其N端二硫鍵的相關性分析. 微生物學報, 2013, 53(4): 346–353.
Characterization and structure of a novel thermostable glucoamylase fromJCM12802
Yujie Guo, Tao Tu, Jin Qiu, Lige Tong, Huiying Luo, and Bin Yao
Feed Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081, China
Glucoamylase is a critical ingredient for saccharification in the starch decomposition, and widely used in food, pharmaceutical and fermentation industries. Glucoamylases are usually thermostable and have peak activities at high temperature, as required for the industrial process of glucose production. In this study, a glucoamylase gene belonging to the glycoside hydrolase (GH) family 15,, was cloned fromJCM12802, and successfully expressed inGS115. Recombinant glucoamylaseGA showed optimal activities at pH 4.5 and 75 °C. The result of thermostability analysis showed thatGA retained above 70% activity after incubating for 1 h at 65 °C, and 43% residual activity after 30 min at 70 °C. Moreover,GA had high resistance to most metal ions and chemical reagents tested. Various starch substrates could be hydrolyzed byGA, including soluble starch (255.6±15.3) U/mg, amylopectin (342.3± 24.7) U/mg, glycogen (185.4±12.5) U/mg, dextrin (423.3±29.3) U/mg and pullulan (65.7±8.1) U/mg. The primary, secondary and tertiary structures of glucoamylase were further analyzed. The low ratio of Glyin the primary structure and low exposed nonpolarity solvent accessible surface in the tertiary structure may be the main reasons forGA’s thermostability. These results show thatGA is great promising for potential use in the commercial production of glucose syrups. Moreover, this research will provide knowledge and innovating ideas for the improvement of glucoamylase thermostability.
,thermostable glucoamylase, cloning and expression, characterization, structural analysis
10.13345/j.cjb.180330
August 15, 2018;
November 7, 2018
The Collaborative Innovation Project of Chinese Academy of Agricultural Sciences (No. CAAS-463 XTCX2016011-04-5).
Bin Yao. Tel: +86-10-82106065; E-mail:binyao@caas.cn
中國農業科學院協同創新項目 (No. CAAS-463 XTCX2016011-04-5) 資助。
2018-11-26
http://kns.cnki.net/kcms/detail/11.1998.Q.20181122.1104.002.html
(本文責編 郝麗芳)

