基于β-catenin/Lef1相互作用為靶標的新型抗腫瘤藥物高通量篩選模型的建立
陳云雨,牛夏憶,李妍,劉曉平
?
基于β-catenin/Lef1相互作用為靶標的新型抗腫瘤藥物高通量篩選模型的建立
陳云雨1,2,牛夏憶1,李妍3,劉曉平1
1 皖南醫學院 藥學院 新藥篩選與評價中心,安徽 蕪湖 241002 2 中國科學院 長春應用化學研究所 化學生物學實驗室,吉林 長春 130022 3 中國醫學科學院-北京協和醫學院 醫藥生物技術研究所 國家新藥 (微生物) 篩選中心,北京 100050

陳云雨, 牛夏憶, 李妍, 等. 基于β-catenin/Lef1相互作用為靶標的新型抗腫瘤藥物高通量篩選模型的建立. 生物工程學報, 2019, 35(4): 707–717.Chen YY, Niu XY, Li Y, et al. Development of an ELISA-based high throughput screening method for novel anticancer agents targeting β-catenin/Lef1 interaction. Chin J Biotech, 2019, 35(4): 707–717.
旨在以β-catenin/Lef1相互作用為靶標,建立基于ELISA原理的適用于靶向β-catenin/Lef1相互作用小分子抑制劑篩選的高通量篩選模型。利用DNA重組技術,將構建的β-catenin-pET-30a(+)重組質粒轉化大腸桿菌Rosetta (DE3),經誘導培養后進行β-catenin原核表達。采用親和層析方法分離純化β-catenin后,以GST Pulldown實驗進行生物學活性鑒定。利用ELISA原理建立β-catenin/GST-Lef1結合的分子模型,通過優選GST-Lef1最佳包被濃度和β-catenin最佳反應濃度,建立適用于靶向β-catenin/Lef1相互作用小分子抑制劑篩選的高通量篩選模型。SDS-PAGE和Western blotting實驗證實β-catenin的原核表達。GST Pulldown實驗證實純化的β-catenin具有良好的生物學活性。通過對基于ELISA原理建立的β-catenin/GST-Lef1結合的分子模型優化,選用10 μg/mL GST-Lef1和6 μg/mL β-catenin建立ELISA高通量篩選模型,其Z¢因子為0.76。本研究成功建立了基于ELISA原理的β-catenin/GST-Lef1結合的分子模型,為靶向β-catenin/Lef1相互作用小分子抑制劑的高通量篩選奠定了基礎。
Wnt抑制劑,β-catenin,β-catenin/Lef1相互作用,酶聯免疫吸附實驗,高通量篩選
Wnt/β-catenin信號通路的異常活化在結腸癌、肝癌、肺癌、乳腺癌、慢性淋巴細胞白血病等多種癌癥的發生與發展中發揮重要作用,已經成為腫瘤分子靶向治療的一個重要靶標[1]。β-catenin是介導Wnt信號轉導的關鍵調控因子,同時通過與E-cadherin相互作用,參與細胞黏連和細胞骨架的構成。β-catenin核心功能區是12個連續重復的犰狳蛋白重復片段 (Armadillo repeats, 138–686 aa),兩側是N端結構域和C端轉錄激活結構域 (Carboxy-terminal transactivation domain, CTA)。其中犰狳蛋白重復片段對β-catenin的生物學功能尤為重要,幾乎介導了β-catenin與所有已知互作蛋白的結合[2]。在經典Wnt信號通路中,β-catenin作為重要的核轉錄調控因子,通過與Tcf4 (T-cell factor 4) 和Lef1 (Lymphoid enhancer factor 1) 相互作用而啟動大量原癌基因的表達[3-4]。研究表明,β-catenin/Lef1相互作用在非小細胞肺癌 (Non-small cell lung cancer,NSCLC) 腦 (骨) 轉移過程中發揮重要作用,促進肺癌細胞浸潤和腦 (骨) 轉移的形成[5-6]。另一方面,β-catenin/Lef1相互作用對于維持腫瘤干細胞(Cancer stem cells, CSC) 分化和自我更新具有極其重要的促進作用,參與維持腫瘤干細胞休眠體的形成,促進腫瘤耐藥與復發[7-8]。此外,β-catenin/Lef1相互作用在急 (慢) 性淋巴細胞白血病的發生與發展中也發揮重要的促進作用,已經成為白血病治療的新靶標[9-13]。因此,靶向β-catenin/Lef1相互作用小分子抑制劑的發現對于抑制NSCLC轉移和急 (慢) 性淋巴細胞白血病的治療具有重要意義。
本研究通過原核表達和分離純化高活性的β-catenin與GST-Lef1功能蛋白,以β-catenin/Lef1相互作用為靶標,建立基于酶聯免疫吸附實驗 (Enzyme-linked immunosorbent assay, ELISA) 原理的高通量篩選模型,為靶向β-catenin/Lef1相互作用小分子抑制劑的理性化發現奠定基礎。
1 材料與方法
1.1 材料
pET-30a(+)與pGEX-4T-1載體由本室保存;GST-β-catenin-pGEX-4T-1重組質粒由中國科學院大學存濟醫學院袁莉教授惠贈;大腸桿菌DH5α感受態細胞、.Rosetta (DE3)感受態細胞、.BL21(DE3)感受態細胞、?-T DNA聚合酶、Trans2K?DNA Marker、u?Ⅱ、?-T1試劑盒、?試劑盒、瓊脂糖、?HⅠ和?Ⅰ購自TransGen公司;酵母粉、胰蛋白胨和瓊脂粉購自Oxoid公司;BCA (Bicinchoninic acid) 試劑盒購自Thermo公司;硫酸卡那霉素、氨芐西林和異丙基硫代半乳糖苷 (Isopropyl β-D-Thiogalactoside,IPTG) 購自上海阿拉丁生化科技股份有限公司;牛血清白蛋白(Bull serum albumin, BSA)、小鼠抗組氨酸 (Histidine,His) 標簽單抗、小鼠抗谷胱甘肽轉移酶 (Glutathione S-transferase,GST) 標簽單抗和辣根過氧化物酶 (Horseradish peroxidase,HRP) 標記的羊抗小鼠IgG購自Biosharp公司;MaxiLuminTM化學發光液購自Biokits公司;96孔酶標板購自Corning公司;可溶型單組分四甲基聯苯胺 (3,3?,5,5?-Tetramethylbenzidine,TMB) 溶液購自天根生化科技 (北京) 有限公司;醋酸纖維素膜購自Millipore公司;HisTrap和GSTrap層析柱購自GE公司;谷胱甘肽親和介質購自中科森輝微球技術 (蘇州) 有限公司;其他生化試劑為國產分析純試劑。
1.2 方法
1.2.1 β-catenin (138–781 aa) 基因片段擴增
β-catenin功能區主要包括犰狳蛋白重復片段(138–686 aa) 和C端轉錄激活結構域 (687–781 aa),主要介導與Wnt信號通路中相關蛋白的相互作用和染色質重塑復合體的募集[2]。根據β-catenin (138–781 aa) 基因序列設計引物,以GST-β-catenin- pGEX-4T-1重組質粒為模板擴增基因片段 (1 932 bp)。按照常規PCR方法進行基因片段的擴增[14],以1%瓊脂糖凝膠電泳檢測目的基因擴增結果。
1.2.2 β-catenin原核表達質粒構建
按照文獻所述方法進行β-catenin原核表達質粒的構建[14]。首先,將回收的基因片段與T載體連接,構建克隆質粒。將克隆質粒轉化.DH5α感受態細胞,經藍白斑篩選后,以單菌落PCR反應和質粒雙酶切法鑒定陽性克隆,質粒測序由General Biosystems公司完成。
雙酶切克隆質粒中的基因片段后回收,再與pET-30a(+)載體連接,構建β-catenin- pET-30a(+)重組質粒。將重組質粒轉化.DH5α感受態細胞,經卡那霉素抗性篩選后,同法鑒定陽性克隆。
1.2.3 β-catenin原核表達
按照文獻所述方法進行β-catenin原核表達[14]。首先,將β-catenin-pET-30a(+)重組質粒轉化.Rosetta (DE3) 感受態細胞,經卡那霉素抗性篩選后,隨機挑取6個單菌落,以1 mmol/L IPTG于25 ℃誘導培養10 h,進行β-catenin原核表達。離心收集菌體,以8% SDS-PAGE和Clinx Image Analysis軟件進行β-catenin原核表達量分析。
工程菌大量誘導培養后,將離心收集的菌體以適量TBS (50 mmol/L Tris、150 mmol/L NaCl,pH 8.0) 溶液重懸,離心收集超聲波裂解后的上清液和沉淀。8% SDS-PAGE進行β-catenin的可溶性表達分析。
1.2.4 β-catenin分離純化
大量收集菌體裂解后的上清液,以25%飽和硫酸銨沉淀后制備粗提液,再按照文獻所述方法以HisTrap層析柱進行β-catenin的分離純化[14]。純化的β-catenin以8% SDS-PAGE進行分析,經TBS溶液透析后,以BCA法定量。
1.2.5 Western blotting實驗鑒定β-catenin
按照文獻所述方法[14],純化的β-catenin經8% SDS-PAGE后轉膜,一抗為1∶2 000稀釋的小鼠抗His標簽單抗,二抗為1∶4 000稀釋的HRP-羊抗小鼠IgG,用MaxiLuminTM化學發光液顯影成像。
1.2.6 GST-Lef1 (1–76 aa) 原核表達與分離純化
Lef1是經典Wnt信號通路中重要的核轉錄調控因子,β-catenin通過犰狳蛋白重復片段結構域與Lef1的βBD結構域 (β-catenin binding domain, βBD, 1–76 aa) 相互作用,進而調控大量原癌基因的轉錄與表達[15-16]。檢索Lef1 (1–76 aa) 的基因序列,以HⅠ和Ⅰ作為酶切位點,由General Biosystems公司進行全基因合成后連接pGEX-4T-1載體,構建GST-Lef1-pGEX-4T-1重組質粒。
Lef1 (1–76 aa) 基因合成序列如下 (下劃線為雙酶切位點):5?-ATGCCCCAACTTTC CGGAGGAGGCGGCGGGGGGGACCCGGAACTCTGCGCCACCGATGAGATGATCCCCTTCAAGGACGAAGGCGATCCCCAGAAGGAGAAGATCTTCGCCGAGATCAGTCATCCCGAAGAGGAGGGCGACTTAGCCGACATCAAGTCATCTTTGGTTAACGAGTCCGAAATCATCCCAGCCAGCAACGGGCATGAGGTGGTCAGACAAGCCCCGTCC-3?。
大量收集菌體裂解后的上清液,再按照文獻所述方法以GSTrap層析柱分別進行GST-Lef1和GST的分離純化[14]。純化的GST-Lef1和GST以10% SDS-PAGE進行分析,經TBS溶液透析后,以BCA法定量。
1.2.7 GST Pulldown實驗
將10 μg GST-Lef1和10 μg GST分別加入到20 μL GST瓊脂糖凝膠親和介質中,4 ℃反應過夜。收集反應后的GST瓊脂糖凝膠,以TBS溶液重懸。離心洗滌3次后,分別加入2 μg和10 μg β-catenin,室溫反應1 h,收集GST凝膠。以1.2.5方法檢測β-catenin的結合量。
1.2.8 基于ELISA原理的高通量篩選模型的優化與建立
1) GST-Lef1最佳包被濃度的確定
將5、10、20、30、40、50、60、70、80、90、100 μg/mL的GST-Lef1包被96孔酶標板(100 μL/孔),每組3個復孔,以包被1 μg BSA 孔作為陰性對照。酶標板經含0.1% Tween-20的磷酸鹽 (Phosphate-buffered solution, PBS) 緩沖液(PBST) 洗板3次后,以含10% BSA的PBST溶液于37 ℃封閉2 h。PBST洗板后,依次加入1∶2 000稀釋的小鼠抗GST標簽單抗和1∶4 000稀釋的HRP-羊抗小鼠IgG,室溫反應1 h。以PBST洗板3次后,每孔加入TMB溶液 (100 μL/孔),室溫避光顯色5 min,再加入2 mol/L H2SO4終止反應,多功能酶標儀檢測450值 (CytationTM5, BioTek)。
2) β-catenin最佳反應濃度的確定
GST與GST-Lef1 (10 μg/mL;100 μL/孔) 包被96孔酶標板,以包被GST孔作為陰性對照組。酶標板經PBST洗滌和10% BSA封閉后,將0.5、1、2、3、4、5、6、7、8、9、10 μg/mL的β-catenin (100 μL/孔) 依次加入到96孔酶標板中,每組3個復孔,室溫孵育1 h。PBST洗板后,按照上述方法依次加入1∶2 000稀釋的小鼠抗His標簽單抗和1∶4 000稀釋的HRP-羊抗小鼠IgG,室溫反應1 h。以TMB溶液 (100 μL/孔) 顯色,多功能酶標儀檢測450值。
3) DMSO濃度對β-catenin/GST-Lef1結合的影響
GST-Lef1 (10 μg/mL;100 μL/孔) 包被的96孔酶標板以PBST洗滌和10% BSA封閉后,依次加入含0%、1%、2%、3%、4%、5% DMSO濃度的β-catenin (6 μg/mL;100 μL/孔) 到96孔酶標板中,每組3個復孔,室溫反應1 h。按照上述方法檢測450值。
4) Z¢因子及其他主要技術參數的測定
GST和GST-Lef1 (10 μg/mL;100 μL/孔) 包被的96孔酶標板以PBST洗滌和10% BSA封閉后,將β-catenin (6 μg/mL;100 μL/孔) 加入到96孔酶標板中,室溫孵育1 h。將GST-Lef1與β-catenin反應孔設置為陰性孔,GST與β-catenin反應孔設置為陽性孔,其中1#–30#孔為陰性孔,31#–60#孔為陽性孔。以多功能酶標儀檢測450值并按照BioTek操作系統的相關程序進行Z¢因子的自動計算。
另外,根據相關文獻[17-18],我們也對本篩選模型的信號本底比 (Signal to background,S/B)、信號窗 (Signal window,SW)、信噪比 (Signal to noise,S/N)、信號/本底變異系數 (Coefficient of variation of signal/background,CV) 進行了定量分析。
2 結果與分析
2.1 β-catenin原核表達質粒構建
以GST-β-catenin-pGEX-4T-1重組質粒為模板,利用PCR反應成功擴增了與基因片段 (1 932 bp) 大小一致的特異DNA片段 (圖1A)。將構建的β-catenin-pET-30a(+) 重組質粒轉化DH5α,以單菌落PCR反應和質粒雙酶切法鑒定經卡那霉素抗性篩選的陽性克隆。鑒定結果表明,所挑取的單菌落均可特異性擴增出約1 932 bp的DNA片段 (圖1B)。構建的重組質粒經HⅠ和Ⅰ雙酶切后,再次得到了與PCR擴增結果大小一致的DNA片段 (圖1C)。上述結果表明,成功構建了β-catenin原核表達質粒。
2.2 β-catenin原核表達與分離純化
6株工程菌經誘導培養后,離心收集菌體,以8% SDS-PAGE和Clinx Image Analysis軟件進行β-catenin原核表達分析。與陰性對照組相比,在β-catenin理論分子量 (77 kDa) 位置可見明顯的蛋白表達條帶,β-catenin表達量約為15% (圖2A)。取菌體裂解后的上清液和沉淀進行SDS-PAGE分析表明,β-catenin以可溶形式表達,大部分存在于上清液中(圖2B)。綜上所述,成功進行了β-catenin原核表達。
25%飽和硫酸銨沉淀的菌體裂解上清液經HisTrap層析柱分離純化后,收集的樣品進行SDS-PAGE分析。結果表明,在β-catenin理論分子量 (77 kDa) 位置呈單一蛋白條帶,表明純化的β-catenin具有較高的純度 (圖2B)。以Western blotting實驗對純化的β-catenin進行鑒定,在β-catenin理論分子量 (77 kDa) 位置仍呈現出特異性條帶,證實了β-catenin的正確表達 (圖2C)。β-catenin經TBS溶液透析和BCA法定量后,其濃度為1.0 mg/mL。
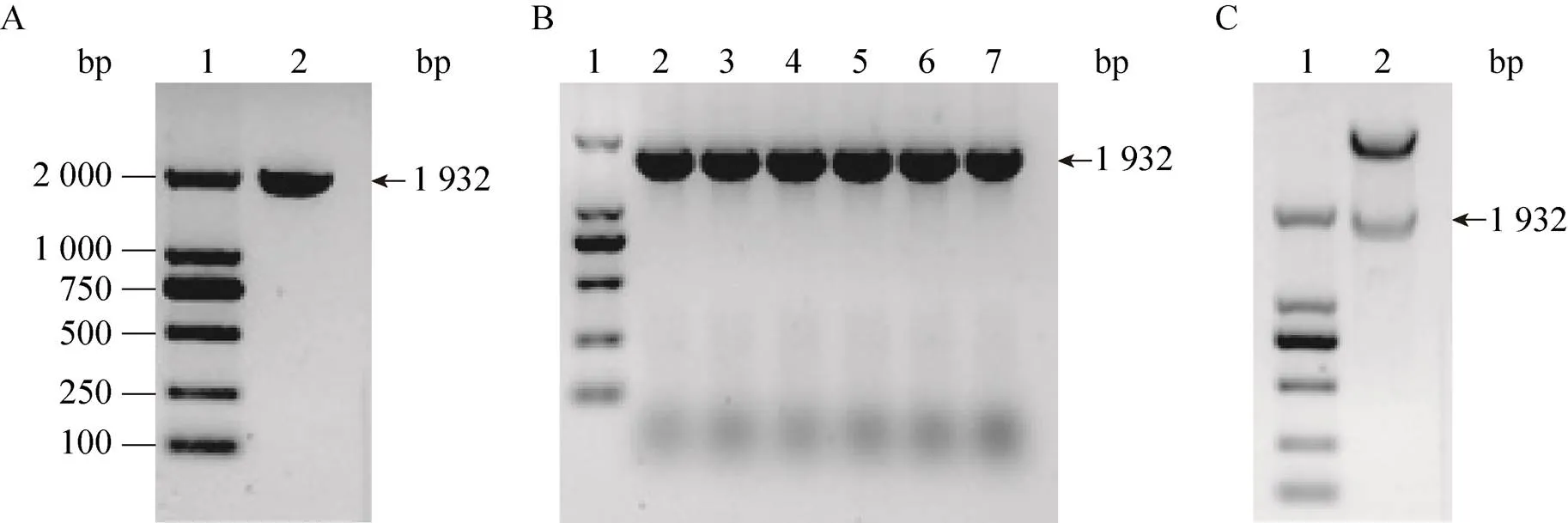
圖1 β-catenin原核表達質粒構建
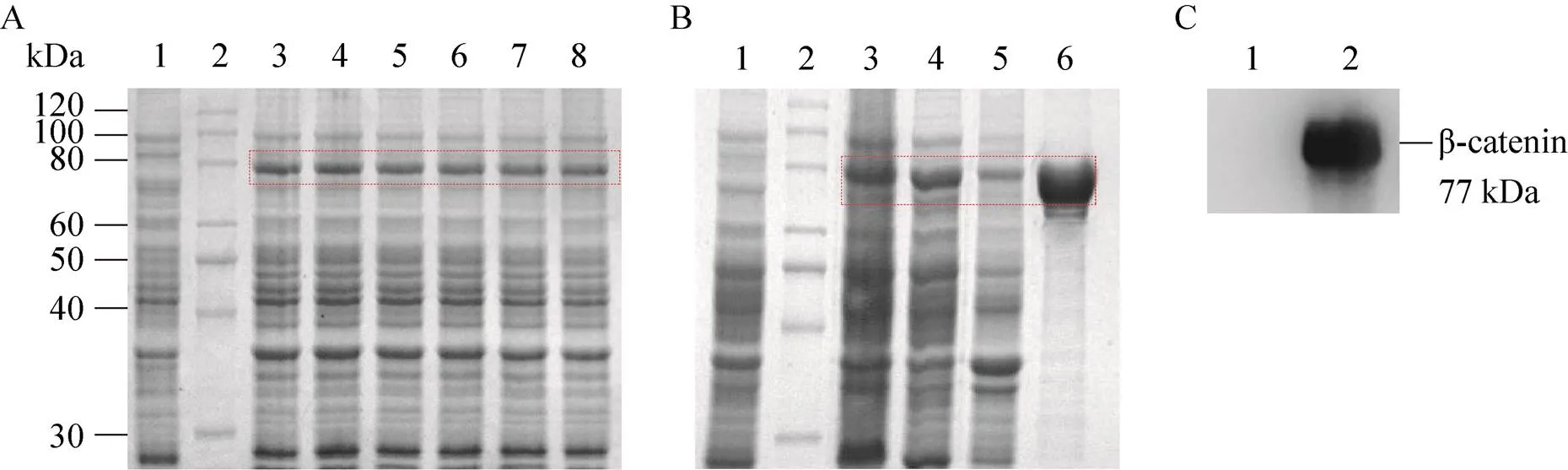
圖2 β-catenin原核表達與分離純化
2.3 GST-Lef1原核表達與分離純化
工程菌經誘導培養后收集菌體,以10% SDS-PAGE和Clinx Image Analysis軟件進行GST-Lef1原核表達分析。結果表明,在GST-Lef1理論分子量 (34 kDa) 位置可見明顯的蛋白表達條帶,GST-Lef1表達量約為18 % (圖3)。取菌體裂解后的上清液和沉淀進行SDS-PAGE分析表明,GST-Lef1以可溶形式表達,大部分存在于上清液中(圖3)。
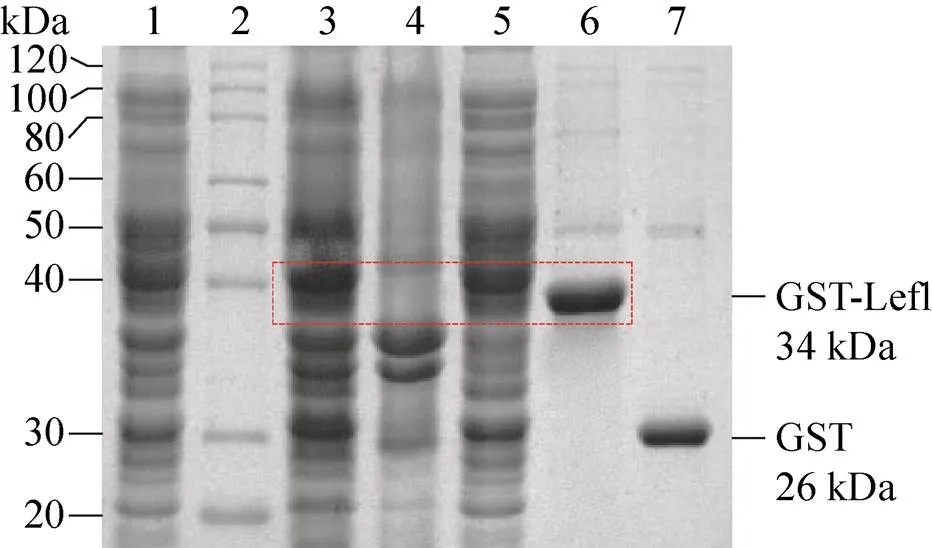
圖3 GST-Lef1原核表達與分離純化
菌體裂解上清液經GSTrap層析柱分離純化后,收集的樣品進行SDS-PAGE分析。結果表明,得到了與預期分子量 (34 kDa) 大小一致且純度較高的GST-Lef1 (圖3)。純化的GST-Lef1和GST (26 kDa) 經TBS溶液透析和BCA法定量后,其濃度分別為1.3 mg/mL和1.7 mg/mL。
2.4 β-catenin生物學活性鑒定
細胞核內β-catenin/Lef1相互作用是Wnt/ β-catenin信號通路中最重要的轉錄調控方式[3-4,15-16]。GST Pulldown實驗表明,純化的β-catenin能與GST-Lef1在體外發生明顯的特異性結合反應,且結合反應具有典型的量效關系,但β-catenin不能與GST發生結合反應 (圖4)。上述結果表明,純化的β-catenin具有良好的生物學活性。
2.5 GST-Lef1最佳包被濃度的確定
將不同濃度的GST-Lef1包被96孔酶標板后,以ELISA方法進行包被量檢測。結果表明,GST-Lef1包被濃度大于10 μg/mL時,450值趨于穩定并始終維持在0.73–0.81之間,10 μg/mL的包被濃度基本達到包被飽和量 (圖5)。因此選用10 μg/mL作為GST-Lef1的最佳包被濃度。
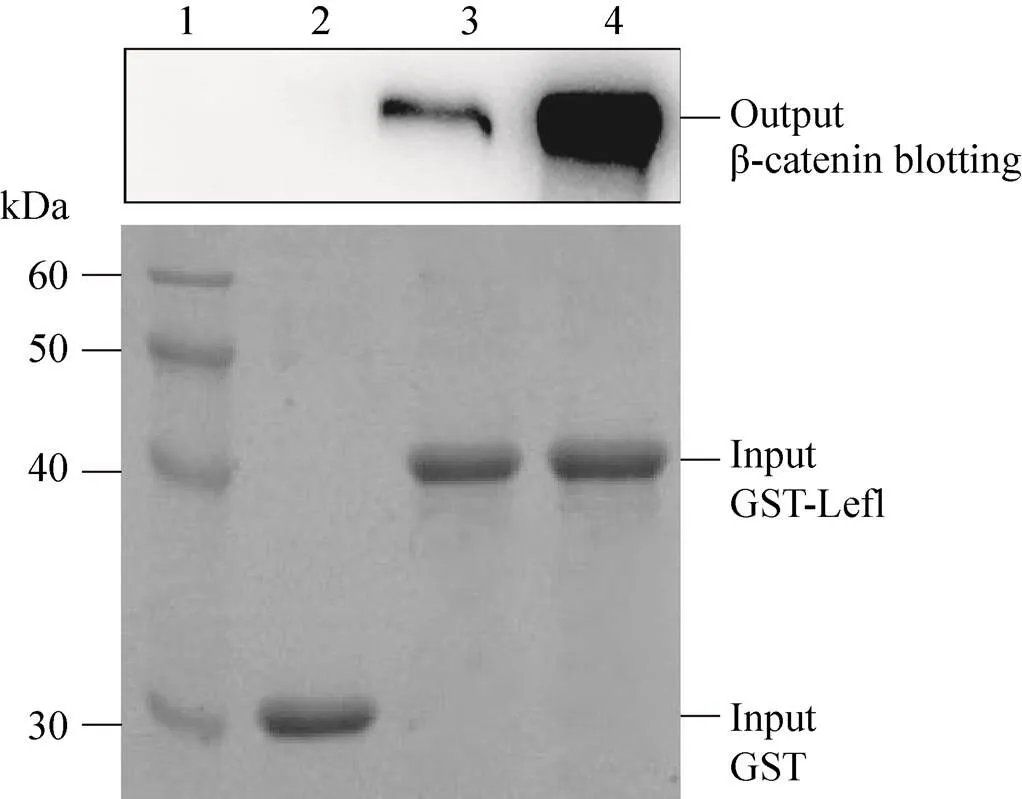
圖4 GST Pulldown實驗

圖5 GST-Lef1最佳包被濃度的確定
2.6 β-catenin最佳反應濃度的確定
將系列稀釋的β-catenin加入到10 μg/mL GST-Lef1包被的96孔酶標板中,以ELISA方法進行β-catenin結合量檢測。結果表明,β-catenin與GST-Lef1的結合反應具有良好的濃度依賴性。當β-catenin濃度達到7 μg/mL時,450值達到最大并趨于結合反應的飽和 (圖6)。為了使其結合反應在實驗體系中趨于飽和狀態并增大實驗體系的信號窗,因此選用6 μg/mL作為β-catenin的最佳反應濃度。
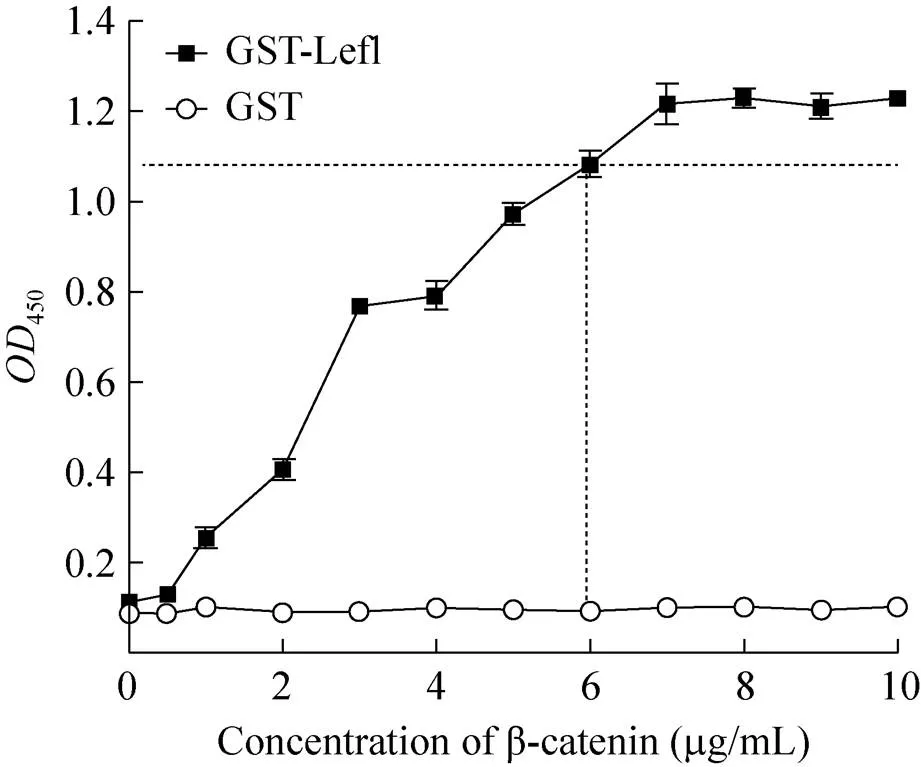
圖6 β-catenin最佳反應濃度的確定
2.7 DMSO濃度對β-catenin/GST-Lef1相互作用的影響
利用確定最佳GST-Lef1包被濃度和β-catenin反應濃度的ELISA分子結合模型進行DMSO濃度影響實驗。結果表明,DMSO濃度在0%–5% 時,450值趨于穩定并始終維持在0.97–1.05之間,其對β-catenin/GST-Lef1相互作用未產生顯著影響 (圖7)。
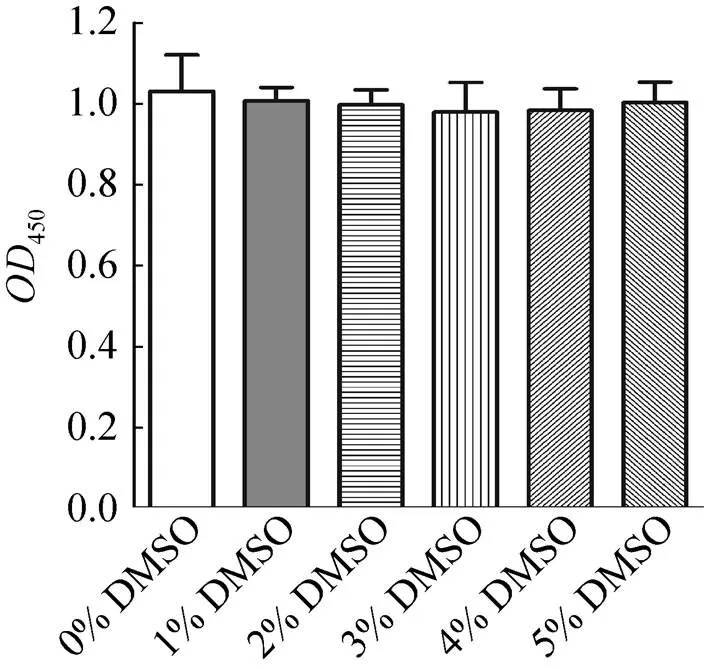
圖7 DMSO濃度對β-catenin/GST-Lef1相互作用的影響
2.8 Z¢因子及其他主要技術參數的測定
通過綜合分析與計算,本篩選模型的Z¢因子值為0.76,滿足高通量篩選中Z¢因子大于0.5的基本要求 (圖8)。
除Z¢因子外,本篩選模型的其他4個通用技術指標,如信號本底比 (S/B)、信噪比 (S/N)、信號窗 (SW) 和信號/本底變異系數 (CV) 也完全滿足高通量篩選的基本要求 (表1)。
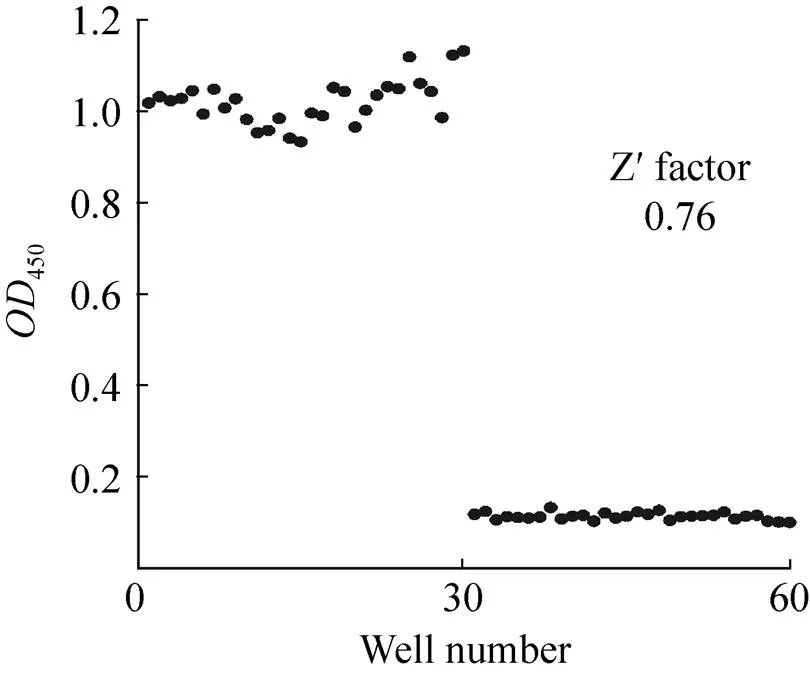
圖8 ELISA篩選模型Z¢因子的確定

表1 ELISA高通量篩選模型的綜合評價
3 討論
Wnt/β-catenin信號通路是調控腫瘤細胞生長增殖的關鍵信號通路,在腫瘤發生與發展中發揮著極其重要的作用,與腫瘤細胞的生長分化、上皮-間質轉化、免疫耐受及化療耐藥密切相關。鑒于正常細胞中不存在Wnt/β-catenin信號通路,而腫瘤細胞中Wnt/β-catenin信號通路異常活化并啟動大量原癌基因的表達,所以Wnt/β-catenin信號通路已成為新型高選擇性抗腫瘤藥物開發的一個理想靶標[3]。
Lef1與Tcf4同屬于高遷移組分 (High mobility group, HMG) 轉錄因子,是經典Wnt信號通路中重要的核轉錄調控因子。在腫瘤細胞內β-catenin通過與Lef1的βBD結構域相互作用,啟動大量原癌基因的轉錄與表達,促進腫瘤細胞的增殖與分化[3-4,15-16]。目前靶向β-catenin/Tcf4相互作用的小分子抑制劑 (如ZTM-000990、PKF115-584、PKF222-815、PKF118-744、CGP049090、iCRT-3/5/14、LF-3等) 已經成為抗腫瘤藥物研究的熱點,在結腸癌[19-21]、乳腺癌[22]、肝癌[23-24]、多發性骨肉瘤[25]等腫瘤實驗治療中展現出良好的應用前景。但關于靶向β-catenin/Lef1相互作用的小分子抑制劑篩選方法及相關抑制劑的腫瘤分子治療研究卻鮮有報道[13,26]。
由于蛋白質-蛋白質相互作用 (Protein-protein interactions, PPIs) 位點缺少較深的“口袋”式結構,且具有較大的非連續性的相互作用面積,這使得以PPIs為靶點的小分子藥物開發依然面臨較大的挑戰;另外,由于缺少具有多樣化學結構的靶向PPIs的小分子配體,較難進行基于結構的定向藥物設計[27]。因此,靶向β-catenin/Lef1相互作用小分子抑制劑的發現對未來以其為靶標的新型抗腫瘤藥物定向設計具有重要的理論意義。
大腸桿菌原核表達體系已成為制備重組蛋白的首選表達體系[28],本研究綜合利用DNA重組技術,成功進行了β-catenin和GST-Lef1的原核表達與分離純化。由于His標簽較小,幾乎不影響目的蛋白的理化性質且方便目的蛋白的檢測與純化,His標簽已被廣泛應用于多種重組蛋白在各種表達系統的表達與純化中[29]。故此在設計β-catenin原核表達和分離純化策略時,筆者首次采用pET-30a(+) 載體的His標簽融合表達策略成功進行了β-catenin原核表達與分離純化。與已報道的GST-β-catenin融合表達策略相比[30],筆者建立的β-catenin原核表達與分離純化方法具有更好的簡便性和實用性。此外,鑒于.Rosetta (DE3) 可補充大腸桿菌缺乏的6種稀有密碼子對應的tRNA,可提高真核基因在大腸桿菌中的表達水平,故此選擇.Rosetta (DE3) 作為β-catenin的表達宿主菌。
GST Pulldown實驗主要在溶液中進行,可以真實地反映蛋白質分子間的相互作用,已成為體外研究蛋白質-蛋白質相互作用的經典實驗方法[31]。我們利用GST Pulldown實驗進行β-catenin的生物學活性鑒定,證實了純化的β-catenin能與GST-Lef1發生特異性結合反應,這表明純化的β-catenin具有良好的生物學活性。
酶聯免疫吸附實驗具有操作簡便、檢測靈敏、成本低廉等優點,使其在疾病診斷和藥物篩選研究領域得到了極大的應用與發展[32-34]。本研究以β-catenin/Lef1相互作用為靶標,應用ELISA原理建立的高通量篩選模型還具有所需樣品量少、重復性好、檢測結果穩定等諸多優點,可以實現大樣本的簡便、快速的高通量篩選與分析。雖然本篩選模型還存在一定的局限性 (如操作步驟較多、需多次洗滌、耗時較長等),但和本實驗室曾采用的酵母雙雜交篩選模型相比,應用本篩選方法不但可以有效減少篩選化合物用量,降低篩選成本,還具有更好的簡便性和靈敏性。另外,本篩選模型基本真實模擬了β-catenin/Lef1的生理相互作用,不僅可以應用于以β-catenin/Lef1相互作用為靶標的抗腫瘤藥物高通量篩選,還可以聯合GST Pulldown實驗用于評價小分子抑制劑的體外抑制活性,因此本方法也具有良好的實用性。
目前,我們成功應用本篩選模型對本實驗室天然產物化合物庫進行了初步篩選,已獲得了若干苗頭化合物,相關化合物的抗腫瘤分子機制研究正在進行之中。此外,我們也利用本篩選模型對本實驗室設計的一系列靶向多肽進行了系統篩選和體外抑制活性評價,已獲得了若干有深入研究價值的多肽分子,相關多肽的細胞藥理學研究也在同步進行之中。在本篩選模型的后續方法改進中,可直接使用HRP-抗His標簽抗體一步法檢測和顯色,通過減少實驗操作步驟以提高篩選效率。
Z¢因子是評價高通量篩選模型的核心參數,它結合了信號窗 (SW)和信號/本底變異系數 (CV)這2個與模型質量密切相關的重要參數,一般要求Z¢因子>0.5的模型才適用于藥物高通量篩選[35]。通過對建立的ELISA高通量篩選模型的通用技術指標,如Z¢因子、信號本底比 (S/B)、信噪比 (S/N)、信號窗 (SW)、信號/本底變異系數 (CV)進行定量評價,表明本篩選模型具有良好的穩定性、靈敏性和特異性。
綜上所述,本研究成功建立了基于β-catenin/Lef1相互作用為靶標的ELISA高通量篩選模型,為靶向β-catenin/Lef1相互作用的小分子抑制劑高通量篩選和藥理學活性評價奠定了實驗基礎。
致謝:衷心感謝中國科學院大學存濟醫學院袁莉教授和美國華盛頓大學結構生物學系許文清教授在β-catenin原核表達方面給予的悉心指導和無私幫助!
[1] Anastas JN, Moon RT. WNT signalling pathways as therapeutic targets in cancer. Nat Rev Cancer, 2013, 13(1): 11–26.
[2] Su S, Wu W. Regulation of target gene transcription by Wnt/β-catenin signaling. Sci Sin Vitae, 2014, 44(10): 1029–1042 (in Chinese). 蘇尚, 吳畏. Wnt/β-catenin信號通路對靶基因轉錄的調控. 中國科學: 生命科學, 2014, 44(10): 1029–1042.
[3] Barker N, Clevers H. Mining the Wnt pathway for cancer therapeutics. Nat Rev Drug Discov, 2006, 5(12): 997–1014.
[4] Clevers H, Nusse R. Wnt/β-catenin signaling and disease. Cell, 2012, 149(6): 1192–1205.
[5] Nguyen DX, Chiang AC, Zhang XHF, et al. WNT/TCF signaling through LEF1 and HOXB9 mediates lung adenocarcinoma metastasis. Cell, 2009, 138(1): 51–62.
[6] Chen CY, Jan YH, Juan YH, et al. Fucosyltransferase 8 as a functional regulator of nonsmall cell lung cancer. Proc Natl Acad Sci USA, 2013, 110(2): 630–635.
[7] Iqbal W, Alkarim S, AlHejin A, et al. Targeting signal transduction pathways of cancer stem cells for therapeutic opportunities of metastasis. Oncotarget, 2016, 7(46): 76337–76353.
[8] Steeg PS. Targeting metastasis. Nat Rev Cancer, 2016, 16(4): 201–218.
[9] Metzeler KH, Heilmeier B, Edmaier KE, et al. High expression of lymphoid enhancer-binding factor-1 () is a novel favorable prognostic factor in cytogenetically normal acute myeloid leukemia. Blood, 2012, 120(10): 2118–2126.
[10] Yeung J, Esposito MT, Gandillet A, et al. β-Catenin mediates the establishment and drug resistance of MLL leukemic stem cells. Cancer Cell, 2010, 18(6): 606–618.
[11] Petropoulos K, Arseni N, Schessl C, et al. A novel role for Lef-1, a central transcription mediator of Wnt signaling, in leukemogenesis. J Exp Med, 2008, 205(3): 515–522.
[12] Gandhirajan RK, Poll-Wolbeck SJ, Gehrke I, et al. Wnt/β-catenin/LEF-1 signaling in chronic lymphocytic leukemia (CLL): a target for current and potential therapeutic options. Curr Cancer Drug Targets, 2010, 10(7): 716–727.
[13] Gandhirajan RK, Staib PA, Minke K, et al. Small molecule inhibitors of Wntsignaling induces apoptosis in chronic lymphocytic leukemia cellsand. Neoplasia, 2010, 12(4): 326–335.
[14] Chen YY, Liu G, Zhang J, et al. Bacterial expression, purification and biological activity evaluation of Plk1 PBD protein. J Chongqing Med Univ, 2018, 43(11): 1453-1457 (in Chinese).
陳云雨, 劉剛, 張晶, 等. Plk1 PBD蛋白原核表達、分離純化與活性鑒定. 重慶醫科大學學報, 2018, 43(11): 1453-1457.
[15] Behrens J, von Kries JP, Kühl M, et al. Functional interaction of β-catenin with the transcription factor LEF-1. Nature, 1996, 382(6592): 638–642.
[16] von Kries JP, Winbeck G, Asbrand C, et al. Hot spots in β-catenin for interactions with LEF-1, conductin and APC. Nat Struct Biol, 2000, 7(9): 800–807.
[17] Gong SQ, Han XW, Li XH, et al. Development of a high-throughput screening strategy for upregulators of the OPG/RANKL ratio with the potential for antiosteoporosis effects. J Biomol Screen, 2016, 21(7): 738–748.
[18] Chen YY, Miao DD, Zhang YM, et al. Development of a novel fluorescence polarization-based high-throughput screening method for PLK1 PBD inhibitors. Chin Med Biotechnol, 2017, 12(5): 385–390 (in Chinese). 陳云雨, 繆冬冬, 張葉明, 等. 靶向PLK1 PBD小分子抑制劑熒光偏振高通量篩選模型的建立. 中國醫藥生物技術, 2017, 12(5): 385–390.
[19] Lepourcelet M, Chen YNP, France DS, et al. Small-molecule antagonists of the oncogenic Tcf/β-catenin protein complex. Cancer Cell, 2004, 5(1): 91–102.
[20] Fang L, Zhu QH, Neuenschwander M, et al. A Small-molecule antagonist of the β-catenin/TCF4 interaction blocks the self-renewal of cancer stem cells and suppresses tumorigenesis. Cancer Res, 2016, 76(4): 891–901.
[21] Gonsalves FC, Klein K, Carson BB, et al. An RNAi-based chemical genetic screen identifies three small-molecule inhibitors of the Wnt/signaling pathway. Proc Natl Acad Sci USA, 2011, 108(15): 5954–5963.
[22] Jang GB, Hong IS, Kim RJ, et al. Wnt/β-catenin small-molecule inhibitor CWP232228 preferentially inhibits the growth of breast cancer stem-like cells. Cancer Res, 2015, 75(8): 1691–1702.
[23] Wei W, Chua MS, Grepper S, et al. Small molecule antagonists of Tcf4/β-catenin complex inhibit the growth of HCC cellsand. Int J Cancer, 2010, 126(10): 2426–2436.
[24] Kim JY, Lee HY, Park KK, et al. CWP232228 targets liver cancer stem cells through Wnt/β-catenin signaling: a novel therapeutic approach for liver cancer treatment. Oncotarget, 2016, 7(15): 20395–20409.
[25] Sukhdeo K, Mani M, Zhang YY, et al. Targeting the β-catenin/TCF transcriptional complex in the treatment of multiple myeloma. Proc Natl Acad Sci USA, 2007, 104(18): 7516–7521.
[26] Hsieh TH, Hsu CY, Tsai CF, et al. A novel cell-penetrating peptide suppresses breast tumorigenesis by inhibiting β-catenin/LEF-1 signaling. Sci Rep, 2016, 6: 19156.
[27] Ivanov AA, Khuri FR, Fu HA. Targeting protein-protein interactions as an anticancer strategy. Trends Pharmacol Sci, 2013, 34(7): 393–400.
[28] Baeshen MN, Al-Hejin AM, Bora RS, et al. Production of biopharmaceuticals in.: current scenario and future perspectives. J Microbiol Biotechnol, 2015, 25(7): 953–962.
[29] Li YJ, Chen YY, Bi LJ. Fusion tags technology and their applications. Chin J Biotech, 2006, 22(4): 523–527 (in Chinese). 李永進, 陳媛媛, 畢利軍. 融合標簽技術及其應用. 生物工程學報, 2006, 22(4): 523–527.
[30] Yin HL, Yuan L. Prokaryotic expression, purification, and identification of GST-β-catenin-His double labeled fusion protein. J Grad Univ Chin Acad Sci, 2012, 29(6): 847–852 (in Chinese). 尹會龍, 袁莉. GST-β-catenin-His雙標簽融合蛋白的原核表達、純化及鑒定. 中國科學院研究生院學報, 2012, 29(6): 847–852.
[31] Chai ZB, Zhang GL, Han JX. Application of GST-pull down technique in study on protein-protein interaction. Chin J Biol, 2014, 27(10): 1354–1358 (in Chinese). 柴政斌, 張更林, 韓金祥. GST-pull down技術在蛋白質相互作用中的應用. 中國生物制品學雜志, 2014, 27(10): 1354–1358.
[32] Wang L, Bao Y, Yang Y, et al. Discovery of antagonists for human scavenger receptor CD36 via an ELISA-like high-throughput screening assay. J Biomol Screen, 2010, 15(3): 239–250.
[33] Zhang XL, Nie YZ, Lan XG, et al. Preparation of anti-HBsAg epitope monoclonal antibodies and establishment of a sandwich ELISA for HBV serotype detection. Chin J Cell Mol Immunol, 2014, 30(2): 171–175 (in Chinese). 張曉磊, 聶玉哲, 藍興國, 等. 抗HBsAg表位單克隆抗體的制備及HBV血清型夾心ELISA的建立. 細胞與分子免疫學雜志, 2014, 30(2): 171–175.
[34] Siarot L, Chutiwitoonchai N, Sato H, et al. Identification of human immunodeficiency virus type-1 Gag-TSG101 interaction inhibitors by high-throughput screening. Biochem Biophys Res Commun, 2018, 503(4): 2970–2976.
[35] Zhang JH, Chung TDY, Oldenburg KR. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J Biomol Screen, 1999, 4(2): 67–73.
Development of an ELISA-based high throughput screening method for novel anticancer agents targeting β-catenin/Lef1 interaction
Yunyu Chen1,2, Xiayi Niu1, Yan Li3, and Xiaoping Liu1
1 Center for New Drug Screening & Evaluation, School of Pharmacy, Wannan Medical College, Wuhu 241002, Anhui, China 2 Laboratory of Chemical Biology, Changchun Institute of Applied Chemistry, Chinese Academy of Sciences, Changchun 130022, Jilin, China 3 National Center for Microbial Drug Screening, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
To develop an enzyme-linked immunosorbent assay (ELISA)-based high throughput screening (HTS) method for β-catenin/Lef1 interaction antagonists screening,Rosetta (DE3) competent cells were transformed with β-catenin-pET-30a(+) plasmid. β-catenin protein was expressed after induction and purified using affinity chromatography. The biological activity of purified β-catenin was further analyzed by GST Pulldown assay. The β-catenin/GST-Lef1 binding model was established using ELISA principle, and the ELISA-based HTS method was further optimized through determination of an optimal coated concentration of GST-Lef1 and working concentration of β-catenin. The results showed that β-catenin protein was successfully expressed and purified. The GST Pulldown assay demonstrated a perfect biological activity for purified β-catenin. Subsequently, the ELISA-based HTS method was performed using 10 μg/mL GST-Lef1 and 6 μg/mL β-catenin, with the Z¢factor of 0.76. Taken together, we have successfully developed a simple, robust and reliable ELISA-based HTS method for screening of novel Wnt inhibitors targeting β-catenin/Lef1 interaction.
Wnt inhibitors, β-catenin, β-catenin/Lef1 interaction, ELISA, high throughput screening
10.13345/j.cjb.180344
August 26, 2018;
November 7, 2018
National Natural Science Foundation of China (No. 81703546), Anhui Provincial Natural Science Foundation (No. 1808085QH265), Jilin Scientific and Technological Development Program (No. 20160520045JH), The Doctoral Starting-up Fund of Wannan Medical College (No. RCQD201617), College Student Innovation Fund of Wannan Medical College (No. WK2018S54).
Xiaoping Liu. Tel: +86-553-3932601; Fax: +86-553-3932622; E-mail: liuxiaoping@wnmc.edu.cn
Yan Li. Tel: +86-10-63180623; Fax: +86-10-63180604; E-mail: 13391513480@163.com
國家自然科學基金 (No. 81703546),安徽省自然科學基金 (No. 1808085QH265),吉林省科技發展計劃 (No. 20160520045JH),皖南醫學院博士科研啟動基金 (No. RCQD201617),皖南醫學院大學生科研資助金 (No. WK2018S54) 資助。
2018-11-26
http://kns.cnki.net/kcms/detail/11.1998.Q.20181122.1104.004.html
(本文責編 郝麗芳)

