硫辛酸和甜菜堿在小麥組織培養中的作用
鄭冠鵬,王曉雨,劉新倫,田增榮,王 超,吉萬全
(西北農林科技大學農學院/國家小麥改良中心楊凌分中心/旱區作物逆境生物學國家重點實驗室,陜西楊凌 712100)
近年來,以轉基因技術提高小麥產量、品質和抗逆性的研究已日趨廣泛。農桿菌轉化法具有操作簡單、成本低、可轉移較大片段 DNA等優點,并且外源基因的整合多為單拷貝,遺傳穩定性好,后代多數符合孟德爾遺傳規律,所以在小麥轉基因研究中被廣泛應用[1]。然而在農桿菌轉化過程中,褐化問題嚴重影響了小麥轉化的成功率,其與玻璃化和菌類污染并稱為組織培養的三大難題[2]。
褐化是外植體受到脅迫后釋放出酚類物質并誘導植保素或物理屏障生成的一種自我保護機制。由于酚類物質不穩定,易在多酚氧化酶的作用下氧化形成褐色醌類物質,醌類物質又會在酪氨酸酶等酶的作用下,與外植體中的蛋白質聚合,進一步導致其他酶系統紊亂,導致外植體生長停滯直至死亡[3]。研究表明,在培養基中添加一些抗褐化劑,如半胱氨酸(Cys)、抗壞血酸(Vc)、谷胱甘肽(GSH)及AgNO3等[4],可以減輕愈傷組織的褐化。趙 瑋[5]在茶樹組織培養中使用1/2 MS培養基并加入0.50 g·L-1的Na2S2O3和0.50 g·L-1的活性炭,使茶樹的褐化率降為40.5%。饒慧云等[6]在葡萄組織培養中研究了7種抗褐化劑的作用,效果為PVP(2.0 g·L-1)>甘露醇(20.0 g·L-1)>AgNO3(0.02 g·L-1)>Vc(0.006 g·L-1)>活性炭(2.5 g·L-1)>檸檬酸(0.6 g·L-1)。在杉木精簡組織培養中加入Vc和Cys可有效降低愈傷組織的褐化程度[7];在堿茅種胚的誘導、繼代和芽分化培養基中添加500 mg·L-1的脯氨酸可有效防止愈傷組織褐化[8];在小麥遺傳轉化的侵染和共培養培養基中添加400 mg·L-1的Cys,降低了愈傷組織的褐化率[9]。
硫辛酸(lipoic acid,LA)作為一種獨特的抗氧化劑,廣泛存在于各種原核和真核細胞中,它的存在可有效減少氧化應激反應的發生[10]。硫辛酸的抗氧化功能體現在以下5個方面:(1)直接清除活性氧和活性氮;(2)通過螯合金屬離子發揮抗氧化作用;(3)循環再生其他內源性抗氧化劑;(4)增強自身氧化酶的活性;(5)增加線粒體膜電位和細胞氧消耗,降低活性氧的產生。硫辛酸在木本植物的組織培養中有所應用,Uchendu等[11]的研究表明,培養基中添加4~8 mmol·L-1的硫辛酸可顯著提高兩種樹莓莖尖的再生率。但硫辛酸在小麥組織培養中的研究尚未見報道。
甜菜堿(glycine betaine,GB)是一種植物抵抗非生物脅迫的保護劑[12],研究表明,甜菜堿可誘導H2O2介導的抗氧化機制[13]。Cuin等[14]研究發現,培養液中添加低濃度(5 mmol·L-1)的甜菜堿可減少擬南芥根部伸長區的氧自由基。Uchendu等[11]的研究表明,在培養基中添加10 mmol·L-1的甜菜堿可有效提高凍存莖尖的再生率。然而甜菜堿在小麥組織培養中的研究尚未見報道。
本研究以小麥幼胚為試驗材料,研究硫辛酸和甜菜堿在組織培養中對愈傷組織的作用,以期找到克服小麥愈傷組織褐化的方法,為進一步優化小麥遺傳轉化體系提供參考。
1 材料與方法
1.1 試驗材料
所用小麥受體材料為弱春性小麥品種小偃22,半冬性小麥品種Z50和鄭麥366,農桿菌菌株為GV3101,均由西北農林科技大學染色體工程實驗室保存。植物表達載體DRB-bar-TaGW2由本實驗室構建。
1.2 培養基
誘導培養基:MS+2 mg·L-12,4-D,+30 g·L-1蔗糖+7 g·L-1瓊脂,pH 5.8。重懸液:1/10MS+2,4-D(2 mg·L-1)+30 g·L-1蔗糖+150 mmol·L-1乙酰丁香酮,pH 5.8。共培養基:1/10MS+2,4-D(2 mg·L-1)+30 g·L-1蔗糖,pH 5.8。抑菌培養基:基礎培養基為MS+2,4-D(2 mg·L-1)+30 g·L-1蔗糖+7 g·L-1瓊脂,分別添加不同濃度的硫辛酸和甜菜堿(表1)。硫辛酸與甜菜堿均于滅菌前加入并將pH調至5.8,滅菌結束后溫度降至約50 ℃時加入終濃度為500 mg·L-1的羧芐青霉素。

表1 抑菌培養基中硫酸鋅(LA)和甜菜堿(GB)的添加量Table 1 Concentration of lipoic acid(LA) and glycine betaine(GB) in the bacteriostatic medium
基礎培養基均為MS+2,4-D(2 mg·L-1)+30 g·L-1蔗糖+7 g·L-1瓊脂。
The basic medium is MS+2,4-D(2 mg·L-1)+30 g·L-1sucrose+7 g·L-1agar.
1.3 小麥幼胚愈傷組織的誘導
取揚花后13~15 d的小麥未成熟種子,用75%乙醇浸泡30 s,無菌水沖洗2~3次,隨后用0.1%升汞處理10 min,無菌水沖洗4~5次。于超凈工作臺中用滅菌的手術刀切取幼胚置于誘導培養基上,置于25 ℃下暗培養15 d。
1.4 幼胚愈傷組織的侵染
將含有載體DRB-bar-TaGW2的農桿菌GV3101接種于LB液體培養基(含50 mg·L-1利福平+100 mg·L-1壯觀霉素)中,28 ℃ 280 r·min-1過夜培養至OD600為0.6~0.8,4 000 r·min-1離心10 min,棄上清后加入與上清等量的重懸液重懸農桿菌,用重新懸浮的菌液浸泡愈傷組織20 min后除去多余菌液。將愈傷組織轉入含有適量共培養基的濾紙培養皿中,25 ℃共培養48 h,再轉入含有不同處理的抑菌培養基中。各處理均重復3次,每重復取愈傷組織50枚左右。
1.5 數據統計與分析
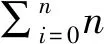
a:0級;b:1級;c :2級;d: 3級。 a:Level 0; b:Level 1; c:Level 2; d:Level 3.
2 結果與分析
2.1 不同品種的褐化及水漬化程度
本研究發現,在均未添加LA和GB時,于5、10和15 d抑菌處理后,Z50和小偃22的褐化程度均顯著低于鄭麥366 ,各品種隨著抑菌時間的延長,褐化程度均呈現先升高后降低的趨勢,但除小偃22外,差異均不顯著(圖2)。三個品種的水漬化程度均表現為隨抑菌培養時間的延長而降低,Z50、鄭麥366抑菌10 d時的水漬化程度均顯著低于5 d。抑菌5 d時小偃22水漬化程度顯著低于鄭麥366,但抑菌10和15 d時差異不顯著(圖3)。
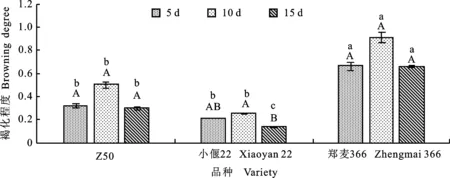
圖柱上小寫字母不同表示相同抑菌時間內不同品種之間差異顯著(P<0.05),大寫字母不同表示相同品種在不同抑菌時間下差異顯著(P<0.05)。圖3同。
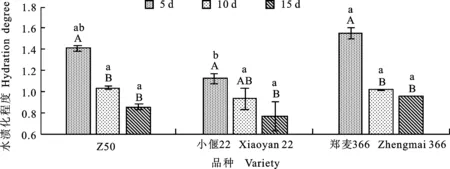
圖3 不同品種在不同抑菌處理天數后的水漬化程度
2.2 硫辛酸處理對抑菌階段愈傷組織的影響
2.2.1 硫辛酸處理對抑菌階段愈傷組織褐化程度的影響
從圖4可以看出,Z50、小偃22和鄭麥366的褐化程度基本呈現隨硫辛酸濃度的升高而降低的趨勢,并且隨著抑菌時間的延長,其中添加4和8 mmol·L-1硫辛酸處理的褐化程度均顯著低于CK(小偃22處理15 d的情況例外)。在抑菌培養第10 d,添加4 mmol·L-1硫辛酸的Z50褐化程度最低,僅為對照的10.50%。在硫辛酸對小偃22愈傷組織的處理中,添加2 mmol·L-1硫辛酸褐化程度最高,而添加4和8 mmol·L-1硫辛酸處理的褐化程度顯著低于CK。鄭麥366在抑菌第5 d,2 mmol·L-1硫辛酸處理的褐化程度略高于CK,而在第10和15 d的褐化程度均隨硫辛酸濃度的升高而降低。這說明硫辛酸在抑制愈傷組織褐化方面起到積極的作用,且其影響程度與品種類型密切相關。
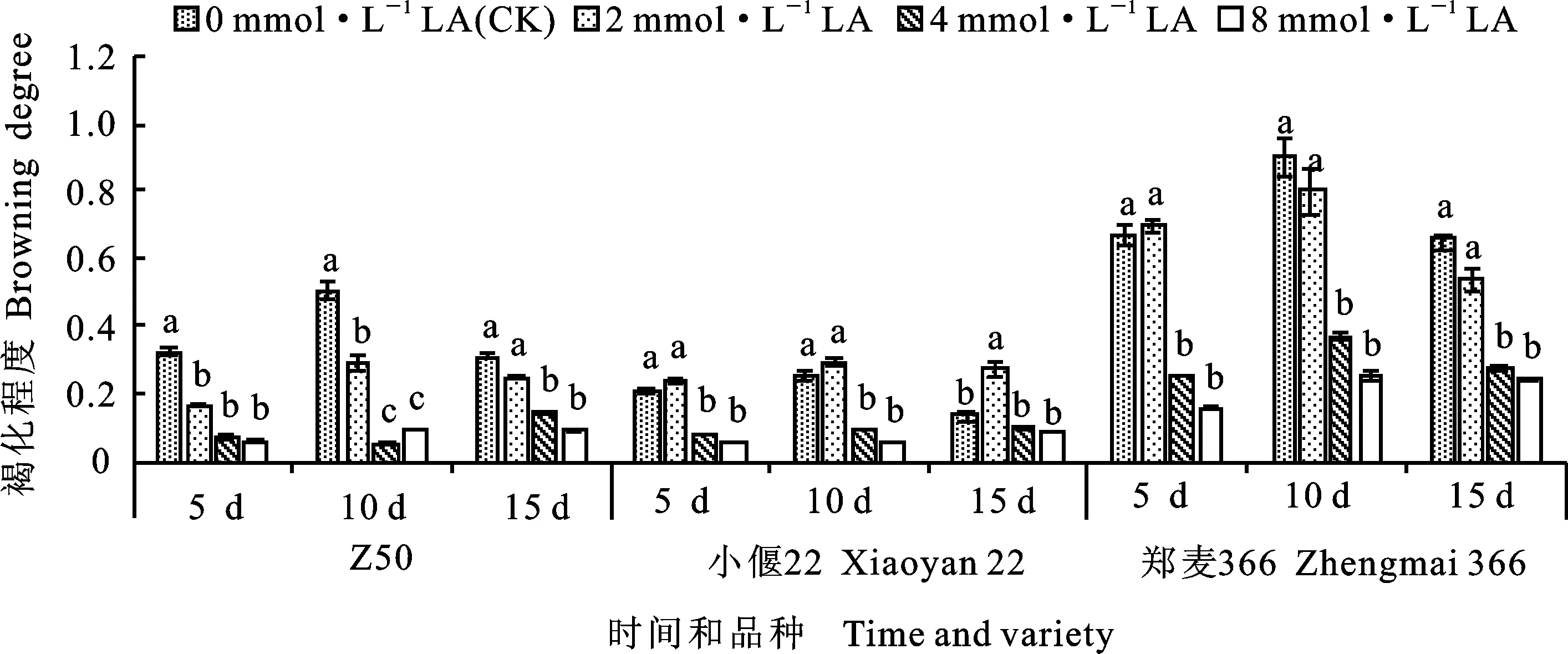
橫坐標上的天數為抑菌處理的時間;圖柱上小寫字母不同表示在不同濃度硫辛酸處理下相同品種和相同抑菌時間內褐化程度在0.05水平上差異顯著。圖5、圖6、圖7同。
2.2.2 硫辛酸處理對抑菌階段愈傷組織水漬化程度的影響
如圖5所示,在添加不同濃度硫辛酸處理5、10和15 d后,隨著硫辛酸濃度的提高,Z50和小偃22愈傷組織的水漬化程度依次增加。添加8 mmol·L-1硫辛酸的Z50水漬化程度在5、10和15 d均顯著高于CK。添加4和8 mmol·L-1硫辛酸的小偃22在抑菌15 d時水漬化程度顯著高于CK。添加硫辛酸對鄭麥366的影響與另兩個品種不同,在抑菌5 d時,添加8 mmol·L-1硫辛酸處理的水漬化程度顯著高于CK,抑菌處理10和15 d時,添加2、4和8 mmol·L-1硫辛酸處理的水漬化程度與CK的差異均未達到顯著水平。
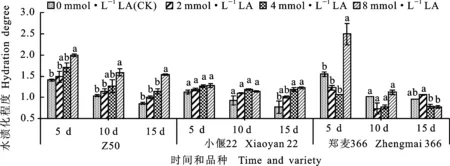
圖5 硫辛酸濃度對抑菌處理后各品種水漬化程度的影響
2.3 甜菜堿處理對抑菌階段愈傷組織的影響
2.3.1 甜菜堿處理對抑菌階段愈傷組織褐化程度的影響
如圖6所示,統計了甜菜堿處理下Z50和小偃22愈傷組織的褐化程度,由于鄭麥366處理較少,不具有統計學意義,故未計入其中。在抑菌5 d的愈傷組織中,添加10 mmol·L-1甜菜堿的Z50表現為褐化程度加深,而在抑菌的第10 和15 d,添加甜菜堿的愈傷組織褐化程度低于對照,但差異均未達到顯著水平。而添加甜菜堿后,在抑菌的第5、10和15 d,小偃22愈傷組織的褐化程度均高于對照,但差異均未達到顯著水平。說明添加10 mmol·L-1甜菜堿對這兩個品種愈傷組織褐化程度的影響都不明顯。
2.3.2 甜菜堿處理對抑菌階段愈傷組織水漬化程度的影響
由圖7可知,在對Z50、小偃22幼胚愈傷組織遺傳轉化的抑菌階段,添加10 mmol·L-1的甜菜堿略微降低了愈傷組織的水漬化程度,但處理5、10和15 d后與CK的差異均未達到顯著水平。說明添加10 mmol·L-1甜菜堿對Z50和小偃22水漬化程度的影響均不明顯。
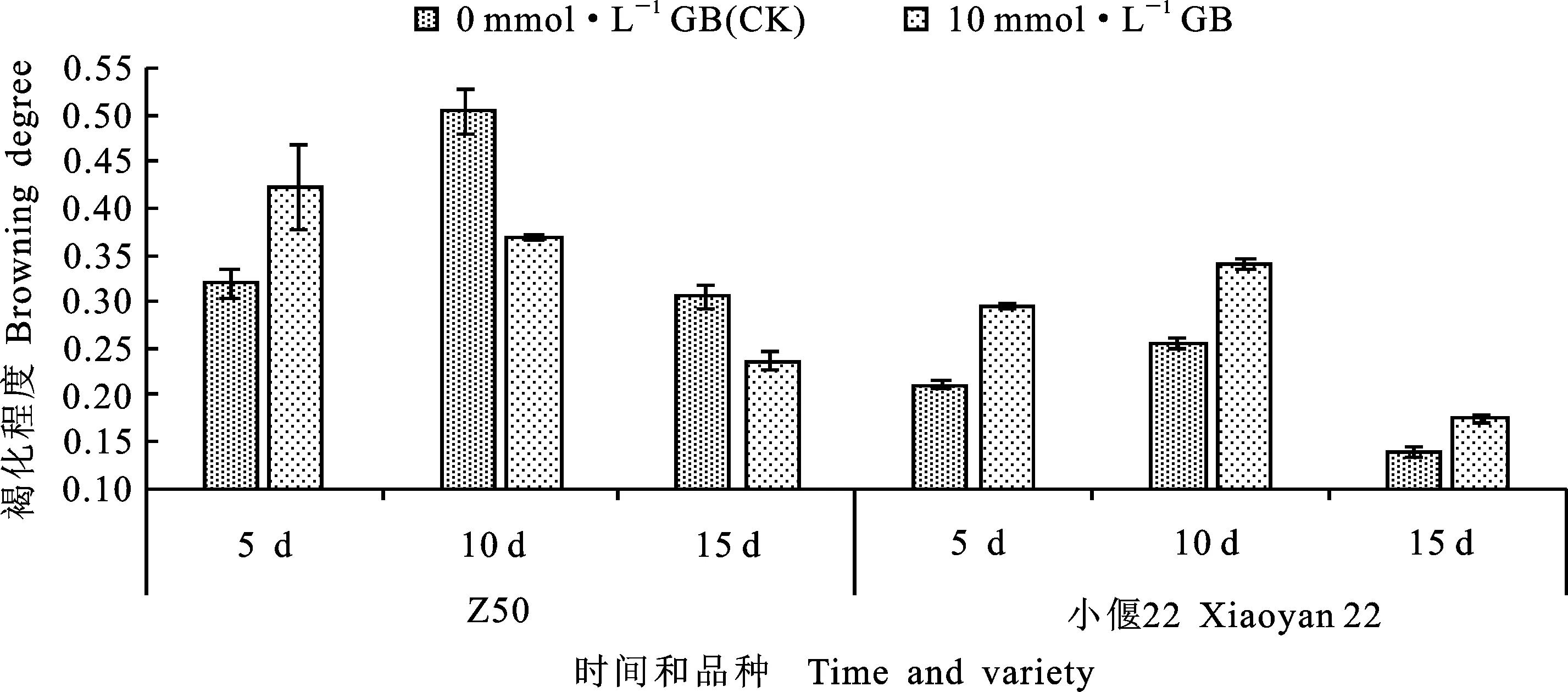
圖6 甜菜堿濃度對抑菌處理后Z50和小偃22褐化程度的影響
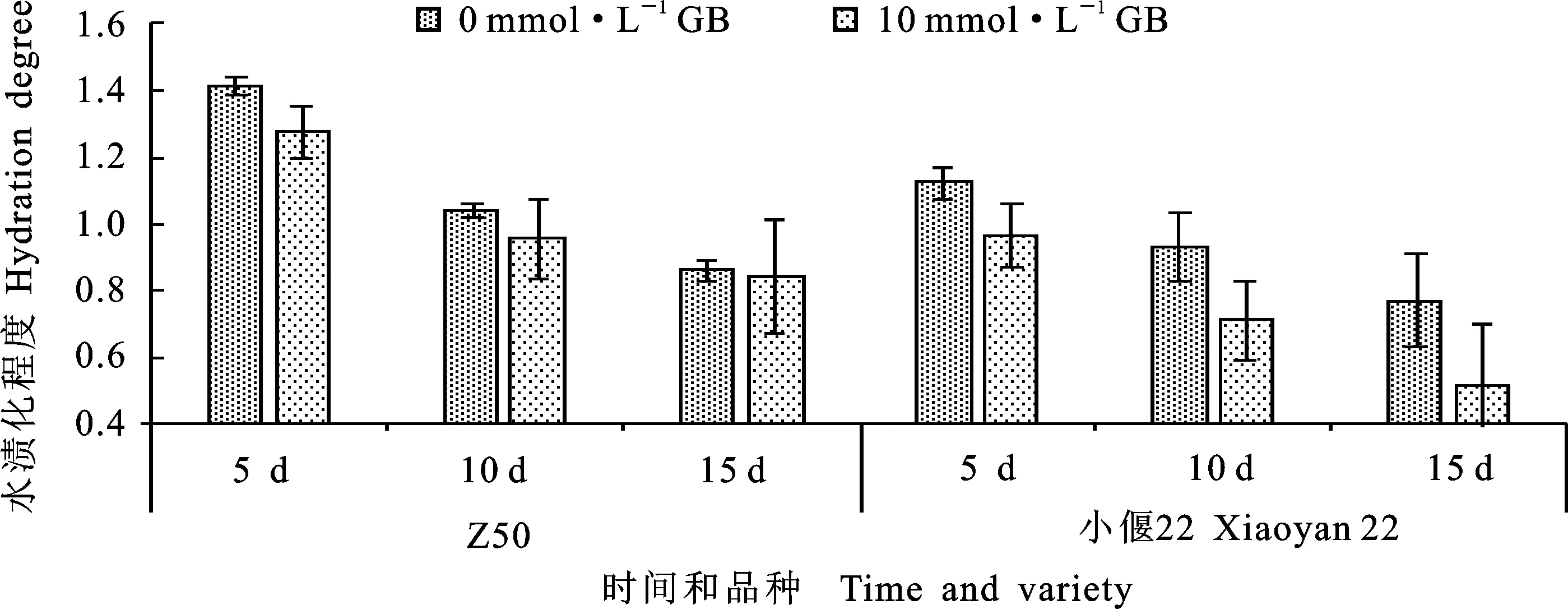
圖7 甜菜堿濃度對抑菌處理后Z50和小偃22水漬化程度的影響
3 討 論
本研究發現,硫辛酸可以有效地降低小麥幼胚愈傷組織的褐化程度,但也會提高愈傷組織的水漬化程度,這可能是由于小麥幼胚愈傷組織的不適應造成的。且在后期的繼續培養中發現,添加硫辛酸濃度較高的處理組,愈傷組織生長緩慢甚至停止生長,考慮可能由于硫辛酸濃度過高,處理時間過長,導致愈傷組織受到毒害。所以筆者認為,硫辛酸雖在抑制褐化方面具有一定的作用,但在添加時間、濃度、添加方法等方面還需進一步的研究。
甜菜堿作為一種滲透調節物質,可以參與細胞的滲透調節,外源甜菜堿可提高小麥幼苗SOD和APX的活性,緩解活性氧帶來的傷害[15]。但本研究發現,甜菜堿對小麥品種Z50和小偃22幼胚愈傷組織的褐化程度及水漬化程度均無明顯影響,這可能是因為這兩個品種對甜菜堿都不敏感的緣故。前人的一些研究證明甜菜堿的添加與品種有關,例如孫文越等[16]研究發現,外源甜菜堿對“黑芒”小麥受到干旱脅迫引起的傷害具有加深作用;而趙博生等[17]的研究卻表明,外源甜菜堿可降低干旱/鹽脅迫對“京核 931”小麥生長的抑制作用。

