大花序桉試管苗生根及移栽試驗
周小華,張 偉,黃志萍,張海忠,王炳南,湯建福,謝 恩
(1.福建生態工程職業技術學校,福建 福州 350008; 2.漳州市林業局,福建 漳州 363000;3.漳州長泰巖溪國有林場,福建 長泰 363900; 4.漳州平和天馬國有林場,福建 平和 363700)
大花序桉(EucalyptuscloezianaF.Muell)又名昆士蘭桉,為桉樹屬昆士蘭桉亞屬(Idiogenes)樹種,自然分布于澳大利亞,大喬木,高可達45 m,在土壤深厚、排水較好、潮濕的土壤上生長良好[1]。具有較強的生長潛力,尤其是后期生長優勢非常明顯,是優良的大徑材培育樹種[2]。大花序桉木材黃褐色、紋理通直、結構均勻、硬度高,廣泛用于家具、建筑、礦柱、坑木等[3]。但由于大花序桉引種的種源少,且開花結實量較少,更重要的是,大花序桉與其它桉樹一樣,屬異花蟲媒樹種,種內容易雜交,子代分化嚴重。因此無性繁殖成為大花序桉良種繁殖的重要手段[4]。而大花序桉是難生根樹種,扦插生根極難[5],因此組培繁育顯得尤為重要。目前國內大花序桉組織培養研究雖有成功報道但仍處于實驗室階段[5-8]。本試驗在大花序桉誘導及增殖研究的基礎上,探討培養基種類、植物生長調節劑種類及濃度、生根苗閉瓶及開瓶煉苗時間、移栽基質等因子對大花序桉試管苗生根及移栽成活的影響,以期獲得大花序桉生根、移栽成活的最適條件。
1 材料與方法
1.1 試驗材料
試驗材料采用漳州市選育的大花序桉優株莖段為外植體,經誘導增殖后獲得的無根試管苗。
1.2 試驗方法
1.2.1 壯苗培養 壯苗培養的目的是將經過繼代增殖培養得到的組培苗進一步培養,以改善部分瓶苗原有芽體細弱、矮小、葉片開展狀態差等狀況,為下一步提高芽體的生根率和成活率打下基礎,增強植株的抗性。
將經過增殖培養獲得的叢生試管苗切成適當的大小,接種到以改良MS+瓊脂5.5 g·L-1+蔗糖30 g·L-1為基本培養基,附加不同濃度和不同種類的植物生長調節物質的壯苗培養基上(表1)。
每處理每種配方33瓶,每個處理接種10~11瓶,重復3次,每重復樣本數約50株。在培養室溫度為(25±2) ℃,濕度為60%~70%,光照強度為1300~1500 lx,每日光照時間為12 h的條件下壯苗培養。
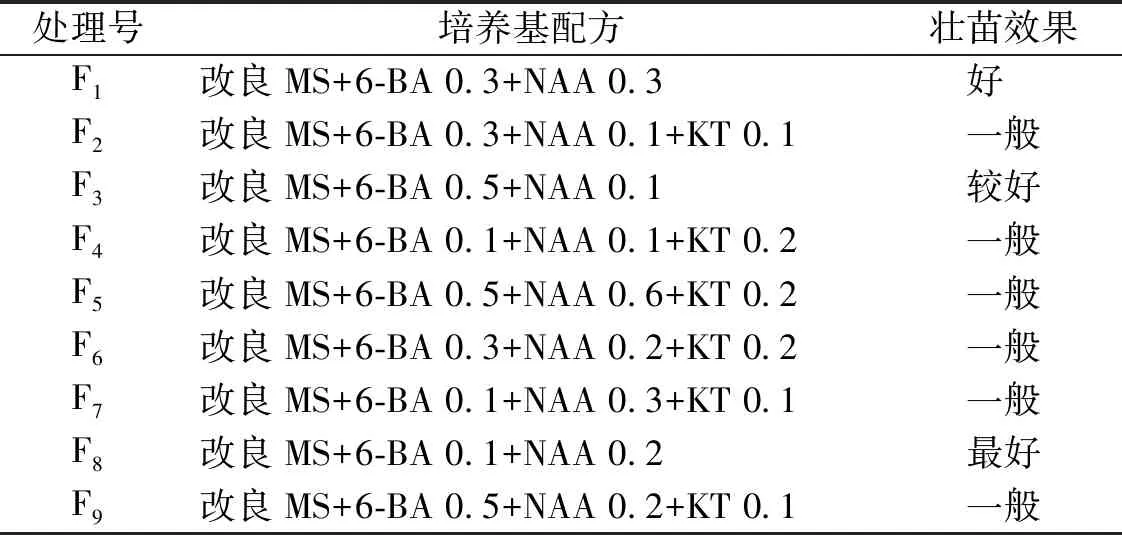
表1 壯苗培養試驗設計及效果
*:培養基配方中植物生長調節劑單位為mg·L-1;所有培養基均添加蔗糖(分析純)30 g·L-1,瓊脂5.5 g·L-1。下同。
1.2.2 生根培養 采用經壯苗培養后苗高2 cm左右的健壯芽苗作為生根材料,進行生根誘導。以基本培養基、IBA、NAA、6-BA、IAA 5個因子為試驗因素,其水平分別為:基本培養基(MS、1/2 MS、1/4 MS、1/2改良MS)、IBA(0、0.2、0.5、1.0 mg·L-1)、NAA(0、0.3、0.6、1.0 mg·L-1)、6-BA(0、0.1、0.3、0.6 mg·L-1)、IAA(0、0.05、0.1、0.5 mg·L-1)(表2)采用5因素4水平的L16(45)正交試驗設計(表3)。
每處理每種配方33瓶,每個處理接種10~11瓶,每瓶接種3~5株芽苗(一般為4株),重復3次,每重復樣本數約30~50株。在培養室溫度為(25±2) ℃,濕度為60%~70%,光照強度為1500~1800 lx,每日光照時間為12 h的條件下生根培養。
1.2.3 煉苗移栽
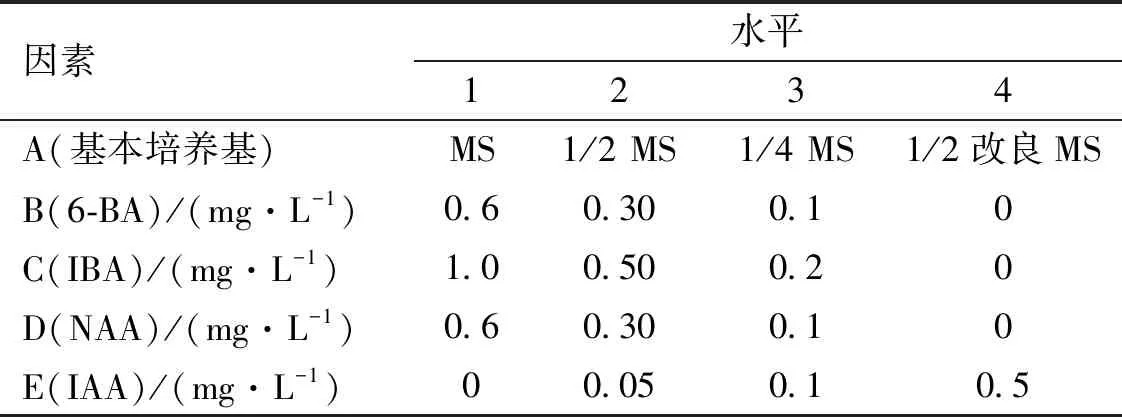
表2 生根培養試驗因子水平表
1)煉苗。將生長健壯、挺拔,根系生長良好,株高>2 cm的健壯生根瓶苗移出培養室,置于室外(常溫下即可,一般煉苗室溫度控制在18~23 ℃為宜),采用以下方式進行煉苗試驗:S1:閉瓶鍛煉3 d,開瓶鍛煉0 d;S2:閉瓶鍛煉3 d,開瓶鍛煉3 d;S3:閉瓶鍛煉3 d,開瓶鍛煉6 d;S4:閉瓶鍛煉6 d,開瓶鍛煉0 d;S5:閉瓶鍛煉6 d,開瓶鍛煉3 d;S6:閉瓶鍛煉6 d,開瓶鍛煉6 d;此外設一對照組,即直接將試管苗從培養瓶中取出進行移栽,不經過煉苗階段。共計7個處理,隨機區組設計排列,重復2次。
煉苗后的試管苗小心從瓶內取出,洗凈根部附著的培養基,移栽到已用0.1%高錳酸鉀消毒處理的煉苗移栽基質中,注意移苗后最初30 d對幼苗的保溫、保濕。
2)移栽基質選擇。煉苗后經處理的試管苗移栽在細沙(T1)、田園土(T2)、加入鉀肥等混合基質的花土(T3) 3種基質上,隨機區組排列,重復3次。
1.3 數據收集及處理
用誘導增殖后獲得的無根試管苗接入生根培養基后,每3 d進行觀察統計,生根培養30 d時進行生根情況調查,調查其初始生根時間、生根數量、長度等;煉苗與移栽階段,每1~3 d觀察1次,煉苗約7~10 d左右調查其成活率;移栽30 d后調查統計其成活率。調查結果按下列方法統計相關指標。
生根率(%)=生根株數/培養芽數×100%;煉苗成活率(%)=成活苗數/煉苗總數×100%;移栽成活率(%)=成活苗數/移栽總數×100%。
2 結果與分析
2.1 壯苗培養
將經過繼代增殖培養獲得的叢生組培苗切成適當的大小,接種到壯苗培養基中,光照培養至組培苗達到2 cm以上高度時再進行生根培養試驗。壯苗培養基的選擇主要是考慮減少細胞分裂素的刺激以促進植株生長為生根培養打下基礎。根據苗高長至2 cm左右的時間及苗是否健壯、有無分枝等生長情況現場判定壯苗效果,結果見表1。由表1可知,壯苗培養最佳培養基配方為編號F8的改良MS+6-BA 0.1 mg·L-1+NAA 0.2 mg·L-1培養基。
2.2 生根培養
生根情況一般分為2種:一種是先在莖段基部產生愈傷組織,再從愈傷組織中分化出不定根;還有一種是直接從莖段基部皮層生出不定根(圖1)。通過不同配方對生根效果的影響(表3)發現編號為G16的1/2 MS+IBA 0.5 mg·L-1+NAA 0.6 mg·L-1+IAA 0.1 mg·L-1生根效果最好,經適當調整培養基配方后生根率可達86.9%以上,且主根發達,側根較多,枝葉長勢較好。

表3 生根培養試驗正交設計及效果
*:培養30 d時觀察生根培養結果。
2.3 煉苗移栽
2.3.1 不同煉苗方式對組培苗成活率的影響 從7種煉苗方式對組培苗成活率的影響比較來分析,不同的煉苗方式對組培苗成活率的影響明顯(表4)。編號為S3即閉瓶鍛煉3 d,開瓶鍛煉6 d,以及編號為S6即閉瓶鍛煉6 d,開瓶鍛煉6 d,此2種煉苗成活率最高,達到95%以上。
2.3.2 不同移栽基質對移栽成活率的影響 從3種移栽基質配方對比看,其中移栽成活率最高的為加入鉀肥等混合基質的花土(T3),其移栽成活率達96%以上,且木質化程度最高,生長健壯(表5)。
移栽一般在春季進行,移栽后要加強管理(包括病蟲害防治),尤其是移栽后30 d內應注意保濕、保溫,以提高移栽成活率。
3 結論與討論
3.1 壯苗培養
通過壯苗培養試驗得知,壯苗培養基的選擇主要是考慮減少細胞分裂素的刺激以促進植株生長,為生根培養打下基礎。通過試驗壯苗培養最佳培養基配方為編號F8的改良MS+6-BA 0.1 mg·L-1+NAA 0.2 mg·L-1培養基。
壯苗培養是大花序桉組織培養過程中一個重要的環節,經過壯苗培養能夠有效提高試管苗的抗性,健壯其苗體,為生根培養做好準備。在對大花序桉組培苗進行壯苗培養的時候發現6-BA與NAA有協同作用,它們的協同作用只有通過調整NAA或6-BA的濃度來促進其生長,從而達到壯苗目的。
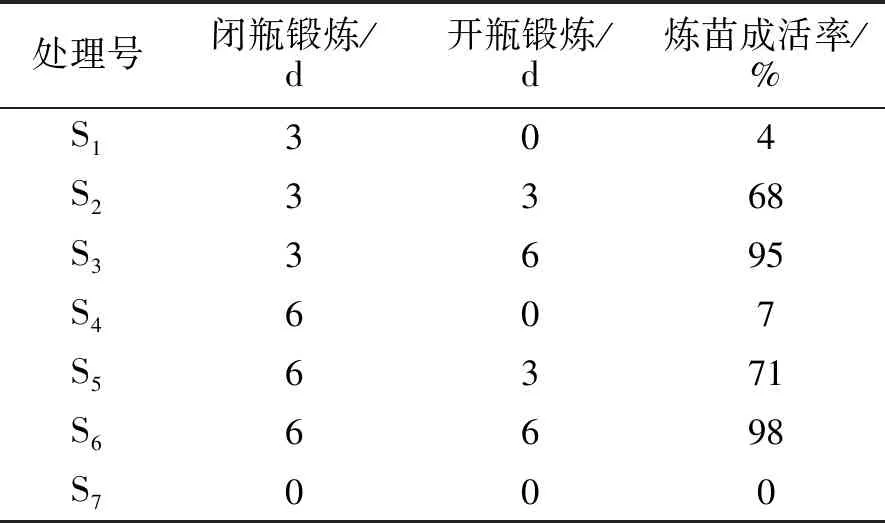
表4 不同煉苗方式對組培苗成活率的影響

表5 不同移栽基質對移栽成活率的影響
3.2 生根培養

圖1 大花序桉生根培養效果
通過生根培養觀察分析可以看出,基本培養基、IBA、NAA、蔗糖對生根率的影響均較大。從不同配方對生根效果的影響發現編號為G16的1/2 MS+IBA 0.5 mg·L-1+NAA 0.6 mg·L-1+IAA 0.1 mg·L-1生根效果最好,經適當調整培養基配方后生根率可達86.9%以上,且主根發達,側根較多,枝葉長勢較好。
植物根的發生需要建立一種最佳的內源生長素/細胞分裂素平衡。在許多植物種類的組織培養中,較低的細胞分裂素和較高的生長素組合可以產生較佳的生根效果。而在實際操作中,絕大多數植物的生根都是可以根據各種生長素的作用特點單獨或配合使用實現的。
3.3 煉苗移栽
從煉苗試驗觀察看,編號為S3即閉瓶鍛煉3 d,開瓶鍛煉6 d,以及編號為S6即閉瓶鍛煉6 d,開瓶鍛煉6 d,此2種煉苗成活率最高,平均達到95%以上。在3種移栽基質配方對比看,其中移栽成活率最高的為花土中加入鉀肥等的混合基質(T3),其移栽成活率高達96%以上,且木質化程度最高,生長健壯。
煉苗移栽失敗的原因主要有以下幾個方面:①煉苗方式和時間不當;②根部附著的培養基未洗凈,根與移栽基質未完全密接;③試管苗的葉表面保護組織細嫩不發達,葉結構發育不全;④組培瓶苗光合能力較弱,葉綠體發育不完善,莖部木質化不夠等。因此在煉苗初期應注意提供最有利于植物生長生根發芽的外界環境,如采取措施適當增加環境的濕度,控制溫度在20 ℃左右,逐步增強光照,配制適宜的保濕透氣營養豐富酸堿度適宜的移栽基質等,讓植物體逐步適應外界環境,提高煉苗移栽的成活率。
*:本項目得到漳州市林業局韓金發、何水東2位高級工程師;福建農林大學陳禮光副教授;長泰巖溪國有林場張友育高級工程師的大力支持與幫助。在此表示最誠摯的謝意!

