造紙法再造煙葉濃縮液中微生物群落結構分析及應用
王 充,龍章德,孟丹丹,蘇 贊,劉 鴻,鄒克興,許春平*
1. 鄭州輕工業學院食品與生物工程學院,鄭州高新技術產業開發區科學大道136 號 450002
2. 廣西中煙工業有限責任公司技術中心,南寧市北湖南路28 號 530001
以煙梗、煙末和碎煙葉等煙草廢棄物為原料,利用造紙法原理加工生產的產品,稱造紙法再造煙葉[1-2]。造紙法再造煙葉生產過程中,以水為萃取劑對煙梗、煙末和碎煙葉等原料進行浸提,然后將浸提液經固液分離和高溫濃縮后的溶液,稱為造紙法再造煙葉濃縮液[3]。對再造煙葉的生產工藝技術的研究,尤其是微生物在再造煙葉生產上的應用是煙草行業的研究熱點之一[4-8]。駱莉等[9]利用淀粉酶和糖化酶,以及生香酵母、植物乳桿菌等微生物對煙梗提取液進行改良,結果表明煙梗提取液的香味成分增加,且能夠改善卷煙煙氣和口感;戴麗君等[10]、周蓉等[11]利用酵母對煙梗萃取液進行發酵處理,處理后的萃取液與未發酵萃取液相比,萃取液香氣成分含量提高;張勃等[12]利用從紅花大金元品種煙葉表面分離的菌株對煙梗水提物進行發酵處理,處理后煙梗水提物的再造煙葉樣品香氣豐度與香氣量增加、木質雜氣減少、細膩性與甜潤感改善,抽吸品質有較大提高。因此,利用有益微生物能夠提高再造煙葉品質。
目前對煙葉和煙田土壤中的微生物群落已有較多報道[13-14],對微生物的開發利用大多集中于煙葉或煙田及其他材料中分離得到的菌株,并將其應用于煙葉醇化發酵以改善煙葉品質,對造紙法再造煙葉方面的報道也僅限于煙草萃取液中的細菌群落組成研究[15],其他真菌群落及相關研究鮮見報道。為此,以造紙法再造煙葉濃縮液為研究對象,應用MiSeq 測序平臺對真菌18S rDNA 和細菌16S rDNA 測序,研究濃縮液內微生物真菌和細菌的群落結構,并利用其內部微生物進行發酵,卷制再造煙葉單料煙評價其發酵效果,旨在為有益微生物在造紙法煙草薄片上的應用提供支持。
1 材料與方法
1.1 樣品采集
2016 年8 月在河南卷煙工業煙草薄片有限公司的造紙法再造煙葉生產車間取煙草片基100 g,另取再造煙葉濃縮液500 mL 樣品4 個,并將收集的濃縮液樣品在無菌條件下混勻為1 個試驗樣品,于-10 ℃條件下帶回實驗室,進行發酵試驗。
1.2 試驗方法
1.2.1 樣品基因組DNA 提取
使用Stool Genomic DNA kit 試劑盒(北京康為世紀生物科技有限公司,貨號:CW2092S)提取樣品基因組DNA。
1.2.2 PCR 擴增和MiSeq 測序
對細菌16S rDNA 的V3~V4 區域進行擴增,擴增片段為470 bp,引物為16s-f:PE1-CCTACGG GNGGWGCAG 和 16Ss-r:PE2-GACTACHVGGG TATCTAATCC( PE 為測序接頭,大小為70 bp)。對真菌18S rDNA 的V4 區域進行擴增,擴增片段為180 bp,引物 為18s-f:PE1-GCGGTAATTCCAG CTCCAA 和18s-r:PE2-AATCCRAGAATTTCACC TCT。PCR 反應體系終體積為25 μL,DNA 聚合酶為KAPA HiFi DNA 聚合酶。16S rDNA 的PCR 擴增反應條件:94 ℃預變性3 min、94 ℃變性30 s、55 ℃退火30 s、72 ℃延伸40 s,循環25 次;最后72 ℃延伸10 min。18S rDNA 的PCR 擴增反應條件:94 ℃預變性3 min、94 ℃變性30 s、55 ℃退火30 s、72 ℃延伸30 s、循環25 次;最后72 ℃延伸10 min。PCR 擴增產物使用2%的瓊脂糖凝膠電泳檢測,目標條帶檢驗合格后,使用MiSeq 測序,測序委托上海祥音生物科技有限公司完成。
1.2.3 測序數據處理與分析
①去除Miseq 測序時加入的引物和接頭序列,再根據PE reads 之間的overlap 關系,將成對的reads 拼接成1 條序列,然后按照Barcode 標簽序列識別并區分樣品得到數據;②使用Usearch 和Uchime 及 數 據 庫(RDP 數 據 庫 、Silva 數 據 庫 和NCBI 16S 數據庫)去除非特異性擴增序列和嵌合體,得到有效序列。③根據序列間的相似性在97%水平上將序列分成不同的操作分類單元(Operational taxonomic unit,OTU)聚類,然后在OTU 聚類結果的基礎上,選擇豐度最高的序列作為OTU 的代表性序列進行各類OTU 分析。 ④從每個OTU 中選擇1 條代表序列,使用RDP classifier 2.2 依據GreenGenes 數據庫為OTU 序列分配分類單元,并定義分類單元中相對豐度低于0.5%的類別都歸為其他種群,相對豐度大于5%的種群定義為優勢菌。使用OriginPro9.0 根據分類單元內的種群豐度繪制每個分類單元的餅狀圖。⑤使用Mothur 1.31.2 軟件計算樣品的Coverage 和Alpha 多樣性指數,包括香農指數(Shannon Index)、ACE 指數、Chao 1 指數、辛普森指數等[16-17]。
1.2.4 濃縮液發酵與化學成分測定
取50 mL 濃縮液于錐形瓶中,放置在搖床內發酵24、48 和72 h,搖床內溫度為30 ℃,振蕩速率120 r/min。采用標準方法[18]測定還原糖和總糖含量(質量分數)。
1.2.5 再造煙葉樣品評吸
取未發酵和發酵24、48 和72 h 后的濃縮液以39%涂布率涂布在煙草片基上,在(40±2)℃的烘箱內烘干后置于相對濕度(65±2)%,溫度(22±2)℃恒溫恒濕箱中48 h,分別切絲和卷制成單料煙。再將單料煙在溫度(22±2)℃,相對濕度(60±5)%的恒溫恒濕箱中平衡48 h 后,由廣西中煙工業有限責任公司產品室具有評吸資質的技術人員8 人按照標準方法[19]進行評吸。
1.2.6 數據處理
再造煙葉濃縮液的化學指標均重復測定3 次,計算其平均值和標準差。利用SPSS 軟件用Duncan新復極差法進行處理間差異顯著性的多重比較。
2 結果與分析
2.1 濃縮液微生物的群落結構分析
2.1.1 濃縮液微生物18S rDNA 和16S rDNA 的PCR 產物分析
由圖1 可知,16S rDNA 的V3-V4 區域擴增片段 在500 bp 左 右 ,18S rDNA 的V4 區 域 擴 增 片 段在250 bp 左 右 ,18S rDNA 和16S rDNA 的PCR 產物條帶清晰明亮,無雜帶,擴增片段大小與預設擴增片段大小一致,表明PCR 產物可進行下一步測序分析。
圖1 濃縮液微生物的18S rDNA 和16S rDNA 的PCR 產物電泳圖Fig.1 Electrophoretogram of 18S rDNA and 16S rDNA PCR products of microorganisms in concentrated liquid
2.1.2 濃縮液微生物測序分析
對造紙法再造煙葉濃縮液內真菌18S rDNA和細菌16S rDNA 的有效序列進行計算得到微生物多樣性指數,見表1。由表1 可知,濃縮液內真菌18S rDNA 和細菌16S rDNA 測序的覆蓋度均大于95%,說明樣品測序結果代表了樣本內微生物的真實情況;18S rDNA 的序列數大約是16S rDNA序列數的4 倍,若以序列數代表微生物的數目,造紙法再造煙葉濃縮液內的真菌占總微生物的80.98%,細菌占總微生物的19.02%;造紙法再造煙葉的濃縮液真菌18S rDNA 共形成548 個OTU,細菌16S rDNA 共形成5 295 個OTU,18S rDNA 序列的香農指數、ACE 指數、Chao1 指數明顯低于16S rDNA 序列,辛普森指數高于16S rDNA 序列,說明濃縮液內的真菌豐富度和多樣性低于細菌。
2.1.3 濃縮液中微生物的門水平多樣性分析
利用GraPhlAn 軟件,對造紙法再造煙葉的濃縮液真菌產生的548 個OUT,根據每個樣本的分類學比對結果選出優勢物種,再結合物種豐度信息生成環形樹狀圖,見圖2。
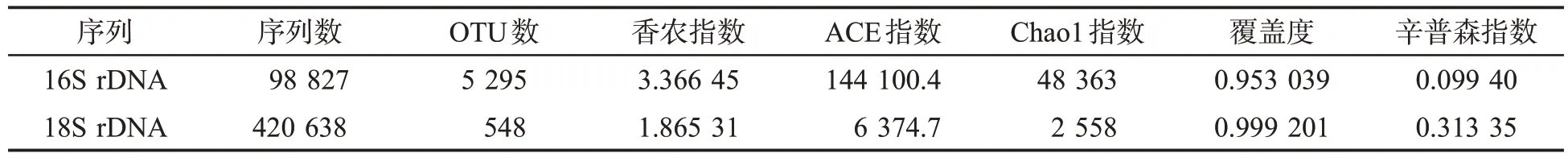
表1 造紙法再造煙葉濃縮液微生物多樣性指數分析Tab.1 Microbial diversity index analysis of concentrated liquid of paper-making reconstituted tobacco

圖2 微生物群落分類與系統發育樹狀圖Fig.2 Classification and phylogenetic tree of microbial communities
圖2 中部為豐度前100 個物種進化分類屬,并將豐度前20 個物種(以星號標出)所對應的門按不同的顏色標出,分別為A 梭菌屬(Clostridium sensu stricto)、B 鏈球菌屬(Streptococcus)、C 酸桿菌屬(Lactobacillus)、D 魏 斯 氏 菌 屬(Weissella)、E(Enterococcus)、F(Aeribacillus)、G 芽 孢 桿 菌 綱(Bacillus) 、H (Streptophyta) 、I 鮑 特 菌 屬(Bordetella)、J(Achromobacter)、K 叢毛單胞菌屬(Comamonas)、L 蒼白桿菌屬(Ochrobactrum)、M 新根瘤菌屬(Neorhizobium)、N 根瘤菌(Rhizobium)、O固氮螺菌(Azospirillum)、P 腸桿菌(Enterobacter)、Q大腸桿菌志賀菌(Escherichia/Shigella)、R 黑草屬(Buchnera)、S 寡養單胞菌(Stenotrophomonas)、T 不動桿菌屬(Acinetobacter)。
由圖2 可以看出,樣本中微生物分為4 類,藍藻/葉綠體(Cyanobacteria/Chloroplast)、厚壁菌門(Firmicutes)、變形菌門(Proteob acteria)和未被分類區。以界為中心,向外依次為門、綱、目、科、屬和種。圈和星號的大小代表豐度大小。外圍環為熱力圖,每一環為1 個樣本(組),每個樣本對應1種顏色。顏色深淺隨物種豐度而變化,物種豐度越大,顏色越深。
本試驗濃縮液中微生物群落結構從門水平上分析,優勢菌群為子囊菌門(Ascomycota)、厚壁菌門(Firmicutes)和變形菌門(Proteobacteria);從屬水平上分析,濃縮液中的優勢菌群為釀酒酵母屬(Kazachstania)、假絲酵母屬(Candida)和Ogataea、乳 酸 桿 菌 屬 (Lactobacillus) 、鏈 球 菌 屬(Streptococcus)和Aeribacillus。這與趙銘欽等[20]、邱立友等[21]、朱大恒等[22]研究發現的烤煙煙葉表面微生物種群主要是細菌、霉菌和放線菌;而霉菌中曲霉(Aspergillus)為優勢菌群的結果不一致,說明烤煙煙葉表面微生物種群的優勢菌群(細菌)與再造煙葉濃縮液中優勢種群(真菌)差異很大,這可能與再造煙葉濃縮液的生產原料和加工過程,以及濃縮液的理化性質有關。但再造煙葉濃縮液中優勢種群是如何影響再造煙葉的香味成分仍有待進一步研究。
2.2 微生物發酵對濃縮液還原糖和總糖含量的影響
微生物發酵過程中,碳源對于微生物生長和代謝產物積累至關重要[23],因此發酵液中還原糖和總糖含量對濃縮液發酵及再造煙葉的生產有重要影響。由表2 可知,濃縮液發酵前48 h,還原糖和總糖含量緩慢下降;發酵48~72 h 之間,還原糖和總糖含量迅速下降,說明濃縮液中的微生物在發酵48 h 前消耗的碳源很少,生長緩慢,屬于遲緩期;48~72 h 之間生長繁殖較旺盛,需要大量的碳源供應,屬于生長期和穩定期。

表2 微生物發酵對濃縮液還原糖和總糖含量的影響①Tab.2 Effects of microbial fermentation on contents of reducing sugar and total sugar in concentrated liquid
2.3 微生物發酵對再造煙葉感官品質的影響
由感官評吸結果(表3)可知,發酵時間48 h 和72 h 的濃縮液能夠提高再造煙葉的香氣量和協調性,提升舒適度。這可能與濃縮液中微生物在48 h至72 h 之間快速生長繁殖,發酵產生一些次級代謝產物,改變了濃縮液中的某些化學成分有關。

表3 再造煙葉評吸結果的比較Tab.3 Sensory evaluation results of reconstituted tobacco
3 結論
造紙法再造煙葉濃縮液微生物的群落結構中主要為真菌種群,含有少量細菌種群。濃縮液中的真菌占總微生物的80.98%,細菌占總微生物的19.02%,濃縮液中的真菌含量高于細菌。真菌種群中的優勢菌屬為釀酒酵母屬(Kazachstania)、假絲酵母屬(Candida)和Ogataea;細菌種群優勢菌屬為乳酸桿菌屬(Lactobacillus)、鏈球菌屬(Streptococcus)和Aeribacillus。通過18S rDNA 序列與16S rDNA 序列的Alpha 多樣性指數比較,真菌種群的豐富度和多樣性低于細菌;利用濃縮液微生物在30 ℃條件下振蕩發酵72 h,可明顯提高再造煙葉的香氣量,改善舒適度。

