《中國藥典》2010版與2015版微生物限度檢查法對兩種制劑檢測結果的比較研究
賈 輝,姚 東,王作君,張敬一
0 引言
本研究以2013年“軍隊醫療機構制劑標準提高專項科研課題”的總體要求作為依據,從各個方面對原軍規(《中國人民解放軍醫療機構制劑規范》)制劑復方碘溶液稀釋液和鹽酸環丙沙星魚肝油滴鼻乳進行提升,包括對制劑處方進行校正、對制劑的工藝中各詳細的參數進行明確、增加了薄層鑒別項,建立了含量測定方法并進行驗證等,力求該制劑經此研究之后,質控水平與現行版中國藥典同步。
按照《中國藥典》2010版方法已經建立和驗證的復方碘溶液稀釋液和鹽酸環丙沙星魚肝油滴鼻乳微生物限度檢查法,但《中國藥典》2015版在試驗培養基、菌種的選用、微生物計數及控制菌檢查方法等方面均有較大的修訂。本文參考相關文獻[1-3],采用兩種制劑(復方碘溶液稀釋液和鹽酸環丙沙星魚肝油滴鼻乳),以《中華人民共和國藥典(2010版)》和《中華人民共和國藥典(2015版)》中的微生物限度檢查要求為依據,重新考察方法學并完成3次平行驗證,從而對兩種方法之間的差別進行比較,確定并驗證改進后測定方法的優勢,同時提出選用薄膜過濾法對這兩種制劑進行微生物限度檢查,排除干擾徹底,方法可行,適合作為復方碘溶液稀釋液和鹽酸環丙沙星魚肝油滴鼻乳的藥檢室常規檢查方法。
1 儀器與材料
1.1 儀器 生物安全柜(型號:BSC-ⅡA2,上海上凈凈化設備有限公司),電熱恒溫培養箱(型號:DH6000 BⅡ,AISITE),4 ℃恒溫冰箱(廣東科龍),霉菌生化培養箱(spx-250BⅢ),立式壓力蒸汽滅菌鍋(型號:YXQ-LS-50A,上海博迅實業有限公司),集菌儀(型號:Htyteritest 601,杭州泰林醫療器械廠),一次性薄膜過濾器(規格:HTY-101,浙江泰林生物技術股份有限公司)。
1.2 菌種 金黃色葡萄球菌菌株[CMCC(B)26003],大腸埃希菌菌株[CMCC(B)44102],枯草芽孢桿菌菌株[CMCC(B)63501],黑曲霉菌菌株[CMCC(B) 98003],白色念珠菌菌株[CMCC(F)10123],銅綠假單胞菌菌株[CMCC(B)10104],均購自中國食品藥品檢定研究院。
1.3 培養基 氯化鈉蛋白胨緩沖液(批號:101123),膽鹽乳糖培養基(批號:111117),玫瑰紅鈉瓊脂培養基(批號:100522),乳糖膽鹽發酵培養基(批號:100224),胰酪大豆胨培養基(瓊脂)(批號:141125),胰酪大豆胨培養基(液體)(批號:140903),沙氏葡萄糖培養基(瓊脂)(批號:140513),營養瓊脂培養基(批號:100407),pH 7.0氯化鈉蛋白胨緩沖液(批號:121105),營養肉湯培養基(批號:110517),麥康凱培養基(液體)(批號:131230),麥康凱培養基(瓊脂)(批號:140926),蛋白胨水培養基(批號:121022),均購自于北京三藥科技開發公司。
1.4 試藥 復方碘溶液稀釋液(規格:100 ml/瓶,沈陽軍區總醫院生產,批號:20141210、20150108、20150307),鹽酸環丙沙星魚肝油滴鼻乳(規格:8 ml/支,沈陽軍區總醫院生產,批號:20150323、20150505、20150614)。
2 方法與結果
2.1 微生物限度檢查制備方法(2010年版《中國藥典》)
2.1.1 各類試驗菌液的制備(大腸埃希菌菌株、金黃色葡萄球菌菌株、枯草芽孢菌菌株) 將新鮮培養的各菌株培養物接種到營養肉湯的培養基中,置于培養箱(30~35 ℃)中,培養時長18~24 h。精密吸取1 ml培養物,加入9 ml 0.9%無菌氯化鈉溶液,制成含菌數為50~100 cfu/ml的菌懸液。用于控制菌驗證時,制備成每1 ml含菌落數<100 cfu的菌懸液。
白念菌液的制備:將白色念珠菌的新鮮培養物接種至改良馬丁培養基中,置于培養箱(23~28 ℃)中,培養時長24~48 h。培養物精密吸取1 ml,加入9 ml 的0.9%無菌氯化鈉溶液,制成的菌懸液濃度為含菌數50~100 cfu/ml。
黑曲菌液的制備:將黑曲霉菌的新鮮培養物接種到改良馬丁培養基的瓊脂斜面上,放置于培養箱(23~28 ℃)中,培養約1周(5~7 d),加入含0.05%(v/v)聚山梨酯80的0.9%無菌氯化鈉溶液3~5 ml,將黑曲霉菌孢子慢慢洗脫。用吸管(帶有棉花濾過功能)將菌液緩慢吸出至無菌的試管中,用0.9%無菌氯化鈉溶液[含0.05%(v/v)聚山梨酯80],制成黑曲霉菌菌懸液濃度為含霉菌孢子數50~100 cfu/ml。
2.1.2 供試液制備 用移液管精密量取10 ml復方碘溶液稀釋液,加pH 7.0無菌氯化鈉-蛋白胨緩沖液至100 ml,混勻,制成的供試液比例為1∶10。
取鹽酸環丙沙星魚肝油滴鼻乳10 ml,加pH 7.0無菌氯化鈉-蛋白胨緩沖液至100 ml,混勻,靜置10 min,取上清液,制成的供試液比例為1∶10。
2.1.3 驗證試驗 ①計數試驗-細菌、霉菌、酵母菌(采用薄膜過濾法):將配制好的1∶10供試液1 ml注入薄膜過濾器中,每膜約用300 ml或500 ml沖洗液(pH 7.0蛋白胨-氯化鈉緩沖液),沖洗3~5次,在最后一次沖洗液中用注射器注入50~100 cfu試驗菌液,抽干后輕取膜,貼于預先鋪至好的營養瓊脂平板中央上,倒置培養,按薄膜過濾法,同法測定其菌落數,對菌液組和供試品對照組的菌落數進行測定。按公式 [各菌株的回收率(%)=(試驗組菌落平均數-供試品對照組菌落平均數)/ 菌液組的菌落平均數×100%] 計算各菌株回收率,結果見表1。
②檢查控制菌-大腸埃希菌菌株、銅綠假單胞菌菌株和金黃色葡萄球菌菌株的檢查:各取供試液(1∶10比例)10 ml并相應的菌懸液1 ml,加至100 ml的相應培養基中,按2010年版《中國藥典》控制菌檢驗方法檢查[4-5]進行驗證,結果見表2。
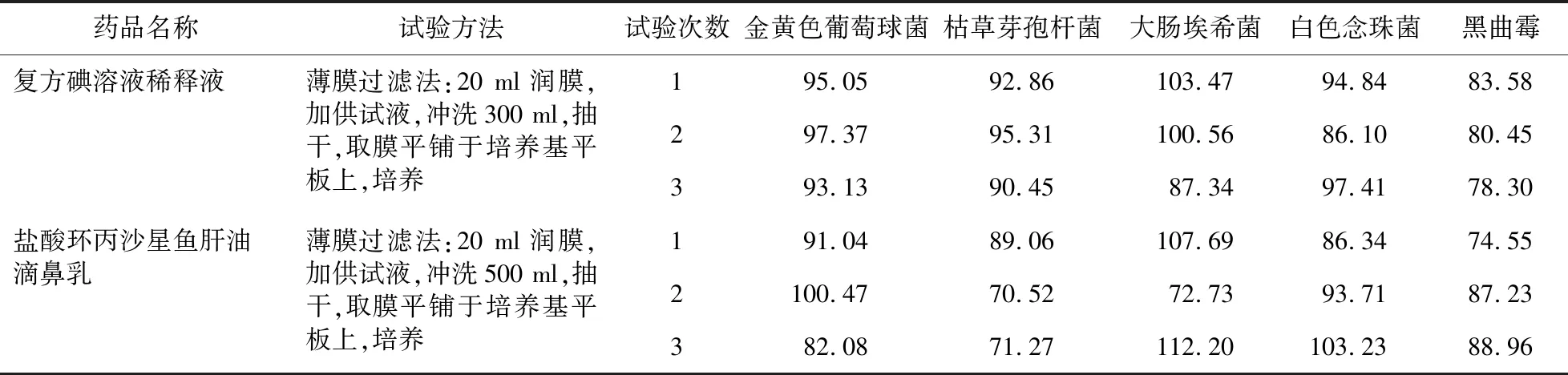
表1 《中國藥典》2010版兩種制劑細菌、霉菌、酵母菌計數試驗結果

表2 《中國藥典》2010版兩種制劑控制菌檢查試驗結果
2.2 微生物限度檢查方法(2015年版《中國藥典》)
2.2.1 各試驗菌液的制備(大腸埃希菌菌株、金黃色葡萄球菌菌株、枯草芽孢桿菌菌株、銅綠假單胞菌菌株) 將新鮮培養的培養物接種至培養基(胰酪大豆胨液體培養基)中,置于培養箱(30~35 ℃)中,培養時長為18~24 h;精密吸取1 ml培養物,用0.9%無菌氯化鈉溶液將菌懸液配制成合適的濃度。在進行控制菌驗證時,用于制成每1 ml含菌落數<100 cfu的菌懸液。
白念菌液的配制:將新鮮培養的培養物接種至培養基(沙氏葡萄糖液體培養基)中,置于霉菌培養箱(20~25 ℃)中,培養時間為2~3 d;用0.9%的無菌氯化鈉溶液將培養物制成合適濃度的白念菌懸液[6]。
黑曲菌液的配制:將新鮮培養的培養物接種至培養基(沙氏葡萄糖瓊脂培養基)斜面上,放置于霉菌培養箱(20~25 ℃)中,培養時長5~7 d,加入0.9%無菌氯化鈉溶液[含0.05%(v/v)吐溫80]3~5 ml,緩慢地將黑曲霉菌孢子洗脫下來。用吸管(帶有棉花濾過)將菌液吸出至無菌的試管中,用0.9%的無菌氯化鈉溶液[含0.05%(v/v)吐溫80]制成合適濃度的黑曲霉菌懸液[6]。
2.2.2 供試液的制備 用移液管精密量取10 ml復方碘溶液稀釋液,加pH 7.0無菌氯化鈉-蛋白胨緩沖液至100 ml,混勻,供試液比例為1∶10。
取鹽酸環丙沙星魚肝油滴鼻乳10 ml,加入緩沖液(pH 7.0無菌氯化鈉-蛋白胨)至100 ml,混勻,靜靜放置10 min,吸取上清液,作為1∶10的供試液。
2.2.3 計數方法適用性試驗 ①需氧菌總數的檢查(薄膜過濾法):取配制好的1∶10供試液10 ml,置于已經滅菌的試管中,加入相應試驗菌液0.1 ml,從而使其最終濃度為菌落數不大于100 cfu/ml,反復吹打數次混合均勻,用移液管從試管中轉移1 ml注入100 ml的緩沖液(pH 7.0無菌氯化鈉-蛋白胨)中,慢慢濾過,分次沖洗,抽干后,用鑷子取膜,輕輕貼于預先鋪好的胰酪大豆胨瓊脂平板上,倒置培養,完成試驗組菌落數的測定,以相同的方法進行菌液組和供試品對照組菌落數測定。
按公式[各菌株回收率=(試驗組的菌落平均數-供試品對照組的菌落平均數)/ 菌液對照組的菌落平均數]計算各菌株的回收率,結果見表3。
②霉菌和酵母菌總數檢查:用移液管精密量取10 ml的1∶10供試液于滅菌試管中,注入0.1 ml相應的試驗菌液使其最終菌液濃度為每1 ml不大于100 cfu,反復吹打數次混合均勻,用移液管從試管中轉移1 ml注入100 ml pH 7.0無菌氯化鈉-蛋白胨的緩沖液中,濾過,沖洗,抽干,用鑷子取膜,輕貼于沙氏葡萄糖瓊脂平板上,培養溫度20~25 ℃,完成試驗組菌落數的測定,相同的方法進行菌液組和供試品對照組的菌落數的測定。
按照公式[各菌株回收率=(試驗組的菌落平均數-供試品對照組的菌落平均數)/菌液對照組組的菌落平均數]計算回收率,結果見表4。
2.2.4 檢查控制菌(大腸埃希菌、銅綠假單胞菌和金黃色葡萄球菌) 用移液管各精密量取10 ml的供試液(比例為1∶10)并相應的菌懸液1 ml,注入100 ml的胰酪大豆胨培養基(液體)中,按2015年版《中國藥典》中控制菌檢驗方法檢查[7]進行驗證,結果見表5。
2.3 三批樣品的檢測及結果比較 分別取2種制劑的3批樣品,分別按“2.1.2”項下方法制備供試品溶液,依據新舊版藥典的方法檢查。兩種方法檢驗結果的比較見表6、表7。
3 討論
3.1 復方碘溶液稀釋液為口服補碘劑,具有調節甲狀腺功能的作用,用于單純性甲狀腺腫及甲狀腺功能亢進者手術前的輔助用藥;鹽酸環丙沙星魚肝油滴鼻乳可抑制細菌生長,減少炎性糜爛,潤滑鼻黏膜,促進黏膜血液循環,用于萎縮性鼻炎及其他原因引起的鼻黏膜干燥等癥。因兩種制劑均具有一定的抗菌消炎作用,在微生物計數試驗中有抑菌現象,因此,在考察了常規平皿法、直接接種法、培養基稀釋法的基礎之上,本研究選用薄膜過濾法進行兩種制劑的微生物限度檢查。
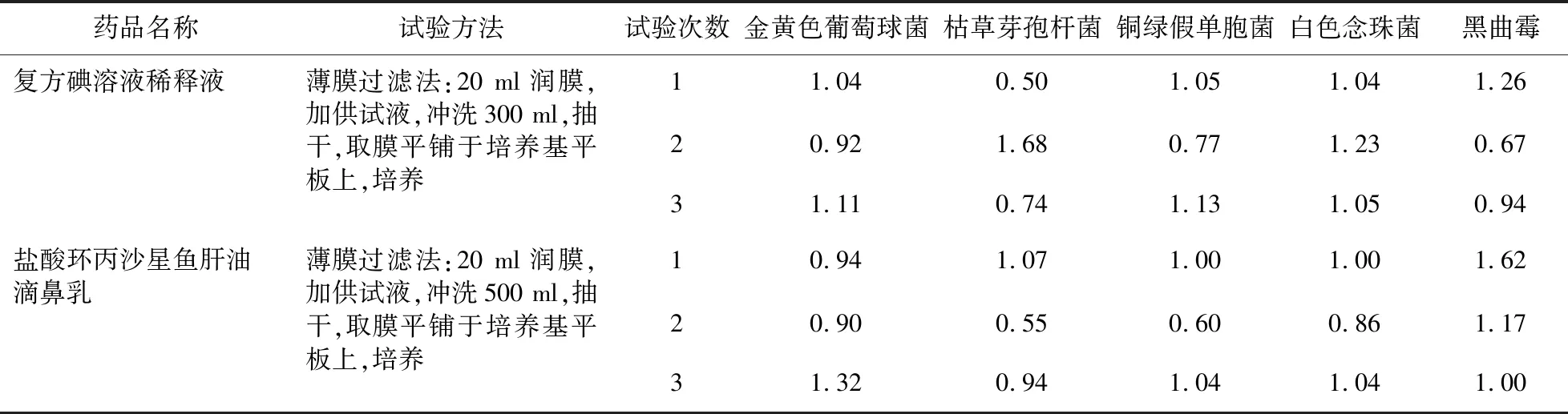
表3 《中國藥典》2015版方法兩種制劑需氧菌總數計數試驗結果
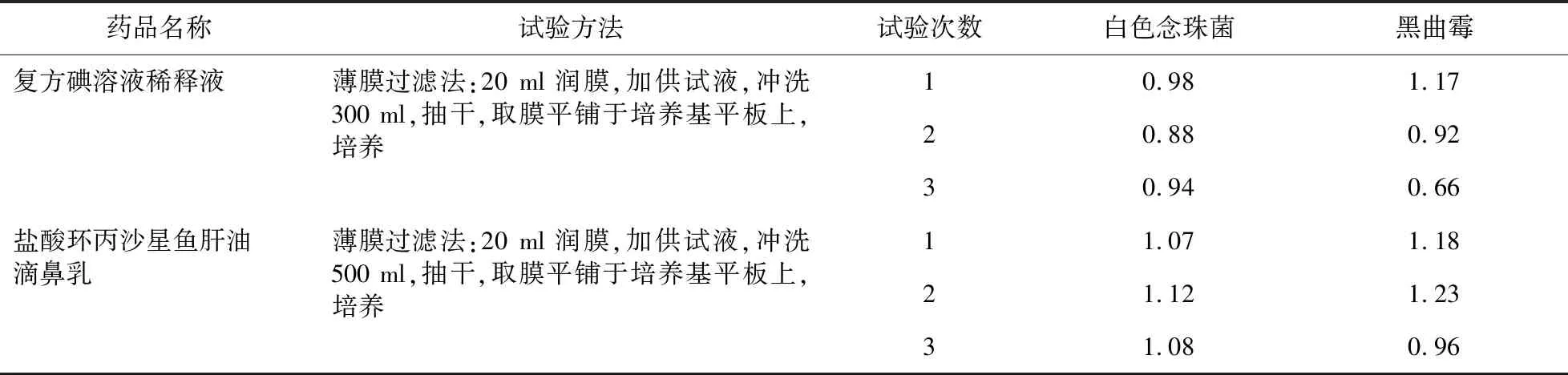
表4 《中國藥典》2015版方法兩種制劑霉菌、酵母菌總數試驗結果

表5 《中國藥典》2015版方法控制菌適用性檢查結果
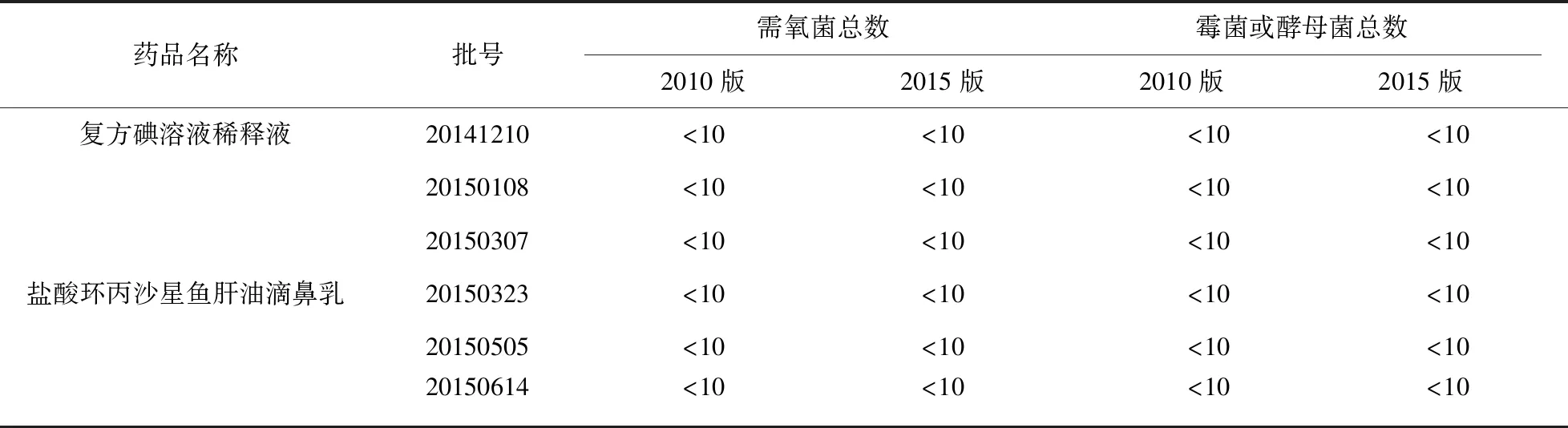
表6 兩種方法檢測3批樣品微生物計數試驗結果比較
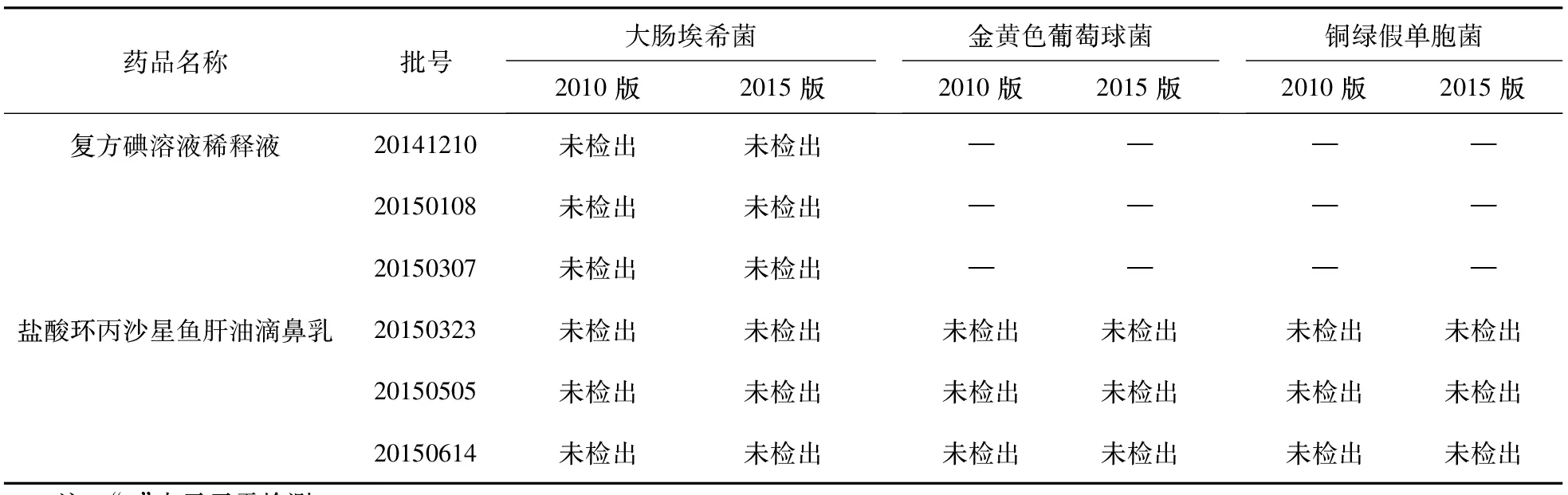
表7 兩種方法檢測3批樣品控制菌檢查試驗結果比較
注:“—”表示無需檢測
3.2 2010版和2015版藥典在回收率的計算和控制范圍兩個方面均有修訂 2010版藥典的回收率結果用百分比“%”表示,回收率不低于70%為合格;而2015版藥典回收用數值表示,回收在0.5~2.0范圍之間合格。相比較而言,2015版藥典回收率的范圍更寬。
3.3 控制菌的檢查中存在增菌培養的重要步驟 在細菌計數試驗的過程中有明顯抑菌的品種,在控制菌的檢查過程中采用最為方便常用的直接接種法就能檢出試驗菌株。對抑菌活性較強而常規方法不能排除的制劑品種,筆者選用直接接種法和培養基稀釋法進行了試驗,發現兩種方法均有干擾,故需要采用薄膜過濾法才能取得好的效果[8-9]。為使檢查結果獲得良好的準確性和重現性,培養基注入時體積應盡量保持一致,且方法驗證需進行3次獨立完整的平行試驗,這一原則貫穿整個試驗始終。
4 結論
綜上所述,無論《中國藥典》2010版,還是2015版,復方碘溶液稀釋液和鹽酸環丙沙星魚肝油滴鼻乳微生物限度均選擇采用薄膜過濾法對細菌、霉菌及酵母菌及控制菌進行限度檢查,且兩版藥典的試驗結果基本一致,但新版藥典的專屬性更高,出現假陽性的幾率更低,2015版《中國藥典》中收載的微生物限度檢查法更適合藥物制劑的微生物限度檢查。

