溶劑系統極性在高速逆流色譜分離油橄欖葉多酚類化合物過程中的影響
王 玉,全凱軍,段文達,黃新異,郭 玫,邸多隆*
1中國科學院蘭州化學物理研究所 中國科學院西北特色植物資源化學重點實驗室 甘肅天然藥物重點實驗室;2甘肅中醫藥大學藥學院,蘭州 730000
高速逆流色譜(High-speed counter-current chromatography,HSCCC)自20世紀80年代初由美國科學家Ito博士研究開發以來,已經被廣泛用于天然產物分離純化領域,成為了一種新型而又高效的分離純化技術。與傳統柱色譜、制備液相色譜相比,HSCCC具有分離效率高、過程簡單、樣品不易被吸附等優勢[1]。在整個HSCCC分離過程中溶劑系統的篩選和優化是至關重要的,在構建HSCCC分離方法的過程中,溶劑系統的篩選和優化占整個分離過程的40%~90%[2]。目前,溶劑系統選擇的方法主要是通過查閱大量相關文獻并參照已知溶劑系統,根據要分離化合物的基本理化性質尋找同類型化合物的分離實例。以此為依據,結合被分離的目標化合物調整實例中溶劑體系的極性并進行HSCCC分離。另外,還可以通過測定分配系數對溶劑系統進行篩選,如高效液相色譜法(HPLC)法測定溶質在上、下兩相中的分配情況。具體方法是將樣品溶解在等體積的所選溶劑系統的上下相混合體系中,然后通過HPLC測定其在其中一相(固定相)峰面積(A1);接著測定樣品在另一相(流動相)中的峰面積(A2),最后通過分配系數計算公式:K=A1/A2,算得K值。這也是篩選溶劑系統最常用的一種方法。因此,發展高效的HSCCC溶劑系統篩選與優化方法,是提高HSCCC分離效率的關鍵因素之一,也是近年來該技術領域研究熱點之一。目前,HSCCC溶劑系統通常由不同種類的非極性溶劑和極性溶劑組成的兩相或三相溶劑體系,在HSCCC分離中,最常用的溶劑系統是Ito建立的一套溶劑體系,該溶劑體系由正己烷-乙酸乙酯-甲醇-正丁醇-水按不同的體積比組成[3]。Oka等設計了由正己烷、乙酸乙酯、正丁醇、甲醇和水組成的溶劑體系。該溶劑體系覆蓋的極性范圍較寬,從非極性的正己烷/甲醇/水(2∶1∶1,v/v/v)到極性的正丁醇-水(1∶1,v/v),利用這一溶劑體系能夠對多種樣品實現分離[4]。Foucault等將非極性溶劑體系正己烷/乙腈(1∶1,v/v)和極性溶劑體系正丁醇/水(1∶1,v/v)結合起來,配制成了7種溶劑體系—HBAW體系,這其中既有二元的、三元的也有四元的溶劑系統。HBAW體系對那些能夠很好地溶解于正丁醇和乙腈(乙腈也可以用甲醇代替)中的樣品非常適用[5],劉言娟[6]研究的的液-液/固三相溶劑系統被用于分離天然產物分離。
油橄欖葉是木犀科木犀欖屬(Olea)常綠喬木植物油橄欖(OleaeuropaeaL.)的干燥葉,其主要化學成分是多酚、黃酮、有機酸、揮發油等化合物。研究表明油橄欖葉具有保護心肌、抗氧化、抗炎、抗癌以及神經保護等藥理作用,其中橄欖苦苷和木犀草素-7′-O-β-D-葡萄糖苷(如圖1)多酚類化合物是其主要有效成分[7-9]。
本文以油橄欖葉中的2種主要有效成分-橄欖苦苷和木犀草素-7′-O-β-D-葡萄糖苷為目標化合物(化學結構見圖1),通過系統考察正己烷-乙酸乙酯-甲醇-水系統不同比例組成的兩相溶劑系統對目標化合物分離的影響,探討目標化合物極性和溶劑系統極性在HSCCC分離過程中的相關性,旨在為HSCCC溶劑系統快速篩選、提高HSCCC在復雜體系中分離制備目標化合物的效率提供技術支持。
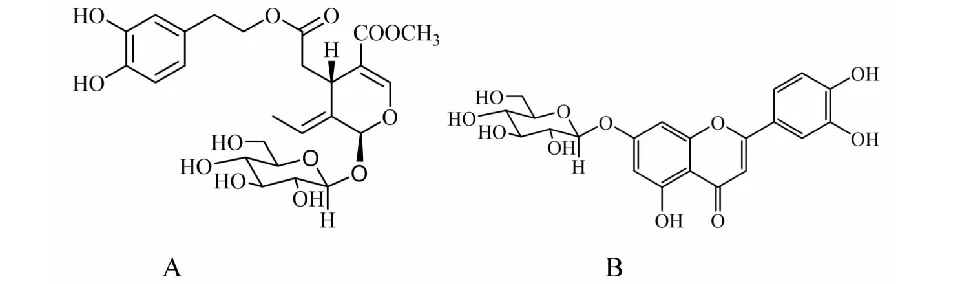
圖1 兩種目標化合物的化學結構Fig.1 The chemical structures of two target compounds注:A代表橄欖苦苷;B 代表木犀草素-7′-O-β-D-葡萄糖苷Note∶ A indicated Oleuropein;B indicated Luteolin-7-O-β-D-glucoside
1 實驗方法
1.1 儀器、試劑與材料
TBE-300B型高速逆流色譜儀(上海同田生物技術股份有限公司,中國),包括TBD-2000 UV檢測器和TBP-1002型恒壓恒流泵(上海同田生物技術股份有限公司,中國)。Agilent 1200液相色譜儀(Agilent Technologies,美國),包括:G1312A 恒流泵,G1315B 檢測器,G1328B 手動進樣器和 Agilent Chemstation software工作站;Sinochrom ODS-BP液相色譜柱(250 mm ×4.6 mm,5 μm);KQ-250DE型數控超聲清洗機(昆山超聲儀器有限公司,中國);BT224S型萬分之一電子分析天平(北京賽多利斯儀器系統有限公司,中國)。
實驗用正己烷、乙酸乙酯、甲醇(天津市富宇精細化工有限公司,中國;分析純),所用水為蒸餾水。乙腈為色譜純(江蘇漢邦科技有限公司,中國);乙酸為色譜純(利安隆博華醫藥化學有限公司,中國)。橄欖苦苷對照品(美國,Sigma 公司,純度:98.9%,批號:BCBN4404N)、木犀草素-7′-O-β-D-葡萄糖苷對照品(中國,四川省維克奇生物科技有限公司,純度:98.0%,批號:wkq16052202)。
油橄欖葉采于甘肅省隴南市,經鑒定為木犀欖屬植物油橄欖OleaeuropaeaL.的葉,樣本保存在西北特色植物資源化學重點實驗室。
1.2 油橄欖葉提取物的制備
稱取干燥的油橄欖葉250 g,加入9~10倍量的60%乙醇溶液,于75 ℃加熱回流提取2 次,每次1 h,濾過,合并2 次濾液,濾液減壓回收乙醇后,烘干,即得油橄欖葉提取物提取物,備用。
1.3 HSCCC分離
1.3.1 分配系數K的測定
溶劑系統的選擇根據目標化合物在兩相溶劑體系中的分配系數K值。具體過程如下:稱取油橄欖葉提取物20 mg,置于10 mL試管中,加入平衡后的上、下相各2 mL振蕩使其完全溶解、靜置分層,取上、下相各0.5 mL減壓干燥,待干燥后分別用0.5 mL甲醇溶解,經0.45 μL濾膜過濾并進行HPLC檢測分析。上、下兩相峰面積分別為A1、A2,K=A1/A2。
1.3.2 兩相溶劑體系及樣品溶液的制備
本實驗所選擇的溶劑系統為正己烷-乙酸乙酯-甲醇-水,分別按不同比例配制1 000 mL置于1 L分液漏斗中,充分振蕩使其混合均勻并于室溫靜置24 h且分層。待兩相溶劑分層后分別取出上、下兩相(上、下兩相分別為固定相和流動相)并于20 ℃超聲脫氣20 min,備用。
取油橄欖葉提取物樣品500 mg加入流動相(下相)20 mL使其完全溶解,即得樣品溶液。
1.3.3 HSCCC分離
將固定相(上相)以20 mL/min的流速泵入高速逆流色譜儀的聚四氟乙烯螺旋管中,待固定相(上相)充滿螺旋管后,開啟高速逆流色譜儀,調整轉速為950 rpm,同時流動相(下相)以1.5 mL/min的流速泵入充滿固定相后的螺旋管中,待末端有流動相流出時,即螺旋管中上下相已達到動態平衡。將1.3.2項下制備的樣品溶液從進樣閥中注入高速逆流色譜儀,開啟檢測器并設置檢測波長為232 nm,根據色譜圖收集各餾分。各餾分按1.3.4項下色譜條件進行HPLC檢測分析并采用面積歸一化法計算純度。
1.3.4 HPLC條件
色譜條件參考文獻[9]:色譜柱:Sinochrom ODS-AP液相色譜柱 (250 mm ×4.6 mm,5 μm)流動相:A為0.2%的乙酸水溶液,流動相B為乙腈。梯度洗脫:0~25 min 18%~31% (B);25~35 min 31% (B);35~45 min 31%~50% (B);進樣量:20 μL;流速:1.0 mL·min-1;溫度:25 ℃;檢測波長:232 nm。
2 結果和分析
2.1 兩相溶劑對2種目標化合物分離過程影響的考察
2.1.1 分配系數K的測定
本研究根據兩種目標化合物性質,參考文獻[3]選擇HEMW系統(正己烷-乙酸乙酯-甲醇-水),考察正己烷-乙酸乙酯-甲醇-水系統9種不同比例組成的兩相溶劑系統對目標化合物分離的影響。按照1.3.1項分配系數K的測定方法,測定2種化合物在9種溶劑系統中的K值,結果見表1。
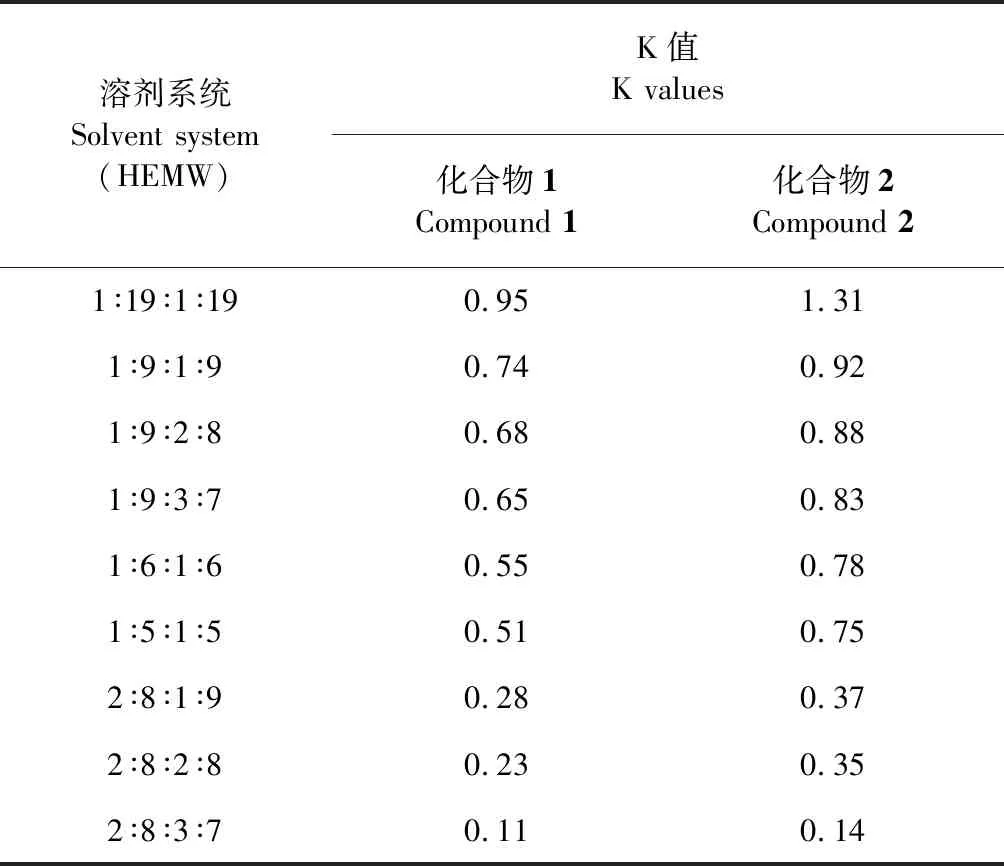
表1 兩種化合物在9種溶劑系統中的分配系數
2.1.2 不同溶劑系統對分離的影響考察
將2.1.1項經測定分配系數K后,從6種HEMW溶劑系統中選擇K值在0.5~2之間的6種溶劑系統,繼續在HSCCC上進行目標化合物分離結果的考察,結果見圖2。按照1.3.4項下HPLC色譜條件對6種不同溶劑系統分離所得目標化合物進行分析。目標化合物橄欖苦苷(化合物1)和木犀草素-7′-O-β-D-葡萄糖苷(化合物2)的色譜圖見圖3、4。圖2可知,隨著溶劑系統K值的增大,橄欖苦苷和木犀草素-7′-O-β-D-葡萄糖苷2種化合物在其兩相溶劑系統(1∶5∶1∶5,v/v)、(1∶6∶1∶6,v/v)、 (1∶9∶2∶8,v/v)、(1∶9∶3∶7,v/v)、(1∶9∶1∶9,v/v)、(1∶19∶1∶19,v/v)的親水性和溶解性依次呈現先增強后減弱趨勢,但因溶劑系統(1∶9∶2∶8,v/v)保留時間過短導致其分離度較差,而在溶劑系統(1∶9∶3∶7,v/v)中分配能力最佳且分離效果呈現最好。因此,隨著溶劑系統極性的增強,分離效率呈現先增強后減弱的趨勢。
由圖2可知:本實驗溶劑系統采用6種HEMW溶劑系統[(1∶19∶1∶19,v/v)、(1∶9∶1∶9,v/v)、(1∶9∶2∶8,v/v)、(1∶9∶3∶7,v/v)、(1∶6∶1∶6,v/v)、(1∶5∶1∶5,v/v)],按照1.3.2項下所述方法對油橄欖葉提取物進行HSCCC分離并根據HSCCC圖譜(如圖2)進行分段接樣。將收集所得各組分于60 ℃減壓旋蒸干燥并對其進行HPLC檢測分析(如圖3、4)。
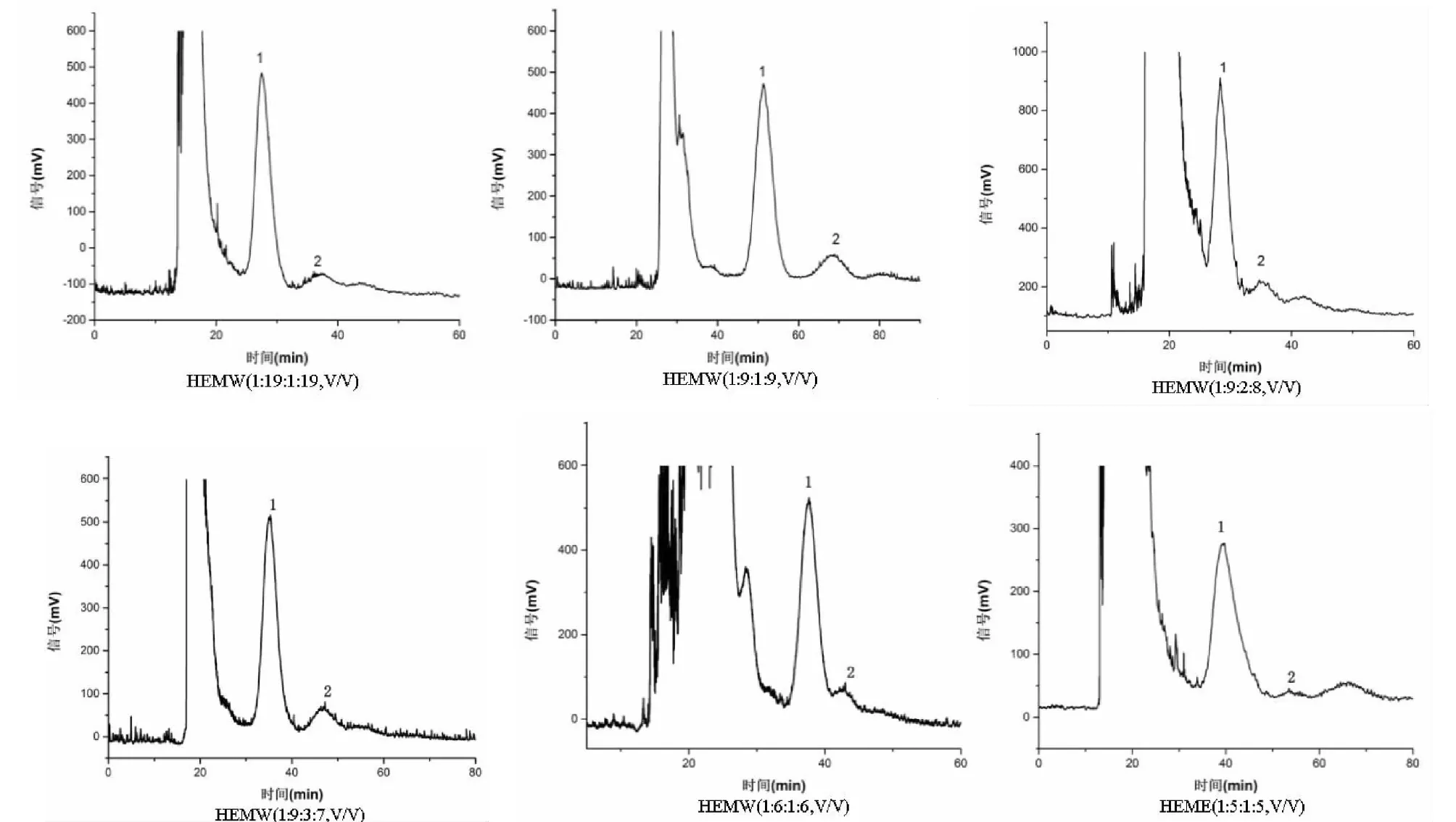
圖2 6種不同溶劑系統分離橄欖苦苷、木犀草素-7′-O-β-D-葡萄糖苷的HSCCC圖Fig.2 HSCCC chromatograms of Olive leaves in 6 solvent systems注1-橄欖苦苷,2-木犀草素-7′-O-β-D-葡萄糖苷。Note:1-Oleuropein;2-Luteolin-7′-O-β-D-glucoside.
圖3 化合物1在不同溶劑系統分離后的HPLC色譜圖Fig.3 HPLC chromatogram of compound1 in 6 solvent systems
2.2 溶劑系統極性和目標化合物極性對分離結果的影響
2.2.1 溶劑系統和目標化合物的極性
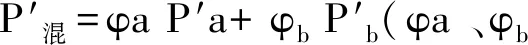
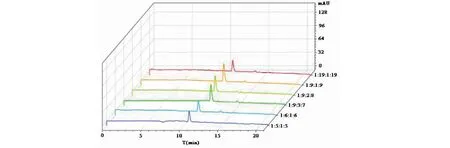
圖4 化合物2在不同溶劑系統分離后的HPLC色譜圖Fig.4 HPLC chromatogram of compound 2 in 6 solvent systems
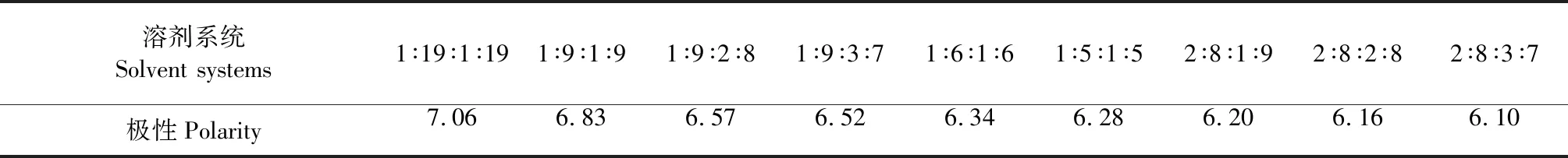
表2 9種溶劑系統的極性
2.2.2 溶劑系統和目標化合物的極性對K值的影響
以表1、表2中的溶劑系統極性變化和和對應K值做圖,見圖5。

圖5 溶劑系統的極性(Polarity)與分配系數(K)之間的關系Fig.5 The relationship between polarity of the solvent system and partition coefficient K values
由圖5的可以看出:隨著溶劑系統極性的增加,化合物1和化合物2的K值呈現增加的趨勢。這是由于K值是化合物在兩相溶劑系統中的分配系數,由于化合物1和2的LogP值分別為-2.23和-4.58,表明兩個化合物的親水性較強。根據相似相溶原理,化合物在于其親水性相近的溶劑中溶解性最好。溶劑系統極性的增加使溶劑系統中上相和下相的極性同時增大,化合物1和2在上相和下相的溶解性同時增大,但是在上相中增大的速率大于下相中增大的速率,因此K值隨著溶劑系統極性的增加逐漸變大。溶劑系統極性的增加促進了化合物在上相中的分布,有利于化合物的分離。同時從圖5中還可以看出:隨著溶劑系統極性的增加,化合物2K值增加的趨勢大于化合物1K值增加的趨勢,表明親水性越強的化合物(LogP值越小),溶劑系統極性變化對其K值的影響越明顯,因此溶劑系統同樣的極性變化,親水性強的化合物在上相中分布增加的更多,在一定極性范圍內,化合物親水性越強,K值隨著溶劑系統極性增大而增加的趨勢越大。
2.2.3 最佳溶劑系統的篩選
在HSCCC過程中最具挑戰的工作是溶劑體系的篩選過程,而選擇一個最佳的溶劑體系主要是通過測定樣品在該溶劑體系中的分配系數K值來確定,合適的K值應該接近1并且理想的K值應該介于0.5~2之間[11]。當K>2.5時,出峰時間過長,峰形變寬;當K<0.5時,出峰時間太快,組分之間的分離度較差。由表1可知:通過測定目標化合物在9種不同比例中的分配系數K值,在正己烷-乙酸乙酯-甲醇-水(2∶8∶1∶9,v/v)、(2∶8∶2∶8,v/v)、(2∶8∶3∶7,v/v) 3種溶劑體系中化合物1、化合物2的K值均小于0.5,這三種溶劑體系會導致兩化合物分離時間太短,分離效果差,作為HSCCC的溶劑體系不合適。因此,實驗采用正己烷-乙酸乙酯-甲醇-水溶劑比例分別為(1∶19∶1∶19,v/v)、(1∶9∶1∶9,v/v)、(1∶9∶2∶8,v/v)、(1∶9∶3∶7,v/v)、(1∶6∶1∶6,v/v)、(1∶5∶1∶5,v/v) 6種溶劑系統在HSCCC上進行兩種化合物分離考察。通過K值適宜的6種溶劑系統對2種化合物在HSCCC上的實際分離。由圖2可知,溶劑系統(1∶19∶1∶19,v/v)、(1∶9∶2∶8,v/v)、(1∶6∶1∶6,v/v)和(1∶5∶1∶5,v/v)分離效果不理想,溶劑系統(1∶9∶1∶9,v/v)雖然分離效果較好,但其出峰時間太晚。綜合考慮,溶劑系統(1∶9∶3∶7,v/v;化合物1和化合物2的保留時間分別為35 min和47 min)為最佳的溶劑系統。
2.3 化合物的分離制備
以2.2.3項篩選的最佳溶劑系統[HEMW(1∶9∶3∶7,v/v)],按照1.3.2項下制備溶劑體系及樣品溶液,按照1.3.3項下HSCCC分離條件進行分離得到的化合物1(橄欖苦苷)和化合物2(木犀草素-7′-O-β-D-葡萄糖苷)。所得化合物1和化合物2按照1.3.4 項下HPLC法進行分析,并用橄欖苦苷和木犀草素-7′-O-β-D-葡萄糖苷對照品溶液進行標定和歸一化法純度檢測,結果含量分別為87.8%和77.5%。
3 結論
本文以油橄欖葉中的2種主要有效成分-橄欖苦苷和木犀草素-7′-O-β-D-葡萄糖苷為目標化合物,通過考察溶劑系統和目標化合物極性對分離的影響,表明對于極性化合物而言,隨著溶劑系統極性的增加,極性化合物的K值呈現增加的趨勢。化合物極性越小,K值增加的趨勢越大。在篩選溶劑系統時,在滿足適宜的K值前提下,分離效率(目標化合物的保留時間)也是需要考慮的重要因素之一。本文通過結合K值和分離效率,優選出從油橄欖葉中分離制備其中主要的有效成分橄欖苦苷和木犀草素-7′-O-β-D-葡萄糖苷最佳溶劑系統[正己烷-乙酸乙酯-甲醇-水,1∶9∶3∶7,v/v)。在優化的HSCCC色譜條件下,分離制備所得橄欖苦苷和木犀草素-7′-O-β-D-葡萄糖苷含量分別為87.8%和77.5%。本研究結果為HSCCC溶劑系統快速篩選、提高HSCCC在復雜體系中分離制備目標化合物的效率提供技術支持。

