沸石改性聚丙烯酰胺復合材料 對誘惑紅色素的吸附研究
,,
(1.太原工業學院,化學與化工系,山西太原 030008; 2.國網山西省電力公司電力科學研究院,山西太原 030001)
誘惑紅色素是一種食用合成色素,可用于食品、醫藥、化妝品和食品包裝材料的著色[1]。長時間攝入違規、超量添加誘惑紅色素的食品,會對人體健康有一定的毒害作用[2],尤其是幼兒,其肝腎排毒功能較弱,生長發育較為敏感,長期攝入超量的合成色素,易造成精神不集中和多動癥[3]。因此,檢測食品中誘惑紅色素的含量顯得尤為重要。
雖然現代分析檢測手段已十分靈敏,但由于樣品中復雜的基體效應,直接測定食用合成色素往往很困難[4]。因此,在測定之前對實際樣品需要進行預富集。常用的預富集方法有溶劑萃取法[5]和吸附法[6-8],其中溶劑萃取法的缺點是操作過程耗時費力且要使用大量有毒的有機溶劑[9]。吸附法因其低成本、高效率、易操作及環保等優點[10-11],而被廣泛地使用。在吸附法中,吸附劑的選擇至關重要。目前,可以作為吸附劑的材料有很多種,如氧化鋁[12-13]、活性炭[14-15]、硅膠[16]、沸石[17-19]、有機聚合物[20]等。
聚丙烯酰胺是一種有機聚合物材料,由于其具有酰胺基單元,可以與合成色素中的磺酸基或是酚羥基形成氫鍵,從而對合成色素具有吸附作用[4]。然而,由于有機聚合物材料在一些溶劑中存在溶脹或是收縮現象,導致其機械穩定性和再生性能較差[21-22],限制了其在預富集方面的應用。近年來,無機材料改性的有機聚合物技術發展迅速,這些改性材料具有高的比表面積、特殊的化學性質、強的機械穩定性和良好的再生性能等特點[23]。
沸石是一類具有三維孔結構的無機材料,由于其具有均勻的孔徑、強酸性、選擇性和穩定性,沸石常被用于離子交換、分離、催化、吸附等[24-25]。本實驗以沸石改性聚丙烯酰胺復合材料作為吸附劑,與紫外-可見吸收光譜法聯用,研究其對誘惑紅色素的吸附性能。考察了實驗條件對吸附性能的影響,研究了沸石改性聚丙烯酰胺復合材料吸附誘惑紅色素的動力學、熱力學和吸附等溫線。
1 材料與方法
1.1 材料與儀器
丙烯酰胺、亞甲基雙丙烯酰胺 天津市福晨化學試劑廠;二甲亞砜、十二醇、偶氮二異丁腈 天津市光復精細化工研究所;人造沸石、誘惑紅色素 阿拉丁試劑有限公司;實驗中所使用的藥品 均為分析純;實驗用水 均為去離子水;丙烯酰胺和偶氮二異丁腈 均經重結晶處理,且在室溫下真空干燥后使用。
CP214電子天平 上海奧豪斯儀器有限公司;pHS-3C數字酸度計 上海雷磁儀器廠;SZCL-4B智能磁力加熱攪拌器 鞏義市予華儀器有限責任公司;SHZ-D(Ⅲ)循環水式真空泵 鞏義市予華儀器有限責任公司;PHG-90304電熱恒溫鼓風干燥箱 上海精宏實驗設備有限公司;KQ-50DB數控超聲波清洗器 昆山市超聲儀器有限公司;SHA-C恒溫振蕩器 常州國華電器有限公司;SPECTRUN-100傅里葉紅外光譜儀 美國PerkinElmer公司;JSM-6700F掃描電子顯微鏡 日本JEOL公司;TU-1901雙光束紫外-可見吸收光譜儀 北京普析通用儀器有限責任公司。Autosorb Station 1氮氣吸附-脫附儀 美國Quantachrome公司。
1.2 實驗方法
1.2.1 沸石改性聚丙烯酰胺復合材料的制備 參照文獻[13]方法:稱取沸石0.60 g放入燒杯中,加入60 mL 1% HCl,用磁力攪拌器攪拌3 h,過濾,并用去離子水洗至濾液呈中性,將得到的固體置于烘箱60 ℃干燥6 h,得到預處理過的沸石。預聚合反應液包括單體丙烯酰胺60.0 mg、交聯劑亞甲基雙丙烯酰胺140.0 mg、預處理過的沸石70.0 mg、引發劑偶氮二異丁腈1.0 mg和致孔劑(二甲亞砜620 μL和十二醇435 μL)。預聚合反應液經超聲10 min混合均勻,通入N25 min以排除體系內的O2和氣泡,再放入恒溫烘箱加熱60 ℃反應8 h。反應后得到的產物用100 mL甲醇超聲洗滌10 min,以除去產物中殘余的致孔劑和未反應完的單體,在60 ℃下干燥6 h后,得到沸石改性聚丙烯酰胺復合材料。若預聚合反應液不包括預處理過的沸石70.0 mg,而其他的反應條件和處理過程相同,制備得到的是聚丙烯酰胺。
1.2.2 掃描電鏡表征分析 使用JSM-6700F掃描電子顯微鏡(SEM),觀察聚丙烯酰胺和沸石改性聚丙烯酰胺復合材料的表面微結構。
1.2.3 氮氣吸附-脫附表征分析 采用Autosorb Station 1氮氣吸附-脫附儀,分別測定聚丙烯酰胺和沸石改性聚丙烯酰胺復合材料的孔徑和BET比表面積。材料在分析前需要在120 ℃,1.333×103Pa條件下干燥10 h。Brunauer-Emmett-Teller(BET)比表面積是根據相對壓力在0.066~0.30范圍內的吸附數據計算出的,而材料的孔徑是利用Barrett-Joyner-Halenda(BJH)模型根據吸附數據計算得到。
1.2.4 紅外光譜(FT-IR)表征分析 采用SPECTRUN-100傅里葉紅外光譜儀,分別測定沸石、聚丙烯酰胺和沸石改性聚丙烯酰胺復合材料的紅外光譜圖。樣品的制備采用KBr壓片法,掃描范圍為4000~400 cm-1。
1.2.5 樣品溶液的配制 將誘惑紅色素溶解于去離子水中,配成濃度為1000 mg/L的標準儲備液,避光,于4 ℃保存。實驗所需的樣品溶液由標準儲備液稀釋得到。所有溶液在紫外-可見吸收光譜儀檢測前,都經過0.45 μm微孔濾膜過濾。
1.2.6 吸附實驗 在20 ℃下,準確移取10 mL 2 mg/L誘惑紅色素溶液于具塞比色管中,加入20 mg復合材料,于恒溫振蕩器上振蕩80 min后,靜置,上層清液經過0.45 μm微孔濾膜過濾后,用紫外-可見吸收光譜儀測量其吸光度(誘惑紅色素的檢測波長為507 nm),并計算出溶液中誘惑紅色素的濃度,每組實驗重復三次。
吸附率(%)和吸附量(qe,mg/g)分別用公式(1)和(2)計算:

式(1)
式(2)
式中:Co和 Ce分別代表起始和平衡時誘惑紅色素的濃度,mg/L;V代表樣品溶液的體積,mL;m代表沸石改性聚丙烯酰胺復合材料的質量,mg。
1.2.7 pH對吸附率的影響 在20 ℃下,取8份20 mg復合材料,分別加到濃度為2 mg/L的10 mL誘惑紅色素溶液中,調pH至2、3、4、5、6、7、8、9,于恒溫振蕩器上振蕩80 min后,靜置,取上層清液,測定溶液中誘惑紅色素的濃度,每組實驗重復三次,由公式(1)計算吸附率。
1.2.8 吸附動力學實驗 將20 mg復合材料置于濃度為2 mg/L,pH=6.0的10 mL誘惑紅色素溶液中,在20 ℃下,分別于恒溫振蕩器上振蕩0、20、30、40、50、60、70、80、90、100、110、120 min后,靜置,取上層清液,測定溶液中誘惑紅色素的濃度,每組實驗重復三次,由公式(1)和(2)分別計算吸附率和吸附量。
為了研究吸附過程中的速控步驟和動力學規律,分別采用擬一級動力學模型和擬二級動力學模型對動力學數據擬合[10]。
擬一級動力學方程如公式(3)所示:
式(3)
式中:qe和qt分別代表平衡時刻和t時刻沸石改性聚丙烯酰胺復合材料對誘惑紅色素的吸附量,mg/g;k1表示擬一級動力學常數,min-1;qe和k1可以通過log(qe-qt)對t作圖所得直線的截距和斜率計算得到。
擬二級動力學方程如公式(4)所示:
式(4)
式中:k2表示擬二級動力學常數,g/mg/min;k2可以由t/qt對t作圖所得直線的截距計算得到。
1.2.9 吸附等溫線實驗 將20 mg復合材料置于初始濃度分別為1、2、10、40、70、100 mg/L的10 mL pH=6.0的誘惑紅色素溶液中,在20 ℃下,于恒溫振蕩器上振蕩80 min后,靜置,取上層清液,測定溶液中誘惑紅色素的濃度,每組實驗重復三次,由公式(2)計算吸附量。
吸附等溫線模型是在一定的溫度下,被用來描述吸附劑與被吸附物質之間的相互作用。為了進一步明確吸附機理,本實驗分別用Langmuir和Freundlich模型擬合吸附等溫數據。
Langmuir模型如公式(5)所示:
式(5)
式中:Ce和qe分別代表平衡濃度(mg/L)和吸附量(mg/g);qmax表示單分子層的最大吸附量,mg/g;b表示Langmuir常數,L/mg。
Freundlich模型如公式(6)所示:
式(6)
式中:K和n代表經驗常數,Ce和qe同公式(5)。
1.2.10 吸附熱力學實驗 將20 mg復合材料置于濃度為2 mg/L的10 mL pH=6.0的誘惑紅色素溶液中,分別在20、30、40、50、60、70 ℃下,于恒溫振蕩器上振蕩80 min后,靜置,取上層清液,測定溶液中誘惑紅色素的濃度,每組實驗重復三次,由公式(2)計算吸附量。
熱力學參數 吉布斯自由能變(ΔG)、焓變(ΔH)和熵變(ΔS)的值由如下公式求得:
式(7)
ΔG=-RTlnKd
式(8)
式(9)
式中:R代表理想氣體常數,為8.3145 J/mol/K,T代表絕對溫度,K;Kd代表熱力學平衡常數;ΔH和ΔS的值可通過lnKd對1/T作圖所得的直線的斜率和截距計算得到。
1.2.11 解吸再生實驗 將吸附有誘惑紅色素的吸附劑用去離子水洗滌,之后轉移到盛有10 mL解析液(V0.5%氨水∶V甲醇=50∶50)的具塞比色管中,于恒溫振蕩器中振蕩后,靜置,取上層清液,測定解析液中誘惑紅色素的濃度,每組實驗重復三次。
1.3 數據統計分析
采用軟件OriginPro 8.0進行數據模型擬合和圖表制作。實驗數據用分析軟件SPSS 20.0進行數據處理和方差分析,采用Tukey-HSD法檢驗,差異顯著性水平為p<0.05。
2 結果與分析
2.1 吸附材料的表征
圖1是聚丙烯酰胺和沸石改性聚丙烯酰胺復合材料的SEM圖。對比圖1a和圖1b,可以看出復合材料的微球尺寸和孔徑比未用沸石改性的聚丙烯酰胺材料的小。氮氣吸附-脫附實驗測得了聚丙烯酰胺和沸石改性聚丙烯酰胺復合材料的孔徑和BET比表面積,復合材料的孔徑為29.7 nm及其BET比表面積為92.1 m2/g。然而,聚丙烯酰胺的孔徑為312.6 nm及其BET比表面積為31.2 m2/g,說明沸石粒子的引入使復合材料的孔徑減小且其BET比表面積增大。綜合SEM和氮氣吸附-脫附分析結果,表明沸石粒子成功地被引入到丙烯酰胺聚合物微球表面[4,13,26]。
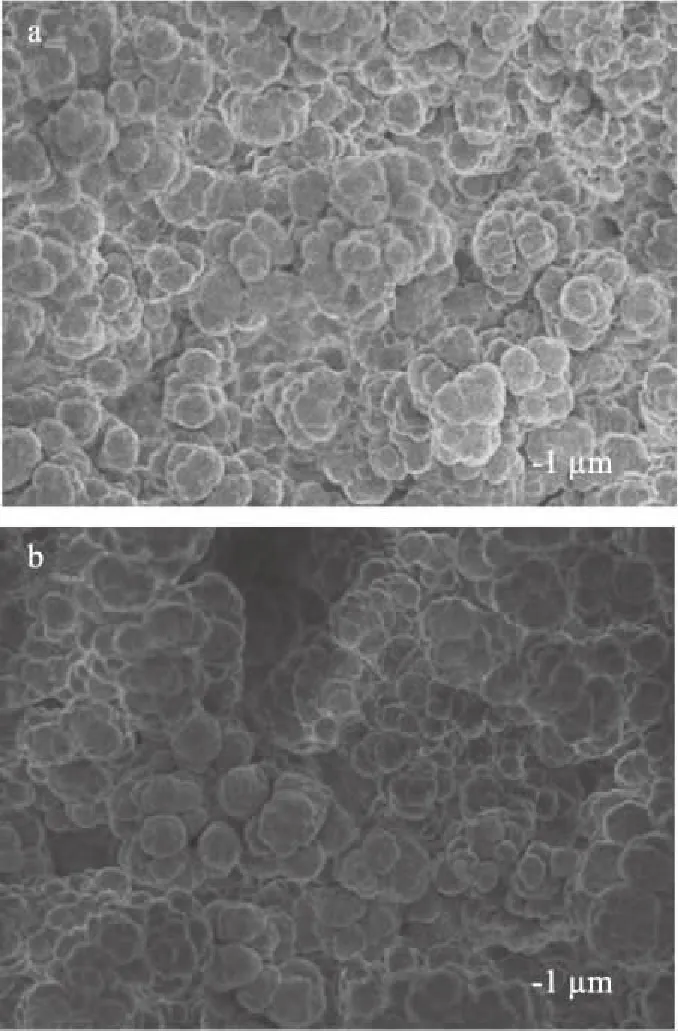
圖1 樣品的SEM圖Fig.1 SEM micrographs of sample注:a:聚丙烯酰胺;b:沸石改性聚丙烯酰胺復合材料。
為了研究復合材料中沸石與聚丙烯酰胺的結合方式,分別對沸石(圖2a)、聚丙烯酰胺(圖2b)和沸石改性聚丙烯酰胺復合材料(圖2c)進行了紅外光譜分析。在圖2a中,3345 cm-1處的吸收峰歸屬于沸石中的O-H的伸縮振動,967 cm-1處的吸收峰應歸屬于沸石中的T-O-T鍵的反對稱伸縮振動。在圖2b中,3304 cm-1處的吸收峰應歸屬于N-H的伸縮振動,而1653和1508 cm-1處的吸收峰分別歸屬于酰胺基中C=O的彎曲振動和N-H的彎曲振動。在圖2c中,3305 cm-1處的吸收峰應歸屬于N-H的伸縮振動,而1644和1515 cm-1處的吸收峰分別歸屬于酰胺基中C=O的彎曲振動和N-H的彎曲振動,970 cm-1處的吸收峰應歸屬于沸石中的T-O-T鍵的反對稱伸縮振動[13]。綜上所述,復合材料的紅外譜圖中沒有出現其他的特征吸收峰,可以推測出沸石與聚丙烯酰胺之間沒有生成新的化學鍵,是以物理吸附方式結合的。

圖2 樣品的紅外光譜圖Fig.2 FT-IR spectra of sample注:a:沸石;b:聚丙烯酰胺; C:沸石改性聚丙烯酰胺復合材料。
2.2 pH對吸附率的影響
pH是影響吸附過程的重要參數,常常影響目標物質與吸附劑之間的相互作用。圖3為pH對誘惑紅色素吸附的影響。從圖中可以看出,當溶液的pH從2增大到6時,吸附率明顯增大;而當pH從6到9時,吸附率略有下降。這種趨勢可能是與誘惑紅色素和吸附劑之間存在的靜電斥力和氫鍵相互作用力有關。該體系存在兩種氫鍵,一種是由誘惑紅色素中的磺酸基或酚羥基與吸附劑中沸石表面的羥基所形成的氫鍵,另一種是由誘惑紅色素中的磺酸基或酚羥基與吸附劑中聚丙烯酰胺的酰胺基所形成的氫鍵[4]。當溶液的pH過低時,由于誘惑紅色素中的磺酸基或酚羥基與吸附劑中的羥基均質子化而導致靜電斥力增加。當溶液的pH過高時,由于氫鍵作用減弱使得吸附率略有降低。為實現較高的吸附率,本實驗選擇溶液的pH為6。

圖3 pH對誘惑紅色素吸附的影響Fig.3 Effect of pH on the adsorption of Allura Red
2.3 吸附動力學分析
振蕩時間是影響吸附劑吸附效果的一個重要參數。圖4為振蕩時間對吸附率的影響。如圖所示,隨著振蕩時間的延長,吸附率先增加;當振蕩時間達到80 min時,誘惑紅色素基本達到吸附平衡;繼續延長振蕩時間,吸附率無明顯增加。這是由于在吸附初始時,沸石改性聚丙烯酰胺復合材料具有較大的孔隙和較多的酰胺基及羥基,隨著時間的延長,孔隙被誘惑紅色素占據,復合材料上的酰胺基及羥基均與誘惑紅色素形成的氫鍵達到飽和,因此吸附率不再發生明顯的增加[11]。為了保證充分的吸附,本實驗選擇振蕩時間為80 min。

圖4 振蕩時間對誘惑紅色素吸附的影響Fig.4 Effect of contact time on the adsorption of Allura Red
沸石改性聚丙烯酰胺復合材料吸附誘惑紅色素的兩種動力學擬合結果如圖5、圖6和表1所示。結果表明,擬二級動力學模型的線性系數較高,并且通過擬二級動力學方程計算得到的qe值與實驗得到的qe值更加吻合,進一步說明了沸石改性聚丙烯酰胺復合材料吸附誘惑紅色素的動力學數據可以用擬二級動力學模型擬合。

qe,實驗(mg/g)擬一級動力學模型擬二級動力學模型k1qe,計算(mg/g)R2k2qe,計算(mg/g)R20.960.113.850.84050.121.030.9984

圖6 擬二級動力學方程曲線Fig.6 Pseudo-second-order kinetics plot
2.4 吸附等溫線分析
在20 ℃下,誘惑紅色素的初始濃度對吸附量的影響如圖7所示。從圖中可以看出,吸附量隨著誘惑紅色素的初始濃度的增大而增加,最終基本達到吸附量值的上限。當誘惑紅色素濃度較低時,吸附劑的吸附位點未飽和,吸附量能較快增加;而當誘惑紅色素濃度較高時,吸附劑的吸附位點逐漸達到飽和,吸附量趨于限值。
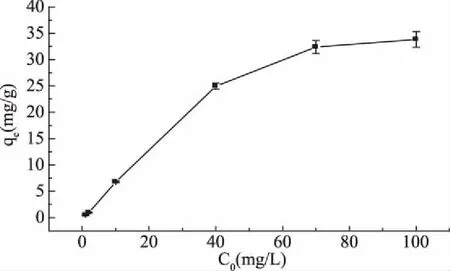
圖7 誘惑紅色素的初始濃度對吸附量的影響Fig.7 Effect of initial Allura Red concentration on adsorption capacity
為了進一步明確等溫吸附機理,分別用Langmuir模型和Freundlich模型擬合等溫吸附數據。圖8和圖9分別為復合材料吸附誘惑紅色素的Langmuir和Freundlich等溫吸附曲線。兩種模型的擬合結果如表2所示,從決定系數可以看出,Langmuir模型的決定系數R2更大,因此,此吸附過程更符合Langmuir模型。

表2 吸附等溫線模型擬合結果Table 2 Parameters of the Langmuir and Freundlich isotherms for Allura Red adsorption

圖8 Langmuir吸附等溫線Fig.8 The Langmuir isotherm for the adsorption
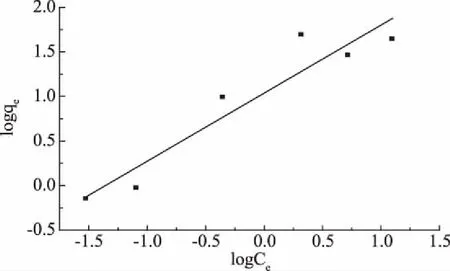
圖9 Freundlich吸附等溫線Fig.9 The Freundlich isotherm for the adsorption
2.5 吸附熱力學分析
復合材料吸附誘惑紅色素的熱力學曲線如圖10所示。當溫度為20 ℃時,ΔG=(4.23 kJ/mol,ΔH=39.01 kJ/mol,ΔS=145.22 J/mol/K。ΔG<0,說明此吸附過程可以自發進行;ΔH>0,說明此吸附過程是吸熱過程,溫度升高有利于吸附進行;ΔS>0,說明此吸附過程是熵增大過程。

圖10 吸附熱力學曲線Fig.10 The thermodynamic curve for the adsorption
2.6 吸附劑的再生性能分析
衡量吸附劑性能優良的一個重要參數是再生性能。沸石改性聚丙烯酰胺吸附劑的再生性能如表3所示。從表中可以看出,重復吸附-解吸實驗三次之后,吸附劑對誘惑紅色素的吸附量值無明顯變化,解吸率保持在88%以上,說明該吸附劑具有較好的再生性能。

表3 解吸次數對吸附量和解吸率的影響Table 3 Effect of desorption cycles on adsorption quantity and desorption rate
3 結論
本實驗合成了沸石改性聚丙烯酰胺復合材料,通過SEM、氮氣吸附-脫附、FT-IR進行了表征,并研究了該材料對誘惑紅色素的吸附性能。pH的考察實驗表明,當溶液pH為6.0時,吸附率達到最大。振蕩時間的考察實驗表明,誘惑紅色素在80 min之內可達到吸附平衡,動力學實驗研究表明,該吸附過程符合擬二級動力學模型。通過對等溫吸附模型的分析,可知該吸附過程符合Langmuir模型。通過對熱力學參數的研究,證明了合成的沸石改性聚丙烯酰胺復合材料對誘惑紅色素的吸附是吸熱過程,并且是自發進行的。對該復合材料進行了再生性能的考察,表明沸石改性聚丙烯酰胺復合材料在進行3次解析再生后吸附能力無明顯變化,具有較好的再生性能。綜上所述,沸石改性聚丙烯酰胺復合材料在吸附合成色素方面有很大的應用前景。

