高溫高濃發酵工業啤酒酵母菌種的構建
孫中貫,周波,王孟祺,王亞平,邢爽,郭學武,肖冬光
1 天津科技大學 生物工程學院,天津 300457
2 天津科技大學 工業發酵微生物教育部重點實驗室,天津 300457
啤酒高濃高溫發酵是指采用較高濃度 (14 °P以上) 的麥芽汁在較高的溫度條件下進行發酵,在啤酒成熟后過濾前,用經處理的含飽和CO2的脫氧水將啤酒稀釋成常規濃度 (10–12 °P) 的技術[1-2]。高濃高溫發酵技術在不增加糖化、發酵等生產設備的基礎上,能夠大幅提高企業的生產效率,減少能源消耗,降低生產成本,獲得更高的經濟效益。但是,高溫高濃發酵技術也會給啤酒發酵帶來一系列的問題,如啤酒風味不協調、泡沫穩定性差、發酵結束后酵母絮凝性下降等[3-4]。
酵母菌絮凝是指酵母細胞之間相互聚集形成絮狀或顆粒狀細胞團,并迅速沉降到發酵液底部的一種生理特性,絮凝的發生是一種無性的、鈣依賴的、可逆的過程[5]。絮凝的發生依賴于絮凝蛋白與鄰近細胞表面寡聚甘露糖鏈間的結合[6],而工業酵母菌株絮凝特性的差異主要是由絮凝蛋白的濃度所決定的[7]。高濃度麥芽汁發酵結束后,發酵液中過量存在的甘露糖等糖類物質可抑制酵母菌株的絮凝性[8]。發酵溫度較低時,對酵母菌株絮凝性的影響較小,酵母細胞均具有較好的絮凝性[9-10]。有關學者認為較低的發酵溫度下,酵母的新陳代謝速度減緩,進而緩解了CO2對酵母菌株的擾動作用,故溫度較低時酵母細胞趨于絮凝[11];本課題組前期研究結果表明,麥芽汁濃度對工業啤酒酵母S6的絮凝性影響較顯著,而高溫發酵對S6菌株的絮凝性影響較小[12]。
Dietvorst 等研究發現在高濃度麥芽糖或葡萄糖的發酵條件下,與甲基轉移酶相關的復合蛋白 (COMPASS) 能夠使FLO1、FLO5以及FLO9基因表達沉默,從而導致酵母菌株的絮凝能力下降[13]。酵母菌細胞壁上的絮凝蛋白表現出豐富的遺傳多樣性,其中FLO5基因編碼的絮凝蛋白與糖鏈的結合能力最強[14]。
啤酒中的高級醇是酵母在發酵過程中的主要副產物之一,是構成啤酒風味的重要物質,適宜的高級醇含量能夠增加啤酒的醇厚感,但含量過高反而會造成酒體風味物質失衡,飲用后產生頭痛、口渴等癥狀[15-16]。研究表明較高的發酵溫度和麥芽汁濃度均有助于高級醇的生成[16-17]。酵母細胞內高級醇的合成分為氨基酸分解代謝途徑(Ehrlich pathway) 和糖酵解合成代謝途徑(Harris pathway)[18],如圖1所示。釀酒酵母菌株的BAT基因編碼的支鏈氨基酸轉氨酶催化支鏈氨基酸轉氨生成高級醇的前體物α-酮酸,因而BAT基因的缺失將有助于抑制高級醇的合成[19-20]。
目前有關利用代謝工程提高高濃高溫發酵條件下工業啤酒酵母絮凝性同時降低高級醇合成能力的研究還未有報道。本研究將在敲除BAT基因的基礎上,實現FLO5基因的過量表達,以構建高溫高濃發酵條件下高絮凝性、低高級醇合成能力的工業啤酒酵母優質菌株。
1 材料與方法
1.1 材料
1.1.1 菌種與質粒
本研究所有菌株和質粒均為作者所在實驗室保存,詳見表1。重組菌株的構建均采用單片段基因重組法[21]。
1.1.2 引物
實驗中所用的引物列于表2。
1.1.3 培養基與試劑
LB 培養基(g/L):胰蛋白胨10,氯化鈉10,酵母浸粉5,pH 7.0,115 ℃滅菌20 min。需要時使用前加入氨芐青霉素至100 μg/mL,固體培養基添加20 g瓊脂,用于大腸桿菌培養。
YEPD培養基(g/L):葡萄糖20,蛋白胨20,酵母浸粉10,自然pH,115 ℃滅菌20 min。制備平板時添加20 g瓊脂,用于酵母培養。篩選轉化子時需添加G418 至500 μg/mL。
YPG 半乳糖誘導培養基(g/L):半乳糖20,蛋白胨20,酵母浸粉10,自然pH,115 ℃滅菌20 min。
麥芽汁培養基:采用二段式浸出糖化法。粉碎后的大麥芽,按1∶4的料水比于62 ℃糖化30 min,隨后升溫至70 ℃糖化至碘檢完畢,過濾煮沸后冷卻至室溫,離心去沉淀后,用自來水調整外觀糖度至18 °P,115 ℃滅菌20 min。
引物委托北京鼎國昌盛生物技術有限責任公司合成。高保真性DNA擴增酶采用TransTaqHiFi,購自北京全式金生物技術有限公司。限制性內切酶、DNA 連接酶、去磷酸化酶購自大連寶生物工程有限公司。質粒提取試劑盒和酵母菌總DNA提取試劑盒購自大連寶生物公司。硫酸鹽遺傳霉素 (G418)、氨芐青霉素、卡那霉素、博來霉素 (Zeocin) 購自北京鼎國昌盛生物技術有限責任公司。鮭魚精DNA購自北京索萊寶科技有限公司。

圖1 釀酒酵母高級醇合成代謝網絡圖Fig.1 Biosynthetic pathways for higher alcohols formation in Saccharomyces cerevisiae.Black solid lines represent that the higher alcohols are derived from the Ehrlich pathway.Gray solid lines represent that the higher alcohols are derived from the Harris pathway.Black dotted lines represent the synthesis of corresponding carboxylic acids.

表1 本研究所用菌株及質粒Table 1 Strains and plasmids in this study
1.2 啤酒發酵實驗
1.2.1 菌種活化
將甘油管中保存菌種轉接至YEPD斜面試管30 ℃活化培養2 d。
1.2.2 一級種子培養
取活化后的斜面菌種一環,接種于裝有5 mL 12 °P麥芽汁培養基的試管中,在28 ℃、180 r/min條件下培養24 h。
1.2.3 二級種子培養
一級種子液按10% (V/V) 的接種量接入裝有50 mL 12 °P麥芽汁培養基的150 mL三角瓶內,16 ℃靜置培養72 h。
1.2.4 啤酒發酵
二級種子液經離心無菌水洗滌2次后得到的酵母泥,按0.5% (W/V) 的接種量接入盛有150 mL 18 °P麥芽汁培養基的250 mL三角瓶內,16 ℃下靜置發酵。
1.3 方法
1.3.1 目的片段的擴增與質粒構建
以釀酒酵母S6菌株的基因組DNA為模板,利用引物對FLO5-U/FLO5-D、BA-U/BA-D、BB-U/BB-D、BA2-U/BA2-D、BB2-U/BB2-D、A1-U/A1-D、B1-U/B1-D擴增FLO5基因、BAT2基因的2條上游同源序列BA和BA2、2條下游同源序列BB和BB2以及BAT1基因的上下游同源序列A1和B1。以質粒pUG6為模板,K-U和K-D為引物對擴增KanMX片段。
將目的基因FLO5經XhoⅠ酶切處理并去磷酸化后,用In-fusion酶連接至相應切口的質粒Yep-PGK中,轉化驗證后依次將經BamHⅠ酶切并磷酸化后的KanMX片段,經SmaⅠ酶切并磷酸化后的BA片段,經SphⅠ酶切并磷酸化后的BB片段,連接到表達載體Yep-PGK相應的位點上并進行轉化驗證,得到質粒Yp-AFKB。

表2 用于基因擴增的引物Table 2 Primers used for PCR
將經SmaⅠ酶切并磷酸化后的BA2片段,經SphⅠ酶切并磷酸化后的BB2片段,依次連接到含有KanMX片段的表達載體Yep-PGK相應的位點上,轉化驗證后得到質粒Yp-A2FKB2。
將BAT1基因的上游同源序列A1片段用EcoRⅠ和BamHⅠ進行雙酶切,連接到相應切口的質粒pUC19中,轉化驗證后再將質粒用BamHⅠ和PstⅠ進行雙酶切,與經同樣酶切后的BAT1基因的下游同源序列B1片段連接,轉化驗證后將KanMX基因片段用BamHⅠ進行單酶切,連接到重組質粒pUC19相應的位點上,轉化驗證后得到質粒pUC-A1KB1。
以質粒YP-AFKB為模板,BA-U和BB-D為引物對,PCR擴增目的片段,經純化回收、測序后,得到敲除BAT2基因一個等位基因同時過表達FLO5基因的重組片段BA+KanMX+PGKp+FLO5+PGKt+BB;以質粒YP-A2FKB2為模板,BA2-U和BB2-D為引物對,PCR擴增目的片段,經純化回收、測序后,得到敲除BAT2基因的另一個等位基因同時過表達FLO5基因的重組片段BA2+KanMX+PGKp+FLO5+PGKt+BB2;以質粒pUC-A1KB1為模板,A1-U和B1-D為引物對,PCR擴增目的片段,經純化回收、測序后,得到敲除BAT1基因一個等位基因的重組片段A1+KanMX+B1。
1.3.2 酵母的轉化和重組子的篩選
酵母的轉化采用LiAc/SS carrier DNA/PEG法[22]。利用G418篩選轉化子,提取轉化子基因組進行PCR定點驗證。
1.3.3 KanMX抗性基因的去除
采用Cre/loxP報告基因挽救系統[23],剔除陽性轉化子中的篩選標記基因KanMX。利用影印平板法篩選轉化子,以K-U/K-D為引物對進行PCR驗證。
1.3.4 Real-Time qPCR測定基因轉錄水平
酵母RNA的提取及RNA的反轉錄均按照產品說明書進行操作,使用SYBR?Premix ExTaqTMII(TaKaRa) 試劑盒進行實時熒光定量PCR,通過2-ΔΔCt值法對目的基因及內參基因ACT1進行基因表達量的分析。
1.3.5 CO2排放量的測定
發酵前預先稱量發酵體系總重,發酵過程中每隔12 h稱重一次,稱重前應先搖晃三角瓶,以去除發酵液中的CO2,當失重小于0.1 g時,表示發酵已經結束。
1.3.6 酵母菌絮凝能力的測定
采用光密度改良法對酵母菌絮凝能力進行測定[24]。
1.3.7 啤酒中高級醇含量的測定
啤酒發酵液經蒸餾后得到的樣品使用氣相色譜法 (Agilent,USA) 測定。色譜條件為:色譜柱LAP-930,50 m×0.32 mm×1.0 μm;檢測器為氫火焰離子化檢測器。初始柱溫為50 ℃,保持8 min,以5 ℃/min的升溫速度升至200 ℃,保持5 min,進樣量為1.0 μL,分流比為10∶1。
1.3.8 其他發酵參數的測定
利用手持糖度計測定原麥汁的表觀糖度;利用斐林試劑法測定發酵液中還原糖的含量;酒精度、發酵度及雙乙酰的測定依據啤酒分析方法進行測定。
2 結果與分析
2.1 重組菌株S6-BF的構建與性能分析
為了提高高溫高濃發酵條件下工業啤酒酵母S6 的絮凝能力,同時降低高級醇的生成量;選擇BAT2基因為重組片段的整合位點,將重組片段BA+KanMX+PGKp+FLO5+PGKt+BB整合到出發菌株S6的基因組中。對在G418濃度為500 mg/L的YEPD平板上生長的轉化子進行PCR驗證。轉化子的PCR驗證結果表明,重組片段成功整合到酵母S6基因組中相應的位點,將得到的陽性轉化子命名為S6-BF (圖2)。
以出發菌株S6為對照菌株,分析重組菌株S6-BF、BAT2基因單敲除重組菌株S6-SB2及FLO5基因單過表達重組菌株S6-SF5的BAT2基因與FLO5基因轉錄水平、絮凝能力、高級醇合成能力以及發酵性能。基因轉錄水平分析結果表明,FLO5基因在重組菌株S6-BF中的轉錄水平較出發菌株得到了非常顯著的提高,約為出發菌株的12倍;與重組菌株S6-SF5相比,FLO5基因在重組菌株S6-BF中的轉錄水平無顯著變化,表明BAT2基因的單敲除對FLO5基因的轉錄水平沒有明顯的影響 (圖3A);同時,絮凝能力分析結果顯示,重組菌株S6-SF5與S6-BF的絮凝能力均得到非常顯著的提升,是出發菌株S6絮凝能力的1.3倍 (圖3B)。與出發菌株相比,重組菌株S6-BF的BAT2基因轉錄水平顯著降低,約為出發菌株的0.6倍,且FLO5基因的過量表達沒有對BAT2基因的轉錄水平產生影響 (圖3A);在高級醇類物質中,僅有異戊醇的合成量得到非常顯著的降低,但降低量僅有7.3%,其他高級醇的合成水平均沒有顯著的變化,同時重組菌株S6-BF絮凝能力的提高對高級醇的合成沒有產生影響 (圖3C)。由表3可知,BAT2基因的單敲除、FLO5基因的單過表達以及BAT2基因與FLO5基因的組合敲除過表達對菌株S6的發酵能力都沒有產生顯著的影響,因而可以通過再次降低BAT2基因表達量同時過量表達FLO5基因的方式,以期提高出發菌株S6的絮凝能力同時降低高級醇的合成水平。
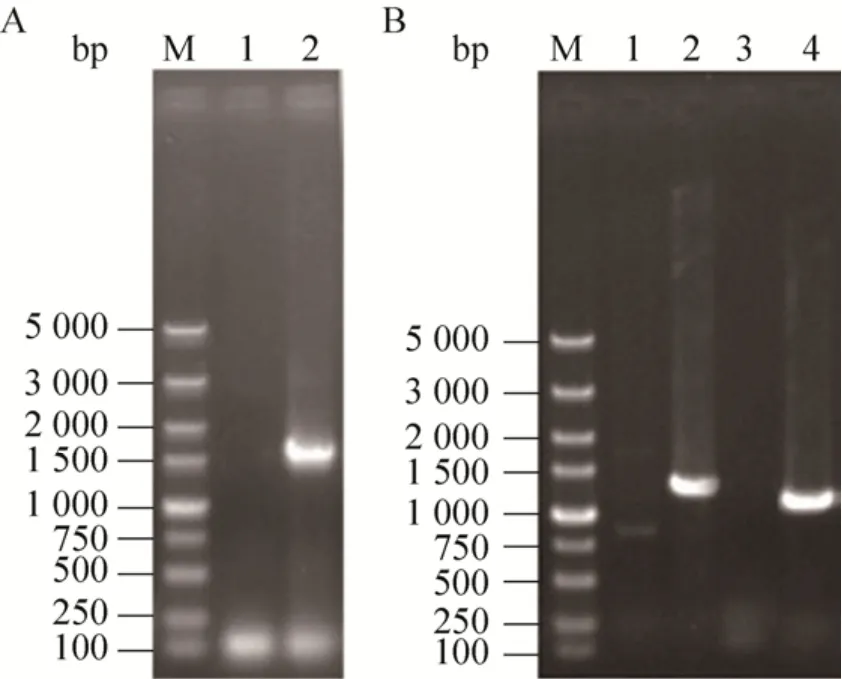
圖2 重組菌株S6-BF的PCR驗證Fig.2 The PCR verification of the mutant strain S6-BF.M: DL5000 DNA marker.(A) Primers: K-U and K-D.1:S6; 2: S6-BF.(B) 1–2: primers: B-U and K-D1; 1: S6; 2:S6-BF.3–4: primers: P-U and B-D; 3: S6; 4: S6-BF.
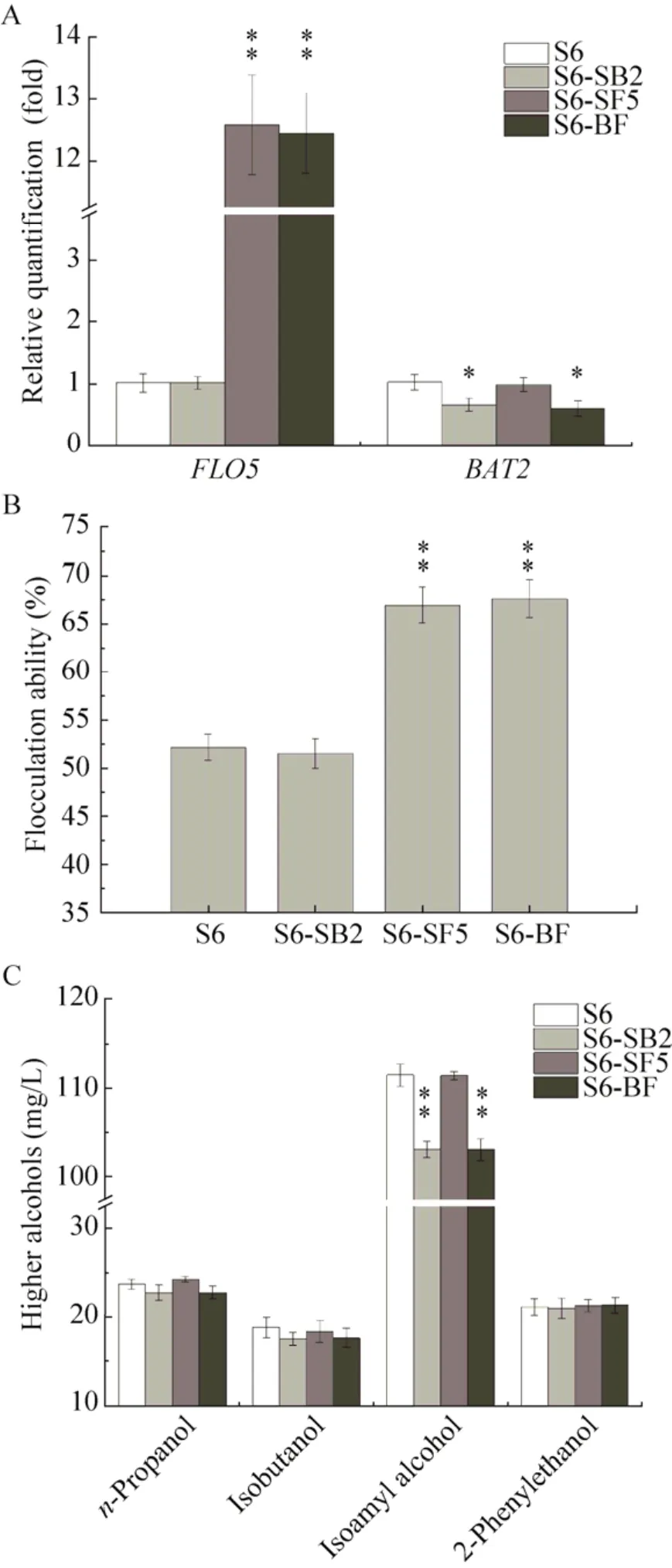
圖3 重組菌株S6-SB2、S6-SF5及S6-BF基因轉錄水平及性能分析Fig.3 Transcriptional levels and characteristics of S6-SB2, S6-SF5, S6-BF and parent S6.(A)Transcriptional levels of FLO5, BAT2 genes in mutants and the parental strain.(B) Flocculation ability of mutants and the parental strain.The flocculation ability was analyzed using the standard method.(C) The final levels of higher alcohols in mutants and the parental strain.Data are presented as the means of the results of three independent experiments.Error bars indicate standard deviations.Note: ** P<0.01, * P<0.05.
2.2 重組菌株S6-BF2的構建與性能分析
以重組菌株S6-BF為出發菌株,構建FLO5基因過量表達的重組菌株,需要再次利用KanMX抗性基因作為篩選標記,因而必須剔除存在于重組菌株S6-BF基因組上的KanMX抗性基因。利用Cre/loxP報告基因挽救系統可以實現KanMX抗性標記的剔除和反復利用。
重組菌株S6-BF基因組中KanMX抗性基因剔除的PCR驗證結果如圖4A所示,將得到的陽性轉化子命名為S6-BFK。選擇重組菌株S6-BFK的BAT2基因為整合位點,采用縮進式基因整合的方式,即同源序列BA2位于同源序列BA的下游區域,同源序列BB2位于同源序列BB的上游區域,且同源序列彼此之間均無重復區域,將重組片段BA2+KanMX+PGKp+FLO5+PGKt+BB2整合到重組菌株S6-BFK的基因組中。對在G418濃度為500 mg/L的YEPD平板上生長的轉化子進行PCR驗證。轉化子的PCR驗證結果表明,重組片段成功整合到酵母S6基因組中相應的位點,將得到的陽性轉化子命名為S6-BF2 (圖4B)。
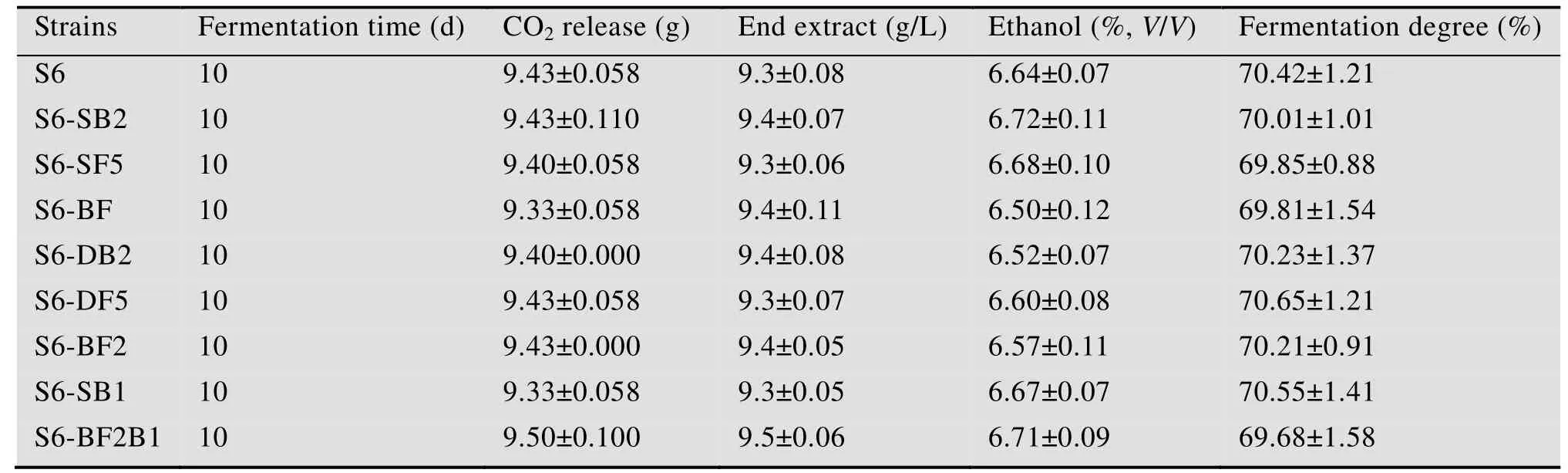
表3 原始菌株S6與重組菌株發酵能力分析Table 3 The fermentation performances of mutants and parent S6
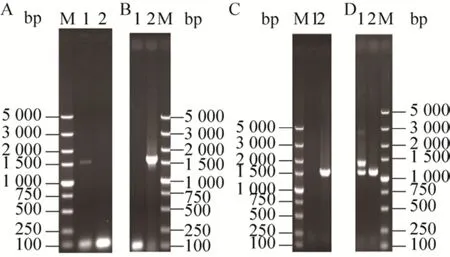
圖4 重組菌株S6-BF2的PCR驗證Fig.4 The PCR verification of the mutant strain S6-BF2.M: DL5000 DNA marker.(A) Primers: K-U and K-D.1: S6-BF; 2: S6-BFK.(B) Primers: K-U and K-D.1:S6-BFK; 2: S6-BF2.(C) Primers: B-U and K-D1.1:S6-BFK; 2: S6-BF2.(D) Primers: P-U and B-D.1:S6-BFK; 2: S6-BF2.
以原始菌株S6 為對照菌株,測定BAT2基因雙敲重組菌株S6-DB2、FLO5基因兩次過表達重組菌株S6-DF5以及重組菌株S6-BF2的BAT2基因與FLO5基因轉錄水平、絮凝能力、高級醇合成能力及發酵性能。FLO5基因在重組菌株S6-BF2中的轉錄水平得到了進一步的提高,較原始菌株S6提高了17.8倍,與重組菌株S6-DF5中FLO5基因轉錄水平無顯著差異 (圖5A);同時,重組菌株S6-BF2的絮凝能力與重組菌株S6-DF5的絮凝能力沒有明顯的差異,均較原始菌株S6提高了62.8%,絮凝能力達到了85.44% (圖5B)。同時實驗結果也表明BAT2基因功能的缺失沒有對重組菌株的絮凝性產生顯著的影響。在重組菌株S6-DB2和S6-BF2中沒有檢測到BAT2基因的轉錄 (圖5A),表明重組菌株S6-DB2和S6-BF2基因組上的BAT2基因已被全部破壞無法正常表達。重組菌株S6-BF2合成高級醇的能力也有顯著降低,其中異戊醇的合成量下降最為明顯;與原始菌株S6相比,重組菌株S6-BF2合成高級醇的能力降低了9.15%,與重組菌株S6-DB2的高級醇合成能力保持一致,實驗結果表明重組菌株絮凝能力的提高沒有對高級醇的合成能力產生影響(圖5C)。由表3可知,重組菌株S6-BF2的發酵能力與原始菌株S6相比沒有顯著變化,表明FLO5基因的過量表達及BAT2基因功能的缺失沒有對工業釀酒酵母S6的發酵能力產生影響,同時也表明在BAT2基因和FLO5基因的改造過程中不存在相互協同或相互干擾的現象,且基因BAT2是釀酒酵母S6的非必需基因。
雖然重組菌株高級醇的合成能力下降較為顯著,但將高濃啤酒稀釋50%至常規濃度 (12 °P)后高級醇的含量仍然高于優質拉格啤酒所要求的高級醇含量的最適濃度[15]。釀酒酵母基因組中存在著BAT2基因的同源基因BAT1,而BAT1基因所編碼的蛋白同樣具有支鏈氨基酸轉氨酶的作用。以重組菌株S6-BF2為出發菌株敲除BAT1基因,考察BAT1基因的缺失對重組菌株高級醇合成能力的影響。
2.3 重組菌株S6-BF2B1的構建與性能分析
以重組菌株S6-BF2為出發菌株實現對BAT1基因的敲除仍然需要以KanMX抗性基因為篩選標記,因此在構建菌株之前需要剔除重組菌株S6-BF2基因組中的KanMX抗性基因。試驗方法及驗證同重組菌株S6-BFK 的構建過程,將剔除KanMX抗性基因的重組菌株命名為S6-BF2K。PCR驗證結果如圖6A所示。將重組片段A1+KanMX+B1轉化至重組菌株S6-BF2K基因組中并進行PCR驗證,同時測定BAT1基因的轉錄水平、陽性轉化子及BAT1基因單敲除重組菌株S6-SB1的發酵性能、絮凝能力及高級醇合成水平。轉化子的PCR驗證結果表明,重組片段A1+KanMX+B1已整合到重組菌株S6-BF2K基因組中相應的位點,將得到的陽性轉化子命名為S6-BF2B1 (圖6B)。
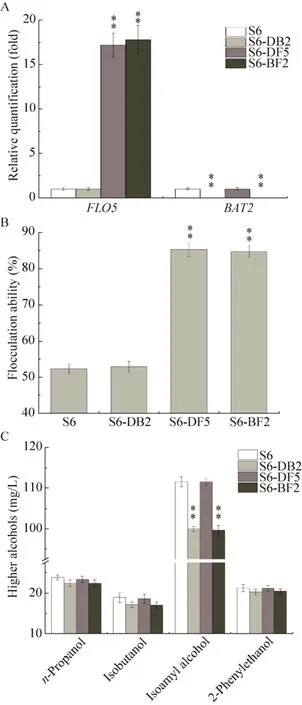
圖5 重組菌株S6-DB2、S6-DF5及S6-BF2基因轉錄水平及性能分析Fig.5 Transcriptional levels and characteristics of S6-DB2, S6-DF5, S6-BF2 and parent S6.(A)Transcriptional levels of FLO5, BAT2 genes in mutants and the parental strain.(B) Flocculation ability of mutants and the parental strain.The flocculation ability was analyzed using the standard method.(C) The final levels of higher alcohols in mutants and the parental strain.Data are presented as the means of the results of three independent experiments.Error bars indicate standard deviations.Note: ** P<0.01; * P<0.05.
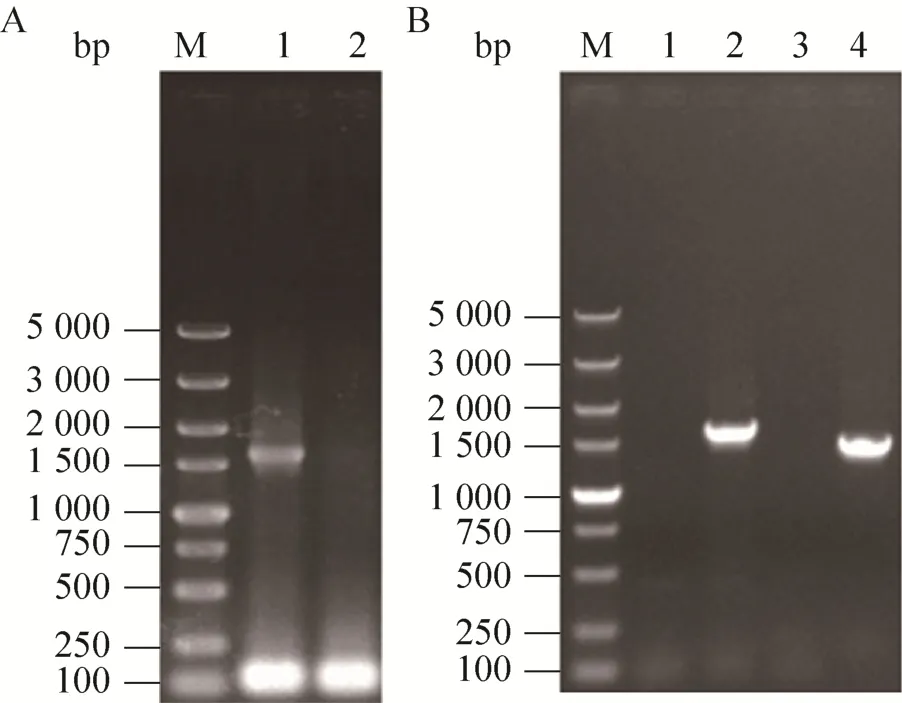
圖6 重組菌株S6-BF2B1的PCR驗證Fig.6 The PCR verification of the mutant strain S6-BF2B1.M: DL5000 DNA marker.(A) Primers: K-U and K-D.1: S6-BF2; 2: S6-BF2K.(B) 1–2: primers:A1-S and A1-X.1: S6-BF2K; 2: S6-BF2B1.3–4: primers:B1-S and B1-X.3: S6-BF2K; 4: S6-BF2B1.
基因轉錄水平分析結果表明,與原始菌株S6相比,重組菌株S6-BF2B1的BAT1基因轉錄水平下降顯著,是原始菌株BAT1基因轉錄水平的56.33%;重組菌株S6-BF2B1中FLO5、BAT2基因的轉錄水平與重組菌株S6-BF2相比沒有發生明顯的變化,且重組菌株S6-SB1中FLO5、BAT2基因的轉錄水平與原始菌株S6保持一致,證明BAT1基因的單次敲除沒有對FLO5、BAT2基因的轉錄水平造成任何影響 (圖7A)。酵母絮凝性分析試驗結果顯示,重組菌株S6-BF2B1 的絮凝性是原始菌株絮凝性的1.62倍,這一水平與重組菌株S6-BF2 的絮凝能力相當,同時BAT1基因的單敲除沒有對菌株S6的絮凝能力產生影響,表明BAT1基因的單敲除沒有影響菌株的絮凝能力(圖7B)。重組菌株S6-SB1、S6-BF2B1 的高級醇合成水平與原始菌株相比均有顯著降低,重組菌株S6-BF2B1 高級醇的合成量降低了19.05%,由原始菌株S6的175.58 mg/L下降至142.13 mg/L(圖7C)。將重組菌株S6-BF2B1高溫高濃發酵液稀釋50%至常規濃度 (12 °P) 時,高級醇含量與原始菌株S6在10 ℃發酵條件下的高級醇生成量基本相當[12]。試驗結果表明,BAT1基因功能的部分缺失有助于降低工業釀酒酵母S6的高級醇合成能力,且對出發菌株的發酵性能沒有產生顯著的影響 (表3);獲得的重組菌株S6-BF2B1能夠在高溫高濃的釀造條件下有效提高釀酒酵母的絮凝性同時顯著降低高級醇的生成量。
2.4 重組菌株S6-BF2B1風味物質的測定
在高溫高濃的發酵條件下進行啤酒發酵實驗,待主發酵結束后,對重組菌株S6-BF2B1及原始菌株S6代謝產生的主要風味物質進行了測定,結果如表4所示。
由表4可以看出,與原始菌株S6 相比,重組菌株S6-BF2B1 的高級醇合成能力及酯類物質的合成水平均有顯著的降低,醇酯比例由原始菌株S6的3.42上升至4.08,達到拉格啤酒要求的較為適宜的醇酯比例 (1∶4–1∶5);雙乙酰的含量沒有發生較為顯著的變化。高級醇中異戊醇的含量降低最為明顯,從而導致乙酸異戊酯的含量顯著降低;此外,重組菌株S6-BF2B1合成乙酸乙酯的能力也明顯下降,這是否與BAT基因功能的減弱有關,還有待于進一步的研究。由于本研究中的啤酒發酵是實驗室錐形瓶小試發酵,只是完成了啤酒主發酵階段的實驗沒有進行后發酵和低溫貯藏,因而啤酒中雙乙酰的含量未能達到成熟啤酒的要求 (雙乙酰閾值范圍為0.10–0.15 mg/L)。
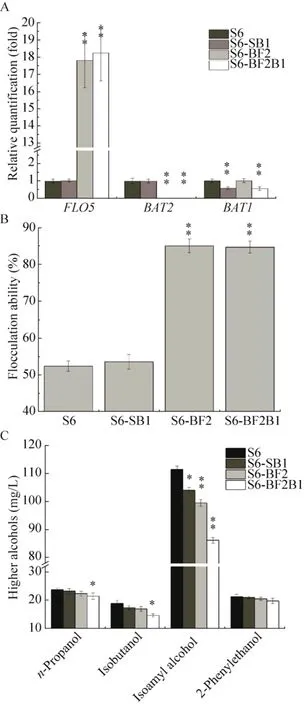
圖7 重組菌株S6-SB1、S6-BF2及S6-BF2B1基因轉錄水平及性能分析Fig.7 Transcriptional levels and characteristics of S6-SB1, S6-BF2, S6-BF2B1 and parent S6.(A)Transcriptional levels of FLO5, BAT2, BAT1 genes in mutants and the parental strain.(B) Flocculation ability of mutants and the parental strain.The flocculation ability was analyzed using the standard method.(C) The final levels of higher alcohols in mutants and the parental strain.Data are presented as the means of the results of three independent experiments.Error bars indicate standard deviations.Note: ** P<0.01; * P<0.05.
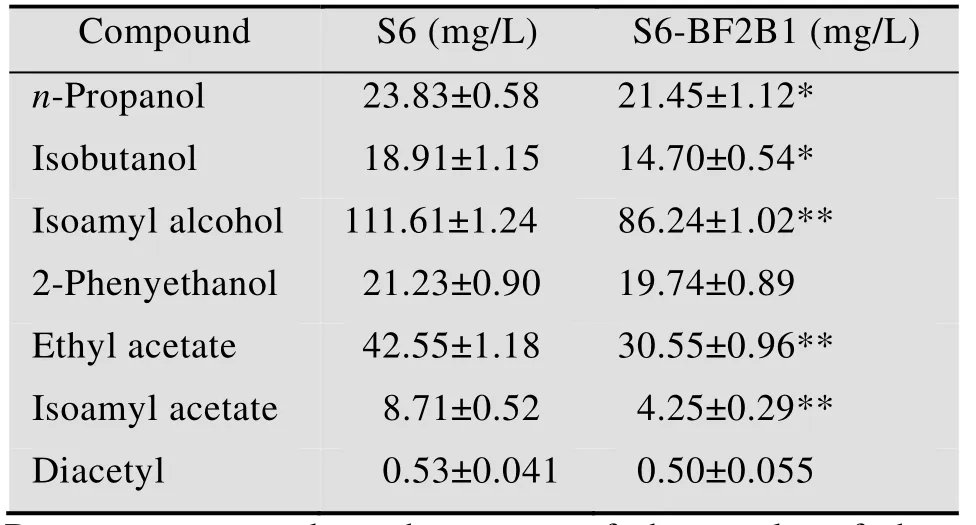
表4 重組菌株S6-BF2B1風味物質的測定Table 4 The flavor component profiles of mutant S6-BF2B1 and parent S6
3 討論
近年來在啤酒行業中興起的高溫高濃發酵技術為啤酒生產企業降低了生產成本,提高了經濟效益,但同時也為生產企業帶來了一系列新的問題。高溫高濃發酵導致的高滲透壓、高乙醇含量等問題對酵母的生長繁殖和發酵造成的影響是不可避免的,進而會對啤酒的口感、風味及酵母的絮凝性等方面帶來一些不良的影響。發酵結束時啤酒酵母能夠迅速地絮凝沉降,不但可以減少分離酵母所產生的能源消耗,也可以避免酵母長時間懸浮于發酵液中發生自溶現象,而超過5%的酵母發生自溶,將對啤酒質量造成難以挽回的影響[25]。針對高溫高濃發酵技術的研究,國內學者多從啤酒的風味物質出發,而酵母絮凝性方面的研究相對缺乏[4,16];國外學者的研究多集中在絮凝基因的調控機制方面,有關絮凝基因應用方面的研究較少[13,26]。因此探索絮凝基因和高級醇代謝基因的協同改造是一條同時解決高溫高濃發酵條件下釀酒酵母絮凝性問題和高級醇合成問題的有效途徑。
本研究以工業啤酒酵母S6為研究對象,運用基因同源重組的方式過量表達酵母絮凝性關鍵基因FLO5的同時,敲除參與高級醇合成代謝的BAT基因,最終獲得絮凝能力較強、高級醇合成水平適宜的工業啤酒酵母重組菌株S6-BF2B1。研究結果表明,重組菌株S6-BF2B1在高溫高濃的發酵條件下,不僅極大地增強了發酵結束后酵母菌株的絮凝能力,而且啤酒風味物質中高級醇的含量也得到了顯著的降低,達到了適宜的醇酯比例。實驗結果對發酵結束后酵母菌株的沉降分離以及改善啤酒中的醇酯比例具有積極的意義,同時也表明BAT基因和FLO5基因在改造過程中不存在相互協同或相互干擾的現象。酵母細胞質中編碼支鏈氨基酸轉氨酶的BAT2基因以及線粒體中編碼支鏈氨基酸轉氨酶的BAT1基因能夠將支鏈氨基酸轉化為高級醇合成的重要前提物質α-酮酸,因而具有促進高級醇合成的作用;文中對BAT基因的敲除也達到了降低工業啤酒酵母S6高級醇合成水平的效果。
通過對FLO5基因、BAT2基因以及BAT1基因的遺傳改造增強了酵母細胞在高溫高濃發酵條件下的絮凝性同時降低了高級醇的合成水平,這為研究釀酒酵母的絮凝性和高級醇的代謝提供了一定的理論依據,同時對指導啤酒的高溫高濃發酵技術具有重要的實踐價值。

