抗腫瘤治療與心房顫動
劉彤 夏云龍
隨著人們對腫瘤與心血管疾病關系認識的深入,腫瘤心臟病學這一新興學科應運而生。心房顫動(房顫)是一種臨床上最常見的持續性心律失常,是腦卒中、心力衰竭(心衰)、心肌梗死和死亡的重要危險因素。除了導致房顫的傳統危險因素(高血壓、心衰、心肌缺血、慢性肺部疾病、糖尿病、甲狀腺功能不全、慢性腎臟疾病)外,房顫的發生與腫瘤也密切相關。首先,腫瘤和房顫有很多共同的危險因素;此外,腫瘤的進展和抗腫瘤治療都會增加房顫風險,在腫瘤治療過程中發生房顫會影響腫瘤患者的預后、治療效果[1-2]。腫瘤導致房顫的病理生理學機制十分復雜,本文主要闡述腫瘤導致房顫的潛在機制(圖1),并為腫瘤治療過程中的房顫預防提供新思路。

圖1 腫瘤導致房顫機制示意圖
1 腫瘤外科術后房顫
腫瘤外科術后發生房顫會延長術后的重癥監護和住院時間,增加患者再住院率、死亡率和遠期卒中風險。心胸外科手術的術后房顫發生率是16%~46%,而非心胸手術的術后房顫發生率為0.4%~12.0%。肺癌患者的肺葉切除術術后房顫發生風險顯著增加,許多研究顯示肺癌患者術后房顫發生率為5.6%~23.0%[3]。而術后房顫會增加肺癌患者肺葉切除術后的遠期死亡率。此外肺癌患者的術后房顫與肺葉切除時的系統性淋巴結清掃有關。此外,結直腸癌患者行擇期結腸切除術后房顫的發生率為12.6%[4],而食管癌患者食管切除術后房顫發生率為9.2%,對于行食管切除術患者,術后房顫可作為術后并發癥和死亡的重要預測指標[5]。一項病例對照研究表明,結直腸癌或乳腺癌手術患者的房顫發生率是非腫瘤相關手術患者的2倍。
促進腫瘤外科術后房顫發生的因素可以分為急性因素和慢性因素,急性因素與手術直接相關,慢性因素包括年齡、高血壓、糖尿病、肥胖和慢性阻塞性肺疾病等。
1.1 促進腫瘤術后房顫發生的急性因素
腫瘤術后房顫與胸部手術、全身炎癥反應、氧化應激和交感神經激活密切相關。房顫是肺癌患者外科治療或肺葉切除術后早期最常見的心律失常。近年來研究表明,有肺葉切除術史的房顫患者的肺靜脈殘端仍具有自律性。眾所周知,肺靜脈是房顫的主要觸發灶,并且肺靜脈殘端與心臟自主神經在房顫發生中可能存在相互聯系,連接肺靜脈殘端的神經和與內在神經節神經叢連接的神經放電被認為是房顫的潛在觸發灶。研究表明,這些肺葉切除術后發生房顫的患者進行導管消融術與普通房顫患者的遠期成功率相近。許多研究也證實了術后房顫的發生與促炎因子的激活存在時間關聯,提示炎癥激活可能是術后房顫發生的重要因素。另有研究顯示,介導心臟組織和循環系統的免疫反應的免疫細胞和蛋白的浸潤與房顫發生有關。此外,手術創傷后的交感神經損傷會影響食管切除術后房顫發生,并在房顫的發生中發揮重要作用。肺葉切除術后,心房鉀通道蛋白表達發生改變,導致心房肌細胞外向鉀電流增多、心房動作電位縮短、術后房顫易感性增加。術后低氧與食管癌術后房顫明顯相關,氧化應激激活參與房顫發生發展,抗氧化治療可能有助于預防腫瘤患者術后的房顫發生[6-7]。
1.2 促進腫瘤術后房顫發生的慢性因素
術后房顫也是肺葉切除或食管切除術后的一種常見并發癥,其發生還與腫瘤患者術前合并的一些慢性疾病有關。老年、男性、心臟病史、高血壓、術前腦鈉肽水平≥30 pg/mL都是術后發生房顫的危險因素。食管癌手術發生房顫也較常見,可能與年齡、糖尿病、合并心血管疾病有關。既往研究顯示肥胖是心臟外科手術術后新發房顫的獨立危險因素,此外,糖尿病也是房顫發生發展的重要危險因素之一,且可預測卒中和血栓栓塞。糖尿病和高血壓等病理狀態下會導致心房肌細胞內鈣穩態失衡,導致細胞內鈣超載,進而引起觸發活動,導致房顫。房顫在右心衰竭、肺血管疾病和慢性阻塞性肺病患者中很常見,并隨著病情的進展發生率逐漸增加[8-9]。
2 抗腫瘤藥物與心房顫動
心臟毒性是抗腫瘤治療的重要不良反應之一,它會增加腫瘤患者遠期死亡率。抗腫瘤治療還會增加腫瘤患者的心血管疾病風險,各種抗腫瘤治療方法如化療、放療、靶向治療、激素療法和抗血管生成治療都對心血管系統有一定影響,并且抗腫瘤聯合治療尤其是放化療聯合常會加重心臟毒性[10]。表1總結了3種主要抗腫瘤藥物(如烷化劑、蒽環類藥物和靶向治療)與心臟相關的潛在不良反應。可能導致房顫的抗腫瘤藥物包括:化療藥物如烷化劑(如順鉑、馬法蘭、環磷酰胺)、蒽環類藥物(如阿霉素)和靶向治療(如曲妥珠單抗、索拉非尼、舒尼替尼)等。化療藥物導致房顫的機制有直接損傷心肌、激活炎癥和氧化應激信號通路等。
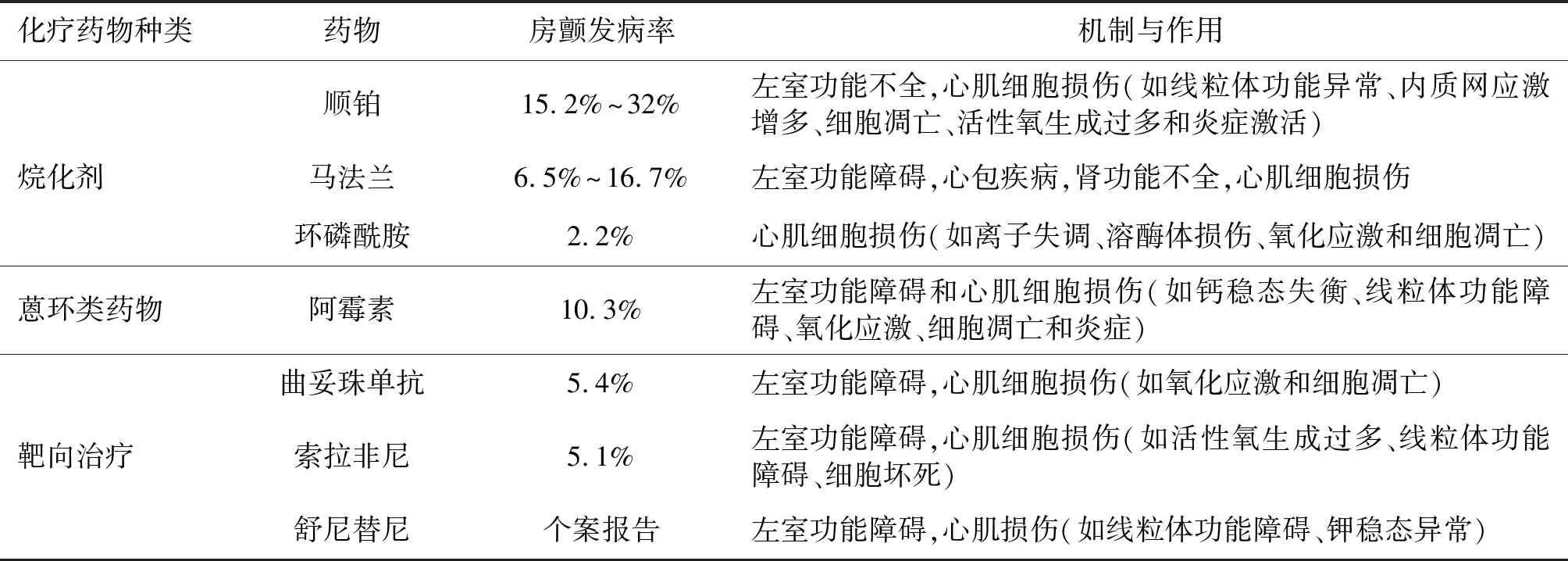
表1 誘發房顫的抗腫瘤藥物
2.1 烷化劑
據報道,順鉑、馬法蘭、環磷酰胺等烷化劑可誘發腫瘤患者發生房顫[11-12]。應用順鉑的腫瘤患者中15.2%~32.0%可發生房顫,應用馬法蘭的腫瘤患者中6.5%~16.7%可發生房顫,高劑量環磷酰胺聯合美司鈉注射也能導致急性房顫發作。骨髓移植患者接受環磷酰胺和全身放療的預處理后,45例患者中有5例出現各種類型心律失常,包括頻發室性早搏(2例),陣發性房顫(1例),室上性心動過速(1例),QT間期延長合并室速(1例)。研究結果表明,順鉑導致的心臟毒性可能會誘發左室功能障礙、心肌細胞收縮功能下降、線粒體功能異常、內質網應激和凋亡增多、活性氧產生過多和炎癥激活,而且與腫瘤壞死因子-α(TNF-α)和核因子(NF)-κB通路介導的炎癥反應上調有關。有報道顯示,應用順鉑的腫瘤患者發生室上性快速性心律失常可能與順鉑導致的鎂代謝紊亂有關。夾竹桃麻素是一種特異性NADPH氧化酶拮抗劑,可通過抑制氧化應激和炎癥通路來改善順鉑引起的心臟毒性,可能有助于房顫的預防。馬法蘭具有很強的潛在心臟毒性,報道稱可引起腫瘤患者發生左室功能障礙、心包疾病和腎功能障礙。環磷酰胺誘發心臟毒性的可能機制包括氧化應激激活、炎癥和細胞凋亡。4-氫過氧環磷酰胺(環磷酰胺的一種活性衍生物)通過增加細胞內鈉和鈣離子濃度、減少鉀離子濃度和ATP的含量、損傷溶酶體來增加心肌細胞的細胞毒性。環磷酰胺還會導致心肌肥厚、心肌纖維化、心肌水腫和炎癥因子如白介素-1β、腫瘤壞死因子-α和白介素-10等表達增加,促進房顫發生。
2.2 蒽環類藥物
阿霉素被廣泛地用于各種腫瘤的治療,可引起劑量相關的心臟毒性,包括一過性心電圖異常、心肌病和心力衰竭[13]。阿霉素也可以導致各種心律失常。阿霉素可以通過下調心臟Cx43/Cx45連接蛋白表達導致進行性心臟功能異常和左室重構。阿霉素可導致心肌細胞線粒體功能障礙、氧化應激和細胞凋亡。阿霉素可導致心肌肌漿網Ca2+ATP酶表達減少,誘發心力衰竭。阿霉素誘導鈣調蛋白依賴性激酶Ⅱ(CaMKⅡ)激活,導致心肌肌漿網Ca2+滲漏,破壞細胞內Ca2+穩態,增加心臟觸發活動和房顫的發生[14]。CaMKⅡ在房顫的發生中發揮重要作用,CaMKⅡ激活可以增加心房肌細胞晚鈉電流和L型鈣電流和鈣調控蛋白磷酸化,導致肌漿網鈣滲漏,抑制CaMKⅡ活性可以減輕阿霉素導致的心臟毒性[14],因此,抑制CaMKⅡ活性可以作為減少化療誘發房顫的一種可能治療方案。
2.3 靶向治療
靶向治療旨在干擾參與腫瘤發展進程中的特異性信號分子。靶向治療藥物一般分為單克隆抗體(如曲妥珠單抗)或小分子物質(如索拉非尼和舒尼替尼)。靶向治療對腫瘤患者具有心臟毒性,這與心臟脫靶效應有關。乳腺癌患者發生新診斷的房顫(5.4%)與早期停用曲妥珠單抗有關。此外,最近的薈萃分析顯示曲妥珠單抗應用過程中房顫的發生率為1.2%[15]。39名肝癌患者在進行索拉非尼聯合5-氟尿嘧啶的Ⅱ期試驗中,2例患者發生房顫,1例患者發生心衰。3例使用舒尼替尼預處理的轉移性腎癌患者中有1例發生房顫。研究提示多數酪氨酸激酶抑制劑能顯著增加腫瘤患者的QTc間期。曲妥珠單抗是一種作用于HER2的單克隆抗體,主要用于HER2過度表達的轉移性乳腺癌的靶向治療。在小鼠模型中,曲妥珠單抗通過增加心肌的氧化應激和凋亡、改變心肌細胞的超微結構導致心臟毒性。有證據表明,曲妥珠單抗與心肌細胞表面的HER2蛋白結合,阻斷了ErbB2-ErbB4信號傳遞,進而造成左室收縮功能障礙。轉移性胃腸間質瘤患者使用舒尼替尼治療也可能引起左室功能障礙[16]。多靶向藥物舒尼替尼能抑制一磷酸腺苷活化的蛋白激酶(AMPK),增加脂質沉積,阻滯鉀通道,導致心律失常。索拉非尼造成心臟毒性的機制包括左室功能障礙、活性氧生成增加、線粒體功能障礙和心肌細胞壞死[17]。
3 免疫機制在腫瘤導致房顫中的作用
有研究提示腫瘤本身可能就是房顫發生的獨立危險因素。一項入選乳腺癌和結腸癌患者的病例對照研究證實,腫瘤會影響房顫的發生發展。炎癥激活參與惡性腫瘤和房顫的發生發展。在腫瘤和房顫發展進程中可發現多種炎癥細胞因子如C反應蛋白、腫瘤壞死因子(TNF)-α,白介素(如白介素-6)和巨噬細胞遷移抑制因子水平升高。炎癥在腫瘤發生發展中發揮重要作用,而房顫可能是腫瘤的一種炎癥并發癥。他汀類藥物的抗炎作用可以有效預防房顫。因此,調節發生房顫的腫瘤患者的免疫應答可能是預防房顫的一個潛在策略。
3.1 C反應蛋白
C反應蛋白水平升高提示體內炎癥激活,與房顫發生發展密切相關[18]。與腫瘤相關的全身性炎癥能通過誘發心房結構重構來促進和維持房顫,臨床研究發現,可以通過心房組織內局部C反應蛋白定位來確定心房局部炎癥,相比持續性房顫,局部炎癥更多參與陣發性房顫。乳腺癌患者在化療的同時使用降低C反應蛋白的藥物可以提高生存率。秋水仙堿能顯著降低炎癥介質如白介素-6和C反應蛋白的水平,可用于預防肺靜脈隔離術后早期房顫的復發,臨床使用秋水仙堿對肝癌患者有抗癌作用。越來越多的臨床證據表明,他汀類藥物除了能調節血清膽固醇水平外,對癌癥的預防和治療也有潛在的影響。他汀類藥物治療能減輕炎癥,顯著減少高敏炎癥標志物如C反應蛋白,因此有助于預防房顫[19]。
3.2 腫瘤壞死因子-α
TNF-α主要由單核細胞和巨噬細胞產生,是免疫應答的重要調節因子,也是細胞因子網絡中的重要成分。TNF-α在多種癌癥類型中均表現為上調,且與腫瘤患者不良預后、激素治療反應性缺失和惡病質的發生有關。既往研究發現TNF-α可能參與慢性房顫的發生。瓣膜性房顫患者與竇性心律的瓣膜病患者相比,NF-κB活性增強、TNF-α和IL-6濃度升高、單核細胞浸潤增多、纖維化增多。持續性和永久性房顫患者TNF-α的濃度遠高于陣發性房顫患者[20]。TNF-α誘發多種細胞包括心肌細胞的凋亡。TNF-α增加肺靜脈起源房性心律失常的發生,破壞細胞內鈣穩態,進而誘發房顫。TNF-α還通過一氧化氮依賴機制誘發大鼠心肌細胞電生理異常。同時,以TNF-α為靶點被認為是腫瘤治療的一種潛在的免疫治療方案。研究發現TNF-α是結腸癌發生和發展的重要調節因素,阻斷小鼠體內的TNF-α可以減少與結腸炎相關結直腸癌的發生。因此,抗TNF-α藥物可能有助于預防腫瘤治療誘發的心臟毒性和房顫。
3.3 白介素-6
在多種類型的腫瘤和心臟疾病如心力衰竭和房顫中均有白介素的產生增加,心衰和房顫患者的促炎癥細胞因子包括白介素-6的水平會升高。房顫患者血漿白介素-6水平升高,并且與房顫進程有關,同時與心臟復律后房顫復發以及血栓形成有關[21]。哺乳動物雷帕霉素靶蛋白(mTOR)的活化能減少白介素-6的產生、減少巨噬細胞的聚集,進而保護心臟功能。托珠單抗是一種抗白介素-6受體抗體,具有抗心律失常作用,通過抑制白介素-6可能減少房顫,有助于預防心臟手術后房顫的發生和復發。應用白介素-6阻滯劑作為抗腫瘤藥物已經在多種癌癥中應用,包括肺癌、多發性骨髓瘤、B細胞非霍奇金淋巴瘤、前列腺癌、腎細胞癌、卵巢癌以及頭頸部癌癥等。但是,應用抗白介素-6/白介素-6受體/gp30進行癌癥治療仍需進一步的臨床前和臨床研究的闡明。總的來說,這些研究強調了控制白介素-6的表達可能預防癌癥患者心臟功能障礙。
3.4 巨噬細胞遷移抑制因子
巨噬細胞遷移抑制因子(MIF)是一種基因多效性的炎性細胞因子,作為多種急性和慢性炎癥性疾病的調節因子。MIF在炎癥通路中起重要作用,與多種表型腫瘤的形成密切相關[22]。MIF在心血管疾病的發病機制中發揮重要作用。心衰和房顫患者的MIF水平升高。MIF的表達與類風濕性關節炎的發病機制有關聯,而類風濕性關節炎是房顫的一個重要的危險因素。細胞外MIF與攜帶CXCR2受體的單核細胞之間的相互作用能夠增加炎癥細胞動員并導致心臟功能受損。MIF可能是通過破壞鈣通道和活化c-Src激酶來減少心房肌細胞的T型鈣電流進而參與房顫的形成。阻滯MIF能顯著減慢某些腫瘤在體內或體外系統的生長,如肺癌、甲狀腺癌、膀胱癌、鱗狀細胞癌、黑色素瘤和結腸癌,抑制MIF能預防高脂飲食誘發的心力衰竭以及壓力負荷誘發的心肌肥厚[23]。
4 結語
大量研究已經證實,腫瘤患者發生房顫可能與手術、腫瘤藥物治療和腫瘤相關免疫有關,同時,房顫的發展也會影響腫瘤患者的預后和治療效果。因此,研究腫瘤患者房顫的發生和維持機制十分重要,將有助于提高腫瘤患者的臨床治療效果。

