器質性心臟病合并室速射頻消融的方法及效果分析
李枚娟 楊亞莉 黃衛斌
1 資料與方法
1.1 研究對象
以2016年1月1日至2018年10月31日在本中心因器質性心臟病合并室性心動過速接受射頻消融治療的15例患者為研究對象,其中,男13例,女2例,平均年齡(55±15)歲。術前常規停用抗心律失常藥物至少5個半衰期,完成血常規,肝、腎功能,電解質,X線胸片,心臟彩超檢查。
1.2 電生理檢查和消融方法
患者在局麻或全麻下安放冠狀竇電極、右心室心尖部的標測電極, 術中以左、右室心尖部或右室流出道起搏,心內電生理檢查以誘發心動過速為主要終點,分析心動過速時QRS波形態特點,分析其起源部位。根據電生理檢查結果送消融導管至相應靶點進行消融手術治療。術中均應用三維標測系統,采用Carto-Univu等技術降低X線輻射劑量。術中采用基質標測、特殊電位標測、起搏標測、拖帶標測、激動標測相結合的方法,提高手術成功率。
1.3 隨訪方案
所有患者分別按消融術后1周、1個月、3個月、半年、1年行心電圖和24 h動態心電圖檢查,所有病例采用門診及電話方式隨訪。
2 結果
15例患者中男性所占比例為86.7%(13/15),女性所占比例為13.3%(2/15),器質性心臟病類型及合并室速的起源部位見表1。
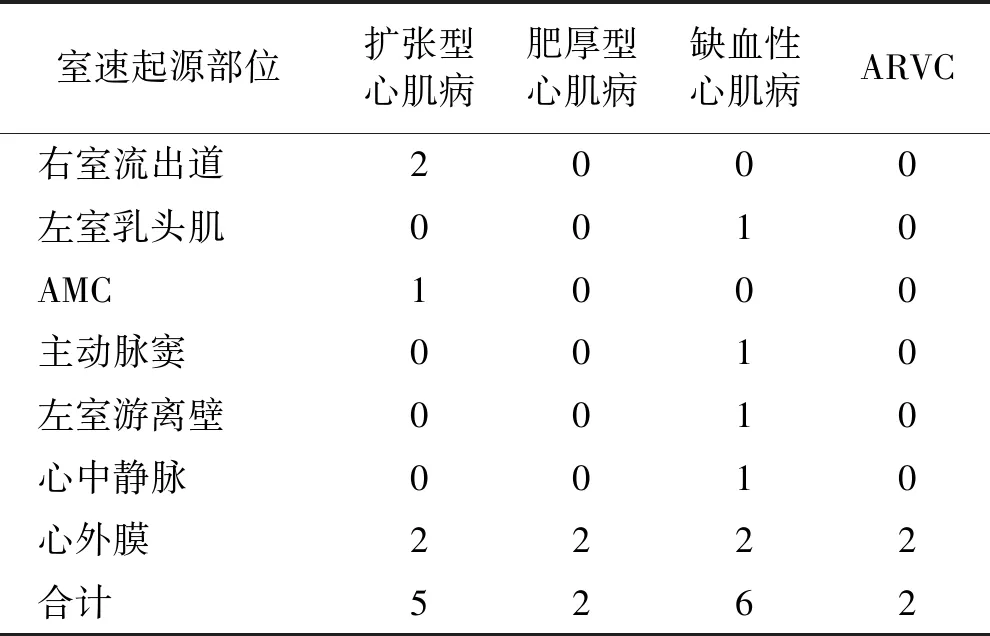
表1 器質性心臟病類型及合并室速的起源部位
ARVC: 致心律失常性右心室心肌病;AMC: 主動脈瓣與二尖瓣環交界區
本中心15例器質性心臟病合并室速患者行射頻消融術,其中8例行心外膜消融(其中1例行內外膜聯合消融);3例為多源性室速(室速發作形態>2種),均為缺血性心肌病。15例患者室速射頻消融有效性與安全性分析與隨訪結果:射頻消融術治療后隨訪(17±3)個月,隨訪期間無持續性室速(持續發作時間>30 s)發作,3例行心外膜消融的患者(1例ARVC,2例缺血性心肌病)及1例行心內膜消融的患者(缺血性心肌病)術后仍有頻發室早,室早負荷占全天總心搏的10%以上,但無室速發作,無暈厥。15例器質性心臟病合并室速患者行射頻消融術后,無持續性室速發作,均達到臨床消融成功,術后均未出現明顯并發癥,無死亡、無出血。
3 討論
器質性心臟病是心臟疾病的總稱,包括先天性心臟病、冠心病、高血壓心臟病、風濕性心臟病、肺源性心臟病、心肌病等各種心臟病,其中心肌病主要包括擴張型心肌病(DCM)、肥厚型心肌病(HCM)、缺血性心肌病、浸潤性心肌病(如心臟淀粉樣變性)、限制性心肌病和其他心肌病(如左室致密化不全和Chagas病)。本文的研究對象中主要有DCM、HCM、缺血性心肌病、ARVC這4種類型。
器質性心臟病合并室速多數由折返環路引起,心肌纖維化后形成的瘢痕區域為致心律失常基質。心肌病變或瘢痕區域中殘存的島狀心肌組織為室速折返環的關鍵部位,這種非均一性的組織排列為電活動的緩慢及各向異性傳導提供了解剖學基礎[1]。心肌梗死為左室瘢痕性室速的最常見原因[2],本中心6例缺血性心肌病患者中有3例為陳舊性心肌梗死患者,根據冠脈血運重建指南[3],對于冠心病合并室性心律失常的患者,評估其冠脈阻塞和缺血非常重要,治療基礎心臟病較心律失常本身更為重要。主要治療措施是改善冠脈血供,對于癥狀性、反復發作的結構性心臟病合并室速患者,若經血運重建、優化的內科治療以及解除可逆性誘因后室速仍未改善, 可行導管消融以減少室速發作概率,提高無室速生存率。本中心6例缺血性心肌病患者其消融部位均位于左室,其中有3例為多源性室速,2例行心外膜消融,術后隨訪過程中,缺血性心肌病合并室早的患者較其他病種多,考慮原因為缺血心肌病變廣泛,電活動不穩定,且與消融過程中采用的消融策略、術中誘發室速維持狀態、血流動力學狀態均有一定關系。
肥厚型心肌病患者室速發生率與心肌病變程度相關,有研究顯示,25%的患者在動態心電圖中可發現非持續性室速,且與心臟性猝死相關[4]。在HCM 患者中,室間隔內部瘢痕所產生的折返環路可介導頻率極快的室速,且有蛻變為室顫的風險,本中心2例肥厚型心肌病患者的消融部位均位于心外膜左室下壁近心尖部,其中1例因室速發作時蛻變為室顫,且合并明顯血流動力學障礙,行ICD植入術,術后仍有室速反復發作,行室速射頻消融術,且術后給予抗心律失常藥物治療,未見持續室速發作,ICD未放電。
對于擴張型心肌病合并室速的患者,其機制多與瓣環附近的病變組織及瘢痕組織介導的折返有關,而4期自動除極速度加快也可能參與其中[5]。本中心5例擴張型心肌病患者中,2例行心外膜消融,部位分別位于心外膜右室下壁近心尖及心外膜間隔偏左側,3例行心內膜消融,部位分別位于左室AMC及右室流出道間隔部。
ARVC是臨床上少見的器質性心臟病,其特點為右室心肌被脂肪細胞和纖維組織替代,常呈現家族性發病特點,與常染色體顯性遺傳有關。V1、V2或V3導聯記錄到Epsilon波或局部的QRS波時限≥110 ms伴V2和V3導聯T 波倒置支持ARVC 的診斷[6]。左束支阻滯樣室早伴QRS波電軸在-90°到110°之間同樣提示ARVC。ARVC 臨床以室性心律失常,尤其是室速為主要表現,其好發部位:三尖瓣環周邊、RVOT區域、右室游離壁偏心尖部,病變嚴重時可引起右室擴大,室壁瘤及心功能不全。本中心2例ARVC消融部位分別位于心外膜右室流出道和心外膜三尖瓣環。靶點被成功標測到并成功消融,短時間內可顯著影響室速發作,很多ARVC室速電風暴患者短期內不復發[7],可以降低患者猝死概率。
器質性心臟病中室速主要發生機制為折返活動,依據各部位在折返環中的作用可分為峽部、外環、內環、旁觀者,其中峽部可細分為入口、出口與中央峽部區域。術中通過低電壓區域判定瘢痕區及峽部相關區域,通過拖帶標測以尋找關鍵峽部。制定消融策略時應注重個體化原則,爭取早期消融,徹底消融病變心肌組織,而對于非缺血性心臟病室速,由于發病機制復雜,經常需心內膜和心外膜聯合消融。目前,學術界尚未對器質性室速的消融策略達成共識。主要標測與消融策略包括心動過速下激動標測、拖帶標測、基質標測指導下的低電壓區定位、局部異常電位(LAVA)消融、瘢痕均質化消融、關鍵峽部消融等。本中心采用多種方法相結合的方式對器質性心臟病患者行射頻消融術,取得了一定的效果,改善了患者無室速生存狀態。對于部分導管消融失敗的患者,可在外科消融經驗豐富的醫療中心,通過術前和術中電生理檢查指導外科消融。本中心隨訪過程中,雖無持續性室速再發,部分患者術后仍有頻發室早、短陣發作,未來需借助更加先進的標測技術提高器質性室速的標測和消融成功率,改善患者預后。

