甲狀腺癌BRAF基因突變與CK19和HBME-1相關性研究
胥 柯,郝蘭香,黃 飛,劉艷梅
(江蘇省鹽城市第一人民醫院內分泌科,江蘇鹽城 224000)
甲狀腺癌是臨床常見的一種內分泌腺惡性腫瘤,在我國甲狀腺癌的發病率呈逐年上升趨勢,但其具體的發病機制尚不清楚[1-2]。細針穿刺細胞學活檢是臨床診斷甲狀腺癌的金標準,但只能確診70%~80%的甲狀腺癌患者[3]。目前尚無理想的蛋白標志物用于臨床診斷甲狀腺癌,因而探討甲狀腺癌的的早期診斷標志物顯得尤為必要[4]。近年來,細胞角蛋白19(CK19)、人骨骼內皮細胞標志物(HBME-1)、鼠類肉瘤濾過性毒菌致癌同源體B1(BRAF)基因等分子標志物或其組合已被建議用于臨床診斷甲狀腺癌,但這些標志物的可靠性還存在較大的爭議[5-7]。本研究通過兩種不同的方法檢測甲狀腺癌患者的CK19、HBME-1表達水平以及BRAF基因突變情況,以期探討這些分子標志物的可靠性。
1 資料與方法
1.1一般資料 選取本院2016年4月至2017年4月收治的甲狀腺癌患者62例為研究對象,其中女32例,男30例;年齡46~65歲,平均(53.26±4.78)歲。選取同期收治的62例甲狀腺良性病變患者為對照,其中男29例,女33例;年齡48~64歲,平均(54.13±3.26)歲,兩組患者的年齡、性別比較,差異無統計學意義(P>0.05),具有可比性。根據第7版美國癌癥聯合委員會(AJCC)癌癥分期手冊對甲狀腺癌進行臨床分期:Ⅰ期患者26例,Ⅱ期患者20例,Ⅲ期患者16例,腫瘤直徑0.82~1.54 cm,平均(1.13±0.32)cm。排除標準:(1)術前合并其他腫瘤,如髓樣癌、濾泡狀癌等;(2)免疫組織化學檢測指標不完整。本研究經本院倫理委員會批準通過,所有研究對象均簽署患者知情同意書。
1.2主要試劑 所用鼠抗人CK19、HBEM-1單克隆抗體(即用型)以及BRAF基因突變檢測試劑盒,均購自福州邁新生物技術有限公司。DNA提取測試盒和聚合酶鏈反應(PCR)所用試劑均購自上海生物工程有限公司。
1.3方法
1.3.1免疫組織化學法檢測 CK-19以及HBEM-1蛋白表達所有標本均經10%福爾馬林固定,石蠟包埋,連續切片(3 μm)及常規的HE染色。采用Envision兩步法對CK19和HBEM-1進行免疫標記,分別檢測62例甲狀腺癌患者組織和62例甲狀腺良性病變組織(對照)的CK19、HBME-1蛋白表達水平。具體的實驗步驟按照操作步驟說明書進行,經過一系列的抗原修復、顯色、染色操作后,用中性樹脂封片,在顯微鏡下觀察。其中 PBS代替一抗作為陰性對照,已知陽性切片作陽性參考來檢測實驗切片的染色情況。結果判定:采用雙盲法閱片,由2名病理科醫生評判計分。胞質內出現黃色顆粒狀物質為陽性,依據陽性細胞著色數計分:陽性數≥71%,3分;陽性數36%~70%,2分;陽性數6%~35%,1分;陽性數≤5%,0分。依據著色強度計分:強著色(明顯的棕黃色)2分;弱著色(淡棕黃色)1分;不著色0 分。陽性分級:兩項指標分數相加分為4級,1~2分(-),3分(+),4分(++),5~6分(+++),其中-表示陰性,+表示弱陽性,++表示陽性,+++表示強陽性,陽性發生事件為+~+++之和,陽性率(%)=陽性事件數/總病例數×100%。
1.3.2PCR法及DNA測序法檢測BRAF基因突變 分別檢測62例甲狀腺癌患者和62例甲狀腺良性病變組織BRAF基因突變狀況。電鏡下觀察甲狀腺癌患者標本組織的HE切片,選取腫瘤成分豐富的蠟塊,連續切5張3 μm厚白片,封存于EP管,二甲苯處理,蛋白酶K完全消化,嚴格依照DNA提取試劑盒說明書提取石蠟組織標本DNA,待測樣品、BRAF陰性以及陽性質控品分別加樣并配置反應體系。應用PCR擴增組織標本DNA的BRAF基因第15外顯子,而后在自動化基因分析儀(購自美國ABI公司)進行測序。采用Chromas軟件分析測序結果,刪除不穩定的測序區域后,將其后面的序列與野生型標準序列比對,標記處為600(T1799A)位密碼子,AGC可能會發生A→C突變,即密碼子600的錯義突變(V600E)。野生型核苷酸AGC TAC AGT GAA ATC TCG A,野生型氨基酸AGC KS;突變型核苷酸CGC TAC AGT GAA ATC TCG A,突變型氨基酸GCT KS。
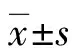
2 結 果
2.1甲狀腺癌與甲狀腺良性病變組織CK19、HBME-1蛋白表達 CK19陽性表達部位在細胞膜和細胞質,62例甲狀腺癌患者標本組織中CK19陽性事件數為62例,陽性表達率為100.0%,見圖1A,60例甲狀腺癌患者組織標本中以陽性和強陽性為主。而甲狀腺良性病變組織CK19陽性事件數為12例,其陽性表達率為19.35%,主要以陰性和弱陽性分級較多見,見圖1B。CK19在甲狀腺癌與甲狀腺良性病變組織中的表達,差異有統計學意義(P<0.05),見表1。HBME-1陽性表達部位多見于細胞膜,腺腔邊緣也有部分著色。甲狀腺良性病變組織中陽性事件僅有4例,占總樣本的6.45%,剩下58例均為陰性表達,見圖1C。而62例甲狀腺癌患者標本組織,陽性事件數為60例,其陽性表達率為96.77%,多數以陽性和強陽性分級表達為主,見圖1D。HBME-1在甲狀腺癌與甲狀腺良性病變組織中HBME-1的表達,差異有統計學意義(P<0.05),見表1。
2.2BRAF突變情況的分析 通過BRAF基因檢測發現,62例甲狀腺癌患者中有37例BRAF基因發生突變,陽性率為59.68%,BRAF突變為點突變,具體表現為15號外顯子1799位點,腺嘌呤替換為胞嘧啶(T1799A)。62例甲狀腺良性病變患者組織均沒有發生BRAF T1799A基因突變,突變率為0。在陽性分級較低的Ⅰ和Ⅱ級中,BRAF的突變率分別為46.15%(12/36)和50.00%(10/20),在侵襲行為較高的陽性分級到達Ⅲ級的甲狀腺癌組織中BRAF的突變率明顯提高,達到93.75(15/16)。當腫瘤直徑≥1 cm時,BRAF的突變率達到78.26%(36/46),直徑<1 cm時,BRAF的突變率明顯降低,突變率為6.25%(1/16)。

表1 兩組患者組織CK19、HBME-1表達差異比較[n(%)]

注:A表示甲狀腺癌組織CK19呈強陽性;B表示甲狀腺良性病變組織CK19呈弱陽性;C表示甲狀腺良性病變組織中HBME-1呈弱陽性;D表示甲狀腺癌組織HBME-1呈強陽性
圖1 甲狀腺癌與甲狀腺良性病變組織CK19、 HBME-1 免疫組織化學圖

表2 BRAF基因突變陽性率與CK19、HBME-1以及其他臨床病理特征的關系
2.3Spearman相關分析 將甲狀腺癌患者BRAF基因突變與CK19、HBME-1表達、腫瘤分期以及腫瘤直徑等進行Spearman相關性分析,結果顯示,BRAF基因突變陽性率與腫瘤直徑、TNM分期呈負相關(均P<0.05),與CK19以及HBME-1陽性表達率呈顯著正相關(均P<0.05),數據見表2。
3 討 論
CK19是一類低分子量角蛋白,在多種上皮組織中均可表達[8]。近年來,相關研究結果表明,甲狀腺癌患者上皮組織中的CK19表達水平較高,陽性率為70.00%~100.00%,而在甲狀腺良性病變組織的陽性率不穩定,沒有確切的陽性表達[9]。這些研究結果顯示,甲狀腺癌患者組織中的CK19表達率遠高于甲狀腺良性病變患者組織,靈敏度高達100.00%[10]。本研究結果顯示,甲狀腺癌患者組織中的CK19陽性率達100.00%,而甲狀腺良性病變患者的CK19陽性率僅為19.35%,與上述研究結果一致。然而最近研究表明,CK19的特異性較低,導致臨床診斷甲狀腺癌使用CK19作為觀察指標的作用受限,故而臨床診斷過程不能單獨依靠CK19陽性診斷甲狀腺癌[11]。同時,研究結果發現,中等以上強度的CK19陽性表達對甲狀腺癌有較好的警惕性作用,說明CK19具有一定的作用。
HBME-1是間皮細胞微絨毛表面特異性標志物。因其在腫瘤血管的形成、腫瘤的生長以及腫瘤的轉移中發揮重要作用,并且高表達于甲狀腺癌組織中,因此,可應用于臨床診斷甲狀腺癌良惡性腫瘤。相關研究報道,HBME-1在甲狀腺癌組織和甲狀腺良性病變組織病變間的表達差異有統計學意義,特異度和靈敏度均較高[12]。可見,HBME-1在用于甲狀腺癌的鑒別診斷時,是一項較為理想的標志物。有研究結果發現,若以特異度最高的HBME-1聯合CK-19蛋白作為臨床診斷甲狀腺癌的依據,可使病理診斷結果更加可靠。本研究結果中,HEME-1在甲狀腺癌組織中陽性檢出率為96.77%,在甲狀腺良性病變組織中的陽性檢出率6.45%,也說明HEME-1在惡良性腫瘤中檢出的靈敏度較高。
BRAF位于7q34,是RAF基因家族成員之一,在MAPK信號通路中起重要作用。近年文獻報道,BRAF基因突變多發于甲狀腺癌患者組織,最多見的突變位點是15外顯子1799位點,該處的T被替代成A(T1799A),導致編碼的蛋白產物發生改變,第600位本應是纈氨酸結果變成了谷氨酸,致使基因介導的信號通路發生了異常,但該突變僅見于甲狀腺癌和部分可能起源于甲狀腺癌的未分化癌患者[13]。國外相關研究報道表明,甲狀腺癌患者組織中的BRAF基因15外顯子1799位點突變率多在30%~45%,而國內相關報道甚少[14-15]。本研究結果顯示,甲狀腺良性病變患者組織沒有1例發生BRAF基因突變,而甲狀腺癌患者多達37例發生BRAF T1799A突變,與國外報道相似,表明BRAF基因突變可能是甲狀腺癌發生的一項重要事件,有利于臨床早期診斷甲狀腺癌。但與國外研究的結果有所不同,本研究中的BRAF T1799A突變率略高于國外水平,其可能原因是與環境因素有關。BRAF基因突變與CK19、HBME-1表達水平存在顯著正相關,同時本研究發現BRAF基因突變與臨床病理參數(TMN分期、腫瘤直徑)存在顯著負相關,再次表明BRAF基因突變以及CK19、HBEM-1可作為臨床診斷甲狀腺癌的指標。
4 結 論
本研究首次探討了甲狀腺癌發生過程中BRAF基因突變與CK19和HBME-1分子表達間的相關性,結果表明將BRAF基因突變與CK19和HBEM-1進行聯合檢測對甲狀腺癌發生的診斷具有較高的臨床價值,可作為臨床診斷指標。

