殼聚糖和殼寡糖保鮮湖北利川山藥的研究
黃夢甜,張正茂
(湖北工程學院生命科學技術學院,湖北孝感 432000)
我國是世界上重要的山藥種植大國,無論是在種植面積、總產量還是消費量都是世界上最大的國家[1]。目前,山藥中的重要成分尿囊素正作為外用制劑而廣泛用于皮膚科臨床,并具有較好的治療效果。另外,相關試驗表明,用山藥中所含的山藥素對豚鼠進行皮內注射,發現對其有局部的麻醉作用[2]。湖北利川山藥,屬日本薯蕷優質品系,藤蔓植物,色白、液濃、味清香,高黏液質,外形獨特,薯蕷的塊根及干燥塊根既可食用,又可入藥,內含豐富的維生素、鈣、磷等重要元素,以及多種營養成分,如蛋白質、胡蘿卜素、多糖、脂質等。因其品質優良、特色明顯、種植歷史悠久,利川山藥被評為“國家地理標志保護產品”[3]。由于山藥在采后運輸過程中,主要有皮薄肉嫩、根莖粗長、莖脆易斷的問題;運輸過程中機械損傷較為嚴重、易造成腐敗霉變;鮮切后褐變迅速;對溫度和濕度敏感;低溫造成冷害凍害、高濕造成腐爛發霉、變軟等現象普遍且不易逆境愈傷[4]。利川山藥在銷售前農戶會將上端掰斷后留種,造成較大的斷面;另外由于其皮薄、肉色凝白,損傷后極易褐變,造成直接貯藏過程中極易腐爛。目前,在果蔬保鮮中天然保鮮劑越來越受到重視,最常用的保鮮劑是殼聚糖及其降解產物殼寡糖[5-6]。而針對山藥的保鮮方法多種多樣,主要集中在鮮切山藥涂膜保鮮上。例如,馬利華等人[7]以大豆分離蛋白、魔芋純粉、殼聚糖及甘油為原料制備涂膜保鮮劑對鮮切山藥進行涂膜保鮮。姜瑜倩等人[4]研究了1-甲基環丙烯、特克多、殼聚糖等不同的保鮮劑對山藥保鮮效果的差異。張帆等人[8]研究改性葛根淀粉涂膜對鮮切山藥保鮮效果的影響。然而對于帶皮保鮮方面的研究較少,且殼寡糖在山藥保鮮中的應用未見報道。由于殼寡糖具有良好的抗菌作用[9-10],葡萄[10]、西蘭花[11]等果蔬貯藏中有較好的保鮮作用。因此,以殼聚糖和殼寡糖為原料,對利川山藥的保鮮效果進行研究,以期延長帶皮利川山藥的貯藏期。
1 材料與方法
1.1 試驗材料、藥品、器材、儀器
1.1.1 試驗材料及藥品
利川山藥、殼寡糖,大連中科格萊克生物科技有限公司提供;殼聚糖(化學純,脫乙酰度為80.0~95.0),國家集團化學試劑有限公司提供;冰乙酸,天津市恒興化學試劑制造有限公司提供;甘油,深圳市華亞化工有限公司提供;鄰苯二酚,天津市化學試劑公司分公司提供;抗壞血酸,湖北金銘州工貿有限公司提供;2,6-二氯靛酚鈉,武漢市華順生物技術有限公司提供。
1.1.2 主要儀器與設備
SPX-250BSH-Ⅱ型生化培養箱,上海新苗醫療器械制造有限公司產品;TGL-20M型臺式高速離心機,長沙邁佳森儀器設備有限公司產品;DF-101S型集熱式攪拌器,金壇市科技儀器有限公司產品;FA1004N型分析天平,上海(菁華)集團公司產品;YP6002型電子天平,上海越平科學儀器有限公司產品;V5600型分光光度計,上海元析儀器有限公司產品;LKTC-B1-T型水浴鍋,江蘇盛藍儀器制造有限公司產品。
1.2 試驗方法
1.2.1 保鮮液的制備
稱取10 g殼聚糖粉末,溶于體積分數為1%冰乙酸溶液中,并添加適量質量分數為20%的甘油,在室溫下置于集熱式攪拌器中攪拌3 h,配制成質量分數為1%的殼聚糖溶液;然后稱取10 g殼寡糖粉末,溶于添加了等量20%的甘油的1%冰乙酸溶液中,得到質量分數為1%的殼寡糖溶液;空白對照組則是在清水中添加等量20%的甘油的1%冰乙酸溶液。
1.2.2 山藥的涂膜處理
挑選大小接近、粗細均勻、外表無機械損傷的山藥段,輕輕洗去表皮的泥土,然后去掉山藥兩端,再掰成5~10 cm的山藥段(不用刀片,以免對山藥造成組織損傷),隨機打亂分成3組,每組27段山藥。
將山藥分別置于上一步所配制的保鮮液中浸泡10 min后撈出瀝干水分,然后將山藥置于10℃生化培養箱中,先每隔2 d測定1次指標,約測定3次后再每隔5 d測定1次指標。
1.2.3 山藥指標的測定

式中:褐變指數(BI)=∑GQ/(4T):
T——山藥總段數;
Q——該級別山藥段數;
G——褐變級別。
(0級-無褐變,1級褐變面積<20%,2級褐變面積20%-35%,3級褐變面積35%~50%,4級褐變面積>50%)。
VC含量測定用2,6-二氯靛酚鈉鹽法;
多酚氧化酶(PPO) 活性參考高夢祥等人[12]的方法:稱取5 g樣品,切碎,加入濃度0.05 mol/L磷酸緩沖液(pH值6.525 mL),低溫下在研缽中磨碎,將勻漿轉入離心管,于4℃下以轉速14 000 r/min離心20 min,取上清液,即為PPO提取液。先加入2.8 mL在30℃保溫過的0.05 mol/L鄰苯二酚溶液(0.05 mol/L磷酸緩沖液配制),再加入0.2 mL提取液,于波長420 nm處進行測定,記錄吸光度的變化。每分鐘吸光度變化0.001為一個活力單位(U)。
1.2.4 數據分析
采用SASv 8.1軟件進行分析,用ANOVA進行方差分析,顯著性檢驗方法為Duncan,檢測限為0.05。有關數據為3次以上平均值。
2 結果與分析
2.1 失質量率的變化
采用稱重法測定經不同處理液浸泡處理貯藏后失質量率的變化,首先測定時每隔2 d記錄1次各組山藥貯藏后的質量,然后每隔5 d記錄山藥質量,共計5次。
不同溶液處理下樣品的失質量率見圖1。
由圖1可以看出,隨貯藏時間延長,3組失質量率均呈顯著上升趨勢(p>0.05),但是殼聚糖組和殼寡糖組的失質量率低于空白組,說明殼聚糖和殼寡糖對樣品失質量率上升有一定的抑制作用,且殼聚糖的抑制作用強于殼寡糖,但4 d后差異不顯著。這是因為殼聚糖和殼寡糖均具有成膜性,在山藥表面形成薄膜,從而阻止水分散失[1];另外,涂膜保鮮對空氣具有一定的阻隔性,從而延緩呼吸高峰的出現,減少糖類等有機物質的損耗[10]。鄧麗莉等人[13]利用殼寡糖處理柑橘,發現該處理可以降低柑橘果實貯藏過程中的失質量率。
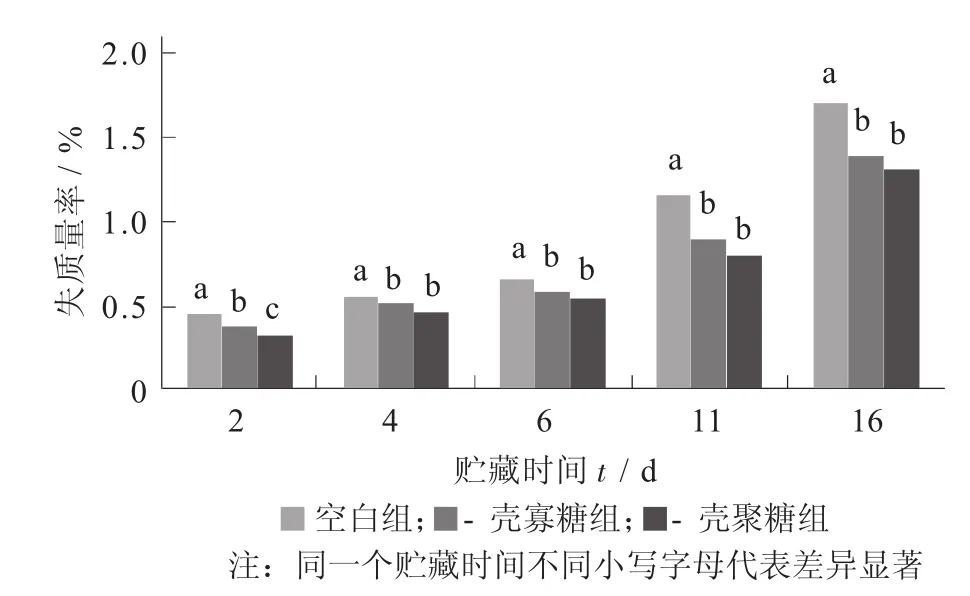
圖1 不同溶液處理下樣品的失質量率
2.2 褐變率的變化
通過計算褐變率來表現不同組山藥經一定貯藏時間下褐變情況。
不同溶液處理下樣品的褐變率見圖2。

圖2 不同溶液處理下樣品的褐變率
由圖2可以看出,開始時殼聚糖處理的樣品褐變率為0,后隨著貯藏時間的延長,3組樣品褐變率均上升,但是空白組的褐變率始終高于殼聚糖組和殼寡糖組,在第16天時達到91.7%,幾乎全部褐變,其次是殼寡糖組,最低的為殼聚糖組,殼聚糖和殼寡糖的差異不顯著(p>0.05)。由此說明殼聚糖和殼寡糖均能延緩樣品的褐變程度,這是由于殼聚糖具有良好的成膜性,可在山藥表面形成薄膜,阻止O2與褐變底物接觸而防止褐變產生[1]。這一結果與王梅等人[1]和鄭科旺等人[14]采用殼聚糖復合保鮮劑涂膜保鮮鮮切山藥的結果一致。
2.3 腐爛率的變化
由于山藥在低溫貯藏時腐爛較慢,所以前3次(6 d內)測定失質量率和褐變率時腐爛率為0,為了方便比較3組的腐爛情況,從試驗的第8天開始記錄山藥腐爛情況,每隔2 d記錄1次,共記錄5次腐爛或霉變情況。
不同溶液處理下樣品的腐爛率見圖3。
由圖3可以看出,3組樣品腐爛率均隨貯藏時間的延長而逐漸上升,其中上升幅度最大的是空白組,殼寡糖組次之,殼聚糖組最小,從而說明殼聚糖對樣品腐爛的延緩作用優于殼寡糖。造成該結果的原因是因為殼聚糖和殼寡糖均具有一定的抑菌性和殺菌性,而殼聚糖對微生物的抑制和抵抗效果優于殼寡糖。
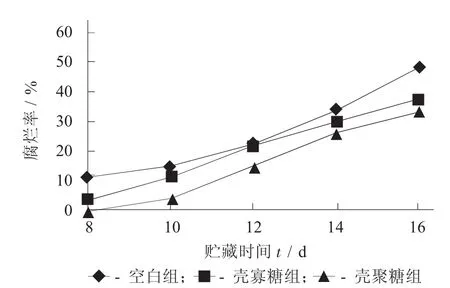
圖3 不同溶液處理下樣品的腐爛率
2.4 維C含量的變化
采用2,6-二氯靛酚鈉鹽法,首先用標準抗壞血酸溶液(0.1 mg/mL) 標定,然后滴定不同組樣品,記錄所用指示劑體積(mL),最后計算3組樣品中所含維C含量,共滴定并計算5次。
不同溶液處理下樣品的維C含量見圖4。

圖4 不同溶液處理下樣品的維C含量
由圖4可以看出,隨著貯藏時間延長,樣品的維C含量均下降,但是殼寡糖組的下降幅度明顯低于殼寡糖組和空白組,而空白組維C含量下降最快。這是由于O2的存在有利于降低維C的含量,而殼聚糖涂膜處理在山藥表面形成了一個低O2的微環境,抑制了果蔬內部抗壞血酸酶的活性[14-15];同時殼寡糖有一定的抗菌作用[9-10],能夠有效抑制微生物的生長,從而降低了維C被氧化的程度。這與鄭科旺等人[14]的研究結果一致。
2.5 PPO活性的變化
用冷凍離心機對樣品進行提取得到酶提取液,以鄰苯二酚溶液為底物,通過測定波長410 nm下反應液吸光度的變化來計算酶活性變化,共記錄5次。
不同溶液處理下樣品PPO的活力見圖5。
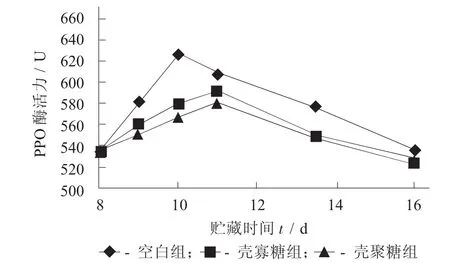
圖5 不同溶液處理下樣品PPO的活力
由圖5可以看出,樣品的PPO均呈先上升后下降的趨勢,其中空白組的酶活力在第4天達到最大值,而殼寡糖組和殼聚糖組在第6天達到最大值,且空白組的酶活力始終高于殼聚糖組和殼寡糖組,而殼寡糖略高于殼聚糖組,且差異不顯著(p>0.05),說明殼聚糖和殼寡糖可在一定程度上抑制PPO的活性。PPO活性在貯藏初期呈現上升趨勢,是因為潛伏形式存在的PPO,與相關膜系統緊密結合,在山藥切斷過程中,膜受到傷害而被活化,從而導致PPO活性增加,這種誘導的PPO僅在受誘導部位(斷面)出現,具有防御性的保衛功能[16]。在貯藏過程中,PPO將二元酚氧化成醌,PPO既作為催化劑催化原有反應,又作為反應底物與原有底物發生反應并形成一系列中間產物[16-17],從而導致活性會逐步下降,最終發生不可逆失活,這是導致PPO活性在貯藏后期呈現下降趨勢的原因。這一結果與王梅等人[1]的研究結果相似。
3 結論
試驗結果表明,殼聚糖和殼寡糖能有效保持新鮮利川山藥的品質,均能在一定程度上降低山藥水分的損失、抑制PPO活性升高、減輕褐變程度、延緩其腐爛霉變、維C的氧化反應及其含量的降低。通過綜合比較發現,殼聚糖對于山藥的保鮮效果更為顯著,但是殼聚糖需要在弱酸環境才能溶解,殼寡糖則具有更好的水溶性。

