腦缺血再灌注后炎癥反應研究進展及中西醫結合防治思路
2019-03-04 02:59:46楊小鈺黃海紅諶澤芳申奧楊仁義武玲張偉
中國現代醫藥雜志
2019年12期
關鍵詞:研究
楊小鈺 黃海紅 諶澤芳 申奧 楊仁義 武玲 張偉
每年世界上有數百萬人因腦缺血而死亡[1]。再灌注后,炎癥細胞的活化與浸潤、黏附分子的合成與分泌成為相互促進級聯反應[2],炎癥因子大量釋放,最終通過相應的信號通路產生作用。已有研究表明,在一級和二級損傷階段,炎癥反應發揮基本作用[3]。中醫稱其為“缺血性腦卒中”,近年來,隨著學者們對其研究不斷深入,中醫藥對其整體調節的優勢不斷突顯,根據分析不同的病因病機對癥治療,充分發揮中西醫結合防治腦缺血再灌注炎癥反應的優勢。
1 腦缺血再灌注炎癥反應的病理生理機制
1.1 炎癥反應的細胞基礎研究已證實,小膠質細胞、星形膠質細胞的活化和白細胞的滲出是中樞神經系統炎癥反應的細胞基礎[4]。見圖1。
1.1.1 小膠質細胞 腦缺血再灌注后,小膠質細胞迅速活化增殖,成為中樞神經系統損傷炎癥反應應答的主要效應器[5],也是炎癥反應的標志[4]。Moon等[6]通過免疫組織化學發現其可釋放大量IL-1、TNF-α 等多種炎癥因子,在中樞神經系統免疫炎癥級聯反應中發揮重要作用;Imai 等[7]研究表明,通過對沙鼠進行短暫性全腦缺血造模后發現外源性小膠質細胞起保護作用。
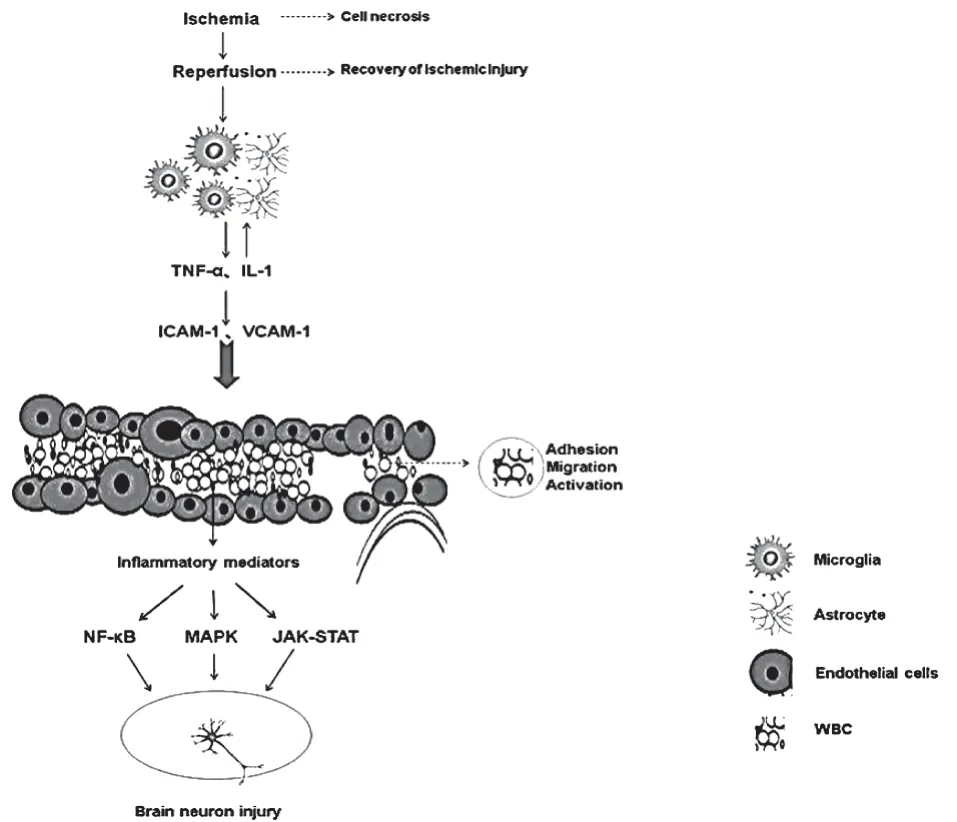
圖1 中樞神經系統炎癥反應機制
1.1.2 星形膠質細胞 星形膠質細胞在腦缺血后是最先受損的一類細胞,出現肥大、增殖,并合成表達多種炎癥介質(如NF-κB p65、TNF-α、ICAM-1),啟動了免疫級聯反應[8]。但是,在腦卒中4h 后反應應答,它可以產生膠質瘢痕以起到神經保護作用。……
登錄APP查看全文
猜你喜歡
體育科技文獻通報(2022年3期)2022-05-23 13:46:54
天津外國語大學學報(2021年3期)2021-08-13 08:32:18
遼金歷史與考古(2021年0期)2021-07-29 01:06:54
科技傳播(2019年22期)2020-01-14 03:06:54
遼金歷史與考古(2019年0期)2020-01-06 07:45:20
民用飛機設計與研究(2019年4期)2019-05-21 07:21:24
電子制作(2018年11期)2018-08-04 03:26:04
汽車工程學報(2017年2期)2017-07-05 08:13:02
國際商務財會(2017年8期)2017-06-21 06:14:14
電子制作(2017年23期)2017-02-02 07:17:19

