火焰塞曼原子吸收光譜法測(cè)定鉬中K、Na的影響因素分析
謝明明
(金堆城鉬業(yè)股份有限公司,陜西西安710077)
鉬中鉀含量的測(cè)定方法為GB/T4325.16-2013《鉬化學(xué)分析方法鉀量的測(cè)定火焰原子吸收光譜法》;鉬中鈉含量的測(cè)定方法為:GB/T4325.17-2013《鉬化學(xué)分析方法鈉量的測(cè)定火焰原子吸收光譜法》。這兩種分析方法均為火焰原子吸收測(cè)定方法,但是針對(duì)火焰塞曼原子吸收來說,在一些細(xì)節(jié)方面還有所差異,如背景處理和干擾。本文主要針對(duì)使用火焰塞曼原子吸收儀,國(guó)家標(biāo)準(zhǔn)分析方法時(shí)對(duì)測(cè)定結(jié)果影響較大的因素進(jìn)行了實(shí)驗(yàn)和分析,得出了最佳的測(cè)定方法。
1 試驗(yàn)部分
1.1 主要儀器與試劑
Z2300型火焰塞曼原子熒光光譜儀(日本日立公司),附專用空心陰極燈。
本文所用水為超純水(ρ≥18.2 MΩ),所用試劑均為優(yōu)級(jí)純。
三氧化鉬(≥99.99%)。
CsCl(25 g/L):稱取 2.5gCsCl溶于 100 mL水中。
鉀標(biāo)準(zhǔn)貯存溶液:10μg/mL鈉標(biāo)準(zhǔn)貯備液(國(guó)家標(biāo)準(zhǔn)物質(zhì)研究中心)。
鈉標(biāo)準(zhǔn)貯存溶液:10μg/mL鈉標(biāo)準(zhǔn)貯備液(國(guó)家標(biāo)準(zhǔn)物質(zhì)研究中心)。
1.2 試驗(yàn)方法
1.2.1 樣品溶液制備
稱取1.000 0 g氧化鉬、鉬酸銨,鉬粉于250 mL石英燒杯中,加入8 mL H2O2溶解,溶解后加入約50 mL水,煮沸3~5 min,取下,冷卻,轉(zhuǎn)移至100 mL容量瓶中,加入 1 mLCsCl(25 g/L),用水定容。隨同試料做空白。
1.2.2 標(biāo)準(zhǔn)溶液制備
移取 10μg/mL鈉標(biāo)準(zhǔn)貯存溶液 0 mL、0.50 mL、1.00 mL、2.00 mL于一系列100 mL容量瓶中,加入1 mLCsCl于各瓶,用水定容,轉(zhuǎn)移至100 mL塑料瓶中。
移取1 010μg/mL鉀標(biāo)準(zhǔn)貯存溶液 0、1.00、2.00、5.00 mL于一系列100 mL容量瓶中,加入1 mLCsCl于各瓶,用水定容,轉(zhuǎn)移至 100 mL塑料瓶中。
1.2.3 測(cè) 定
于日立 Z2300原子吸收上 Na 589.0 nm、K 766.5 nm處,測(cè)定其吸光度,輸入質(zhì)量和體積后,儀器自行計(jì)算測(cè)定結(jié)果。
2 結(jié)果與討論
2.1 器皿的控制
因K、Na在環(huán)境和人體中普遍存在,所以在測(cè)定K、Na時(shí)需要對(duì)所使用的器皿作要求,以減少環(huán)境對(duì)測(cè)定結(jié)果的影響:(a)稱量工具,稱量用表面皿需要專用,保證清潔。(b)燒杯必須為石英燒杯,且在使用前經(jīng)過長(zhǎng)時(shí)間純水浸泡。(c)容量瓶需要在使用前長(zhǎng)時(shí)間浸泡。(d)移液管,吸量管必須是專用。
2.2 稱樣量和過氧化氫用量
本文試驗(yàn)了不同稱樣量和不同過氧化氫的用量,結(jié)果見表1。從表1數(shù)據(jù)可以看出:鉬粉在稱樣量為0.5 g時(shí)加入4 mLH2O2即可溶解完全;在稱樣量為1.000 0 g時(shí),加入8 mLH2O2溶解完全,但是分步加入8 mLH2O2的效果可能無法實(shí)現(xiàn)溶解完全,需要簡(jiǎn)短的加熱,但是直接一次加入8 mLH2O2卻能夠完全溶解得到滿意的效果。三氧化鉬在稱樣量為1.000 g和1.500 0 g時(shí)直接加入8 mLH2O2即可全部溶解,但是值得注意的是,加蓋表面皿的效果會(huì)好于沒有加蓋表面皿的效果,沒有加蓋表面皿的溶解完全時(shí)可能在燒杯壁上形成一層漂浮物,但后續(xù)實(shí)驗(yàn)發(fā)現(xiàn),這些漂浮物在很少的情況下也不影響檢測(cè)結(jié)果。
因此,本實(shí)驗(yàn)組選取1.000 g的稱樣量作為最終的稱樣量,可以減小稱樣量對(duì)于低含量的樣品的影響,降低超出允許差的風(fēng)險(xiǎn)。
2.3 加熱煮沸時(shí)間
GB/T 4325-2013中測(cè)定鉀、鈉時(shí),在溶解后的加熱煮沸時(shí)間為10 min,以驅(qū)除多余的過氧化氫。本文對(duì)樣品溶解后的煮沸時(shí)間進(jìn)行了考察,結(jié)果見表1。實(shí)驗(yàn)結(jié)果表明,煮沸時(shí)間較短(如剛煮沸和煮沸0~1 min)會(huì)出現(xiàn)樣品檢測(cè)結(jié)果偏高的現(xiàn)象,當(dāng)煮沸時(shí)間為3 min以上對(duì)測(cè)定結(jié)果影響不大。因此本文選取煮沸時(shí)間為3~5 min左右。
2.4 CsCl使用
GB/T 4325-2013規(guī)定在測(cè)定 K、Na時(shí),CsCl濃度為25 g/L,每100 mL體積溶液加入1 mL。本文進(jìn)行了CsCl加入量的實(shí)驗(yàn),對(duì)同一批次鉬粉進(jìn)行了0.5 mL、1.0 mL、2.0 mL、5.0 mL和8.0 mL的梯度實(shí)驗(yàn),實(shí)驗(yàn)結(jié)果表明:測(cè)定鉀含量時(shí),隨著CsCl加入量的改變,測(cè)定結(jié)果也會(huì)發(fā)生改變,0.5 mL和1.0 mL加入量測(cè)定結(jié)果偏低且不穩(wěn)定,當(dāng)CsCl加入量為2 mL以后,隨著加入量的增加測(cè)定結(jié)果不變而且穩(wěn)定。測(cè)定鈉含量時(shí),隨著CsCl加入量的改變,測(cè)定結(jié)果也會(huì)發(fā)生改變,0.5 mL、1.0 mL和2.0 mL加入量測(cè)定結(jié)果波動(dòng)較大,當(dāng)CsCl加入量為5 mL以后,隨著加入量的增加測(cè)定結(jié)果穩(wěn)定。
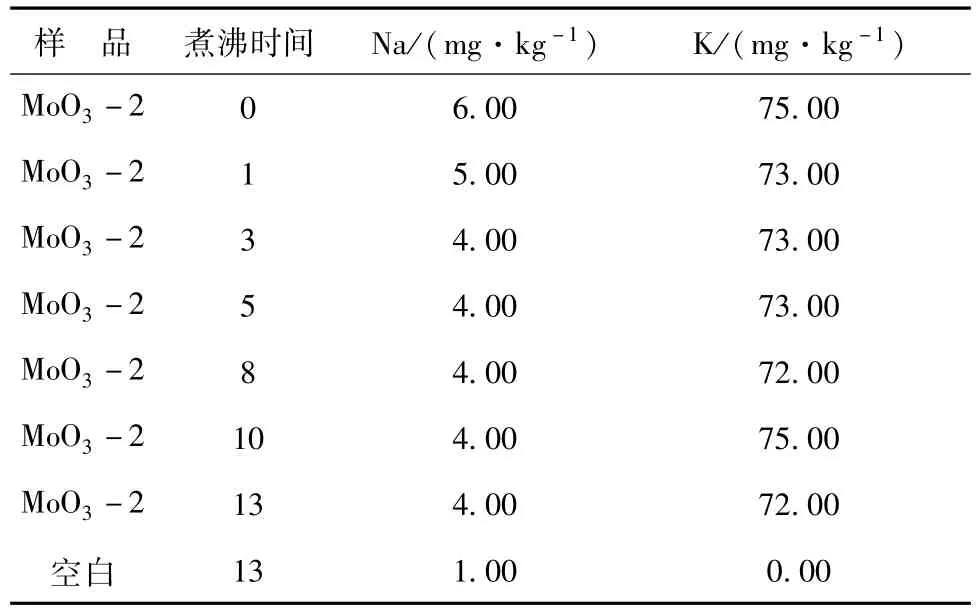
表1 煮沸時(shí)間對(duì)K、Na測(cè)定的影響
綜合考慮,本實(shí)驗(yàn)組認(rèn)為K、Na若采用同一瓶樣品測(cè)定時(shí),應(yīng)選擇CsCl加入量為5 mL,這樣能夠消電離完全,結(jié)果穩(wěn)定,可以減少誤差。
2.5 空心陰極燈之間干擾
實(shí)驗(yàn)中發(fā)現(xiàn),測(cè)定鈉結(jié)果偏高并超出允許差,經(jīng)過排查,找到原因?yàn)榭招年帢O燈全部處于開啟狀態(tài),并且同時(shí)有兩個(gè)等處于工作狀態(tài),在關(guān)閉其他燈后再次測(cè)定相同樣品,測(cè)定結(jié)果和前期的一致,因此本文認(rèn)為在測(cè)定鉀、鈉時(shí)應(yīng)關(guān)閉其他空心陰極燈以減少對(duì)測(cè)定結(jié)果的干擾。
2.6 表面皿使用的影響
在GB/T4325-2013規(guī)定測(cè)定K、Na使用表面皿,使用表面皿確實(shí)可以起到溶解徹底的效果,并且在煮沸過程中不會(huì)出現(xiàn)燒杯壁上出現(xiàn)黃色鉬結(jié)晶,但是加蓋表面皿后測(cè)定數(shù)據(jù)穩(wěn)定性較差、加蓋表面皿會(huì)使測(cè)定結(jié)果偏高,這是因?yàn)楸砻婷笤谑褂眠^程中可能會(huì)被污染,從而影響測(cè)定的結(jié)果,實(shí)驗(yàn)結(jié)果見表 2、表 3。
2.6.1 樣品測(cè)定值統(tǒng)計(jì)分析
在沒有加蓋表面皿的情況下,對(duì)樣品測(cè)定值進(jìn)行統(tǒng)計(jì)分析,結(jié)果見表4。

表2 表面皿使用對(duì)Na測(cè)定的影響
2.7 結(jié)論及建議

表3 表面皿使用對(duì)K、Na測(cè)定的影響
根據(jù)影響因素分析實(shí)驗(yàn)結(jié)果,針對(duì)火焰塞曼原子吸收光譜法測(cè)定鉬中K、Na含量,提出以下建議:(1)測(cè)定K、Na時(shí)對(duì)器皿的要求較高,建議專用。(2)測(cè)定 K、Na時(shí)稱樣量為:FMo 1.000 g、MSA 1.840 0 g、MoO31.500 g。(3)稱樣量為 1.000 g,直接一次性加入8 mLH2O2溶解樣品。(4)煮沸時(shí)間為 3~5 min。CsCl濃度為 25 g/L,加入 5 mL/100 mL,加入時(shí)采用分度吸量管加入,加入時(shí)吸量管不能伸入容量瓶?jī)?nèi),專管專用。(5)測(cè)定Na時(shí),只開啟單一的Na燈。(6)容量瓶中的樣品溶液在當(dāng)天測(cè)定完成后不清洗,待第二天測(cè)定前徹底清洗使用。(7)不加蓋表面皿,但應(yīng)注意溶解過程中不能出現(xiàn)交叉污染。(8)試劑空白的燒杯、容量瓶為專用。(9)樣品溶解后加入水的量約為50 mL。

表4 樣品測(cè)定值統(tǒng)計(jì)

