順鉑耐藥相關基因的篩選、驗證及生物信息學分析?
王旦旦,呂 琳,陳智如,饒進軍
(南方醫科大學藥學院,廣州 510515)
2018年全國癌癥報告顯示,卵巢癌是女性最常見的惡性腫瘤之一,其病死率高居婦科腫瘤之首,其中卵巢上皮癌約占60%[1]。肺癌則是我國各地區男性發病率及病死率最高的惡性腫瘤[2],而肺腺癌是最常見的肺癌類型,約占50%[3]。在晚期卵巢上皮癌及肺腺癌患者中,以順鉑等鉑類藥物為基礎的化學療法常被用于一線治療[4],而腫瘤細胞對順鉑產生耐藥性是影響其臨床治療效果和患者預后的一大難題[5]。研究表明,腫瘤一旦對順鉑形成耐藥性,則第二代的卡鉑及第三代的奧沙利鉑臨床治療效果也明顯減弱。鑒于以上事實,逆轉腫瘤細胞對順鉑的耐藥性是當前抗腫瘤研究的一個重要方向。腫瘤細胞對順鉑耐藥的形成是一個由多種因素共同參與調控的復雜過程[6],其產生的基礎是基因的差異表達。因此,通過高通量的基因芯片技術和生物信息學方法全面檢測與腫瘤順鉑耐藥相關的基因對初步探究順鉑耐藥的發生機制具有非常重要的意義[7]。
以往有關順鉑耐藥機制的研究往往只針對一種腫瘤細胞,由于卵巢上皮癌和肺腺癌均選用順鉑作為其一線化療藥物且都容易導致耐藥,因此本研究基于已發表的人卵巢上皮癌及肺腺癌順鉑耐藥基因芯片數據,利用生物信息學方法分析共同差異基因并運用實時熒光定量PCR(qRT-PCR)進行驗證,同時分析差異基因表達對患者預后的影響,旨在篩選出在不同腫瘤細胞順鉑耐藥形成中共同起作用的關鍵基因,為臨床尋找逆轉順鉑耐藥和改善患者預后的新靶標提供理論基礎,現報道如下。
1 材料與方法
1.1基因芯片數據收集 從基因表達數據庫GEO(www.ncbi.nlm.nih.gov/geo)中下載得到ID號為GSE33482的卵巢上皮癌mRNA芯片數據及ID號為GSE108214的肺腺癌mRNA芯片數據,其中GSE33482包含6例人卵巢上皮癌順鉑耐藥細胞株A2780/DDP標本和6例人卵巢上皮癌親本敏感細胞株A2780標本;GSE108214包含5例人肺腺癌順鉑耐藥細胞株A549/DDP標本和4例人肺腺癌親本敏感細胞株A549標本。
1.2方法
1.2.1共同差異基因篩選 將GSE33482和GSE108214中的芯片數據導入R語言(https://www.r-project.org/)軟件中,使用affy包對上述兩個芯片的原始數據進行過濾和標準化處理,并運用Limma包中的經驗貝葉斯方法分別篩選出差異表達基因,篩選閾值設為校正后P<0.05,差異表達倍數|logFC|≥1,然后使用edgeR包繪制差異基因的熱圖。運用VENNY2.1(http://bioinfogp.cnb.csic.es/tools/venny/index.html)在線工具,分別對在卵巢上皮癌及肺腺癌耐藥株中表達均為上調或下調的差異基因取交集得到共同差異基因。下述的生物信息學分析均只對共同差異基因進行分析。
1.2.2共同差異基因富集分析 將共同差異基因分別導入Metascape數據庫(http://metascape.org/gp/index.html)中進行GO功能和KEGG通路富集分析(設定參數:Overlap≥3,Enrichment≥1.5)。通過Fisher Exact Test計算P值,以P<0.05為差異有統計學意義。
1.2.3蛋白質相互作用網絡分析 運用String10.5(https://string-db.org)構建共同差異基因的蛋白相互作用(protein-protein interaction network,PPI)網絡,將最低互作分值設置成高度可信(high confidence=0.7),并將分析結果轉入Cytoscape軟件中進行可視化處理,然后通過軟件中的Network analyzer插件篩選出節點較多的關鍵基因并構建PPI核心網絡。
1.2.4qRT-PCR驗證基因表達 分別收集本實驗室保存的卵巢上皮癌順鉑耐藥細胞株A2780/DDP及親本敏感株A2780與肺腺癌順鉑耐藥細胞株A549/DDP及親本敏感株A549,運用Trizol提取總RNA。按照反轉錄試劑盒(PrimeScriptTMRT reagent Kit with gDNA Eraser,Takara)說明書合成cDNA,然后根據SYBR定量PCR試劑盒(TB GreenTMPremix Ex TaqTM,Takara)操作步驟配制反應體系,在實時熒光定量PCR(RT-qPCR)儀(LightCycler96,Roche)上進行反應。選用甘油醛-3-磷酸脫氫酶(GAPDH)基因作為內參基因,各基因引物序列見表1。分別以A2780及A549中各基因的mRNA表達水平為對照,根據2-△△Ct值計算關鍵差異基因在A2780/DDP及A549/DDP中mRNA的相對表達水平。
1.2.5生存分析 使用Kaplan-Meier Plotter(http://kmplot.com/analysis/)分析關鍵差異基因的表達對卵巢癌和肺腺癌患者生存率的影響,采用Kaplan-Meier法分析并繪制生存曲線,通過Log-rank檢驗法比較生存曲線的差異,以P<0.05為差異有統計學意義。
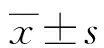
2 結 果
2.1篩選的共同差異基因 在A2780/DDP與A2780之間共篩選得到2 457個在耐藥細胞株中表達上調和1 496個表達下調的差異基因;在A549/DDP與A549之間共篩選得到1 718個在耐藥株細胞中表達上調和1 512個表達下調的差異基因(校正后P<0.05,|logFC|≥1)。差異基因的熱圖見圖1A、B。分別對在兩種耐藥細胞株中表達上調和下調的差異基因取交集,最終得到295個表達上調和176個表達下調的共同差異基因,見圖1C、D。

表1 qRT-PCR引物序列

A:芯片GSE33482差異基因熱圖;B:芯片GSE108214差異基因熱圖;C:表達上調差異基因韋恩圖;D:表達下調差異基因韋恩圖
圖1篩選的共同差異基因熱圖及韋恩圖

表2 共同差異基因的GO功能和KEGG通路富集分析(部分)
2.2共同差異基因的GO功能和KEGG通路富集分析 富集分析結果(P<0.05和FDR<0.05)顯示,在耐藥株中表達上調的共同差異基因主要富集于損傷修復、輔助性T淋巴細胞17(Th17)細胞分化和磷脂酰肌醇-3-激酶/絲蘇氨酸蛋白激酶(PI3K-AKT)信號通路等;表達下調的共同差異基因則主要富集于細胞黏附、軸突導向和細胞因子間受體相互作用等,見表2。
2.3蛋白相互作用網絡分析 蛋白互作分析得到包含273個節點的PPI網絡。其中,PPI核心網絡由相互作用關系較高的10個關鍵基因RIPK4、JUN、PRKCA、JAK1、HSPA1A、HSPB1、PLCB1、GNG4、SHC1和CXCL1構成。PPI核心網絡與其他節點有較多連接,提示上述基因可能起關鍵作用,見圖2。

A:共同差異基因的蛋白互作網絡圖;B:關鍵差異基因核心網絡圖
2.4qRT-PCR檢測結果 運用qRT-PCR驗證10個關鍵差異基因的mRNA表達情況。RIPK4、JUN、PRKCA、JAK1、HSPA1A、PLCB1、GNG4、SHC1基因在A2780/DDP及A549/DDP細胞中的mRNA表達水平均分別高于A2780及A549細胞(P<0.05),CXCL1基因在A2780/DDP及A549/DDP細胞中的mRNA表達水平低于A2780及A549細胞 (P<0.05),與芯片結果一致。但HSPB1在A2780/DDP中的mRNA表達水平卻低于A2780,與芯片數據不一致,見圖3。
2.5生存分析 分析關鍵差異基因RIPK4、JUN、PRKCA、JAK1、HSPA1A、PLCB1、GNG4、SHC1和CXCL1基因的表達水平與卵巢癌和肺腺癌患者生存率之間的關系。僅GNG4和PRKCA基因的表達改變與兩種腫瘤患者的生存率呈負相關(P<0.05),即GNG4和PRKCA高表達患者的生存率均明顯低于低表達患者,見圖4。

A:人卵巢上皮癌順鉑耐藥細胞株A2780/DDP;B:人肺腺癌順鉑耐藥細胞株A549/DDP;a:P<0.05,與A2780比較;b:P<0.01,與A2780比較;c:P<0.05,與A549比較;d:P<0.01,與A549比較

A:GNG4的表達與卵巢癌患者總生存率的Kaplan-Meier曲線;B:PRKCA的表達與卵巢癌患者總生存率的Kaplan-Meier曲線;C:GNG4的表達與肺腺癌患者總生存率的Kaplan-Meier曲線;D:PRKCA的表達與肺腺癌患者總生存率的Kaplan-Meier曲線
3 討 論
卵巢癌與肺癌是嚴重威脅人類生命健康的惡性腫瘤。在過去幾十年里,盡管分子靶向治療等新型治療方案的發展大大提高了患者的生存率,但靶向治療往往存在適用范圍小、治療費用高等問題,因此以鉑類藥物為基礎的傳統化學療法仍然是大多數卵巢癌及肺癌患者最主要的治療手段。而腫瘤細胞順鉑耐藥性的產生,則是導致化療失敗最主要的原因。現有研究顯示,腫瘤細胞對順鉑耐藥的形成是多方面的,包括鉑的聚集、鉑的失活、DNA損傷修復、細胞衰老、凋亡、自噬及上皮間質轉化等,幾乎涵蓋了調節細胞生存的所有方面,且往往是多因素同時存在的,這也是目前缺乏有效逆轉腫瘤細胞對鉑類藥物耐藥的主要原因。研究表明,基因的表達改變是腫瘤細胞耐藥發生的重要基礎,因此,利用基因芯片篩選出與順鉑耐藥相關的關鍵基因,可作為初步闡明順鉑耐藥機制的重要手段。本研究通過GEO數據庫中卵巢上皮癌及肺癌順鉑耐藥與親本敏感細胞株的基因芯片表達數據集篩選得到295個表達上調和176個表達下調的共同差異基因,提示這些基因可能與順鉑耐藥的形成相關。GO與KEGG富集分析結果顯示,共同差異基因主要富集于細胞損傷修復、Th17細胞分化、PI3K-Akt信號通路、細胞黏附、軸突導向和細胞因子間受體相互作用等主要與順鉑耐藥形成相關的DNA損傷修復和細胞凋亡等過程及通路。
本研究通過在線數據庫STRING對共同差異基因進行蛋白互作分析,篩選得到節點較多的10個關鍵基因,其中9個在耐藥株中的表達高于其親本敏感株,分別為RIPK4、JUN、PRKCA、JAK1、HSPA1A、HSPB1、PLCB1、GNG4、SHC1,而CXCL1在耐藥株中的表達則低于敏感株。通過qRT-PCR檢測發現除HSPB1外,其余9個關鍵基因表達情況與芯片結果一致。RIPK4是一個受體相互作用蛋白激酶,研究表明,RIPK4能增強Wnt信號通路從而增強腫瘤細胞的增殖能力并降低腫瘤細胞對順鉑等藥物的敏感性,減少順鉑誘導的細胞凋亡進而導致耐藥[8]。JUN是AP1復合物的重要組成部分且在多種腫瘤細胞中過表達,它可通過不同機制拮抗p53的促凋亡活性,這也可能是高表達JUN導致腫瘤細胞對順鉑敏感性降低的重要原因[9]。PRKCA是蛋白激酶C家族的成員。FU等[10]研究表明,過表達PRKCA可通過激活粘著斑激酶(FAK)和下游信號如Ras和PI3K/AKT導致細胞對順鉑耐藥。JAK1則屬于非受體酪氨酸激酶家族,它的底物為STAT,JAK/STAT通路的持續活化可通過上調抗凋亡基因的表達抑制順鉑誘導的腫瘤細胞凋亡,進而導致細胞耐藥[11]。HSPA1A屬于熱休克蛋白家族,研究者發現它們的表達升高與腫瘤患者的不良預后及對順鉑的抗性相關[12]。PLCB1屬于PLC酶家族,SENGELAUB等[13]研究發現,PLCB1高表達可促進腫瘤細胞的遷移。而GNG4被認為是一個潛在的腫瘤治療靶點,PAL等[14]研究認為其高表達同樣可促進腫瘤細胞的遷移。有關腫瘤細胞遷移與順鉑耐藥形成之間的關系尚未明確,但WACLAW等[15]研究指出,細胞的遷移性可能是影響腫瘤耐藥性的關鍵因素。SHC1在多種腫瘤細胞中發揮致癌作用。AN等[16]研究表明,SHC1的過表達可顯著抑制凋亡,導致腫瘤細胞的持續增殖和耐藥。以上結果初步表明,在耐藥株中高表達的關鍵基因都可能導致順鉑耐藥的產生。而低表達的CXCL1是一個趨化因子,ACHARYYA等[17]發現,阻斷CXCL1的表達能提高化療的有效性,而芯片結果卻顯示,CXCL1在敏感株細胞中的表達明顯高于耐藥株,提示CXCL1在卵巢上皮癌及肺腺癌順鉑耐藥的形成中可能不起主要作用,這也充分說明了順鉑耐藥的形成是一個由多因素、多因子參與的復雜過程。
以上結果表明,在卵巢上皮癌及肺腺癌耐藥細胞株中RIPK4、JUN、PRKCA、JAK1、HSPA1A、PLCB1、GNG4、SHC1基因的高表達可能是其耐藥形成的重要原因。為了探究耐藥相關基因的表達是否影響卵巢癌及肺腺癌患者的生存率,本研究對上述8個耐藥相關基因進行了生存分析,結果顯示,僅PRKCA和GNG4基因的表達與卵巢上皮癌及肺腺癌患者的總生存率呈負相關,表明當靶向PRKCA和GNG4使其表達下調時,不但能提高卵巢上皮癌及肺腺癌對順鉑的敏感性,還能提高患者的生存率,改善患者的預后。而當靶向其他高表達的關鍵基因時,雖具有逆轉順鉑耐藥的潛能,但并不能改善患者的預后。
綜上所述,本研究應用生物信息學方法綜合分析并驗證了卵巢上皮癌與肺腺癌順鉑耐藥的共同差異基因,結果得到了8個關鍵基因RIPK4、JUN、PRKCA、JAK1、HSPA1A、PLCB1、GNG4、SHC1,提示這8個基因可能在多種以順鉑為一線化療藥物的腫瘤耐藥形成中起關鍵作用,為從分子水平更深入探究順鉑耐藥發生、發展的共同機制提供了重要思路。此外,GNG4和PRKCA基因的表達還與提高卵巢癌及肺腺癌患者總生存率密切相關,提示其可能作為逆轉順鉑耐藥和改善患者預后的生物學新靶標。

