骨質疏松小鼠骨組織中miR-21及Smad7的表達及其與骨密度的相關性
鄧純博,劉林,肖正俊,阿良,李洪秋
(沈陽醫學院附屬中心醫院運動創傷骨科,沈陽 110024)
Smad7是轉化生長因子 β / 骨形態發生蛋白(transforming growth factor β/bone morphogenetic protein,TGF-β/BMP) 信號通路內源性負反饋調節因子[1],Smad7與R-Smad蛋 白 結 合 干 擾 拮 抗TGF-β信號,BMP與活化的TGF-β RI和Smad7有協同作用[2]。Smad7也可以通過激活核因子κ β (NF-kappaB inhibitor alpha,NF-κB) 或信號傳導子和轉錄活化子1 (signal transducer and activator of transcription 1,STAT1) 來抑制TGF-β信號[3]。TGF-β/BMP信號在成骨分化及骨形成過程發揮著重要作用[4],前期研究發現,miR-21在骨質疏松患者血漿中表達下降,miR-21可通過調節Smad7促進成骨細胞分化和礦化,因此深入研究miR-21及Smad7的作用機制是有必要的。
通過建立卵巢切除 (ovariectomized,OVX) 鼠模型發現,miR-21可以促進成骨細胞分化,抑制miR-21可減輕雌激素缺乏引起的骨質疏松癥[6-7]。研究[8-10]表明,Smad7蛋白表達改變常導致人類疾病。但是,Smad7在骨質疏松中的具體作用目前沒有報道。Smad7能夠抑制小鼠成骨細胞增殖、分化和礦化[11],部分敲除Smad7基因可調控TGF-β/BMP信號通路進而影響小鼠體內骨形成及礦化[12]。本研究建立鼠骨質疏松動物模型,檢測miR-21/Smad7在骨組織內的表達及其與骨密度的關系,旨在揭示miR-21/Smad7在絕經后骨質疏松中的作用機制。
1 材料與方法
1.1 實驗動物
選取30只12周齡WTC57BL/6J雌性小鼠,體質量18~22 g,由中國醫科大學附屬盛京醫院動物實驗中心提供,分籠飼養,自由攝食飲水。根據不同觀察時間點,將30只小鼠隨機分成6組:切除卵巢組、切除卵巢1周組、切除卵巢2周組、切除卵巢4周組、切除卵巢6周組和切除卵巢8周組,每組5只。
1.2 主要試劑及儀器
戊巴比妥鈉 (上海生工生物工程公司) ,TRIzol Reagent Invitrogen (美國Sigma公司) ,逆轉錄試劑盒 (日本TaKaRa公司) ,real-time PCR試劑盒 (日本TaKaRa公司) ,抗鼠Smad7抗體 (美國Abcom公司) ,兔抗小鼠二抗 (武漢博士德生物工程有限公司) ,Inveon micro-CT系統 (德國 Siemens AG公司) ,組織切片機 (德國Leica公司) ,熒光顯微鏡 (德國 Leica公司) ,二氧化碳恒溫孵箱 (美國Forma公司) ,離心機(日本Kubota公司) ,倒置相差顯微鏡及照相系統 (日本Olympas公司) ,分光光度儀 (德國 Eppendorf公司) ,雙能X線骨密度儀 (美國Hologic公司) 。
1.3 實驗方法
1.3.1 OVX小鼠骨質疏松模型:所用小鼠經腹腔注射1%戊巴比妥鈉 (0.1 mL/100 g) ,待小鼠完全麻醉后,取俯臥位手術。在雙側第3腰椎背側正中做一約0.5 cm切口,鈍性分離,剪開腹膜后用組織鑷探入切口,找到卵巢,將其從靠近輸卵管端結扎,眼科剪剪除,隨后將剩余組織還納腹腔,縫合切口。將30只小鼠按觀察時間點分為:切除卵巢0周組、切除卵巢1周組、切除卵巢2周組、切除卵巢4周組、切除卵巢6周組和切除卵巢8周組。
1.3.2 取材:在OVX后不同觀察時間點將行骨密度測定的小鼠頸椎脫臼處死,用手術剪從髖關節及膝關節離斷分離雙側股骨,去除肌肉和筋膜。每只小鼠的雙側股骨進行骨密度檢測,將行骨密度的股骨隨機取一側股骨行免疫組化染色,另一側股骨行miR-21和Smad-7mRNA含量檢測[5]。
1.4 主要觀察指標
1.4.1 小鼠骨密度測定:在OVX后不同觀察時間點,使用雙能X線骨密度儀并應用小動物骨密度測定軟件,對小鼠雙側股骨遠端行骨密度檢測。
1.4.2 免疫組織化學染色:將OVX后不同觀察時間點小鼠隨機選取的一側股骨于4%中性甲醛浸泡固定;4 ℃過夜,15% 中性 EDTA-2Na 脫鈣4周,經梯度脫水、石蠟包埋后作厚 5 μ m 切片。應用Smad7免疫組化試劑盒按說明測定Smad7在骨組織內的表達。
1.4.3 實時PCR檢測:將OVX后不同時間的另一側小鼠股骨干骺端在液氮中研磨成干粉狀,按照TRIZOL說明書進行操作,從股骨遠端取樣提取RNA,進行RNA質量和濃度檢測后逆轉錄合成cDNA。參考早期研究行股骨骨組織中miR-21和Smad-7的mRNA測定,miRNAs表達含量計算方法為2-ΔΔCt相對定量法。
1.5 統計學分析
所有計量資料以表示,應用SPSS 22.0軟件對數據進行單因素方差分析,應用Pearson相關系數分析miR-21、Smad-7與骨密度的相關性,P< 0.05為差異有統計學意義。
2 結果
2.1 Smad7在骨質疏松小鼠骨組織中的表達水平
通過免疫組化染色檢測Smad7在骨組織中的表達水平,隨著卵巢切除的時間逐漸增加,Smad7的表達逐漸增強,見圖1。
2.2 miR-21及Smad7在骨質疏松小鼠骨內表達水平
通過實時PCR檢測miR-21及Smad7在骨組織RNA表達水平,隨著卵巢切除的時間逐漸增加,miR-21的表達逐漸降低,組間差異有統計學意義,而隨著卵巢切除的時間逐漸增加,Smad7的表達逐漸增強,組間有統計學差異,見表1。
2.3 小鼠骨質疏松模型的骨密度變化情況
通過檢測計算小鼠股骨的骨密度值發現,隨著時間的推移,去勢后小鼠的骨密度逐漸下降,第4、6、8周組與0周組有統計學差異 (P< 0.05) ,見表1。
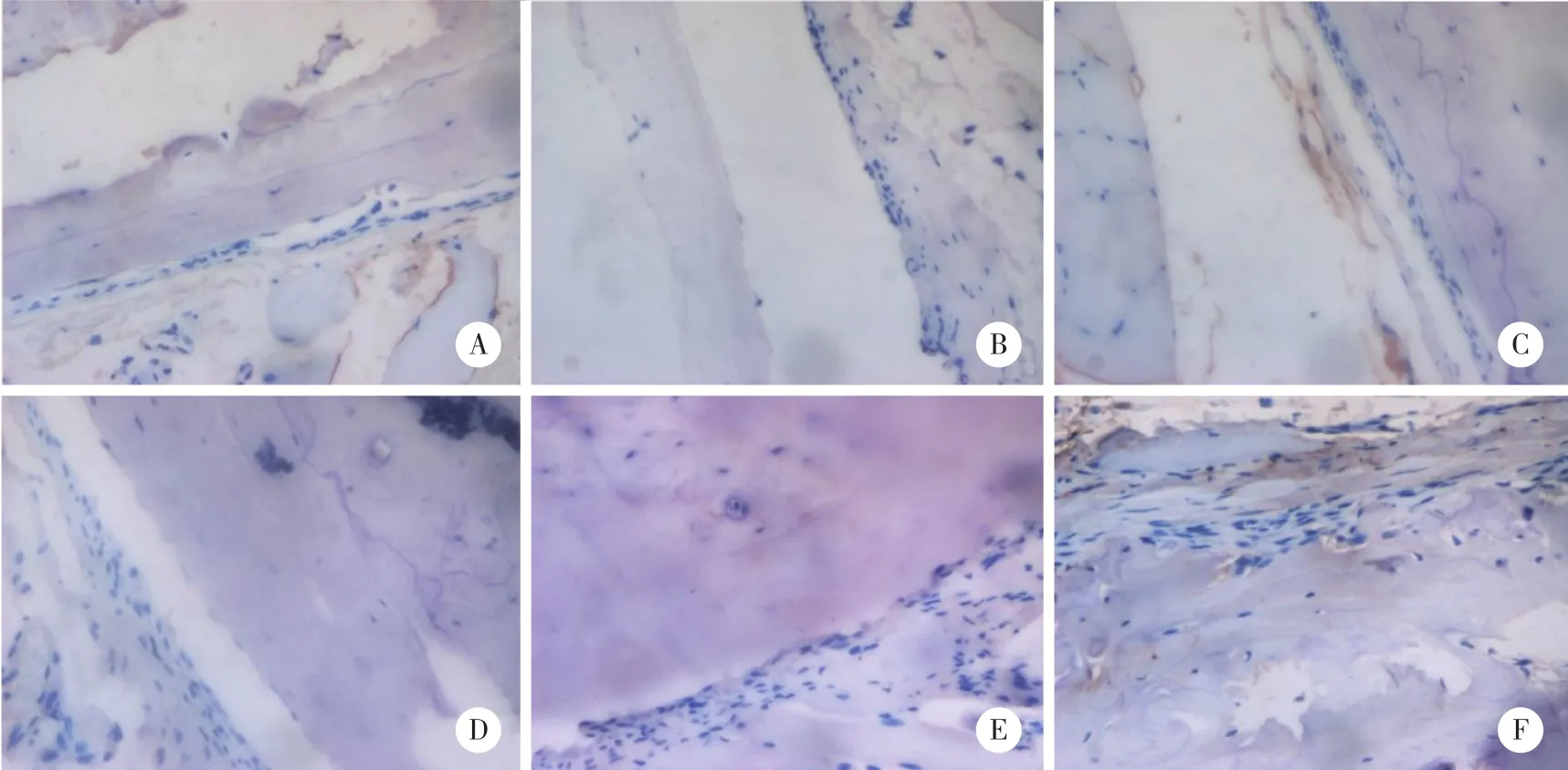
圖1 骨質疏松小鼠OVX后不同時間點Smad7的表達情況 ×200Fig.1 Expression levels of Smad7 in osteoporotic mice at different time points after OVX × 200
2.4 miR-21及Smad7與骨質疏松鼠骨骨密度相關性
通過檢測鼠骨密度值并與miRNA-21、Smad7進行相關分析發現,miR-21與骨密度值呈正相關 (r=0.866,P< 0.01) ,Smad7與骨密度值呈負相關 (r=-0.867,P< 0.01) 。
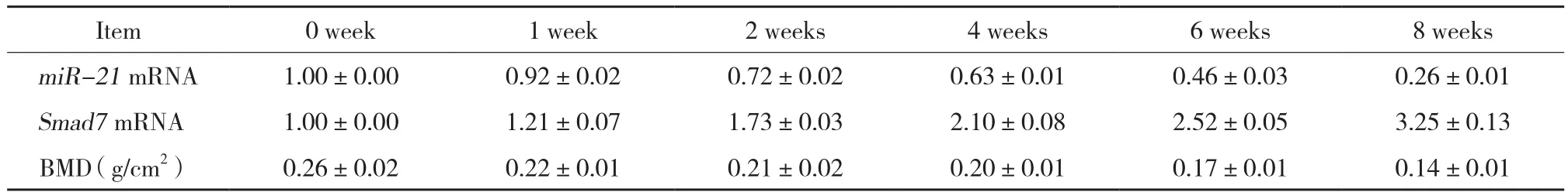
表1 OVX后不同時間點骨質疏松小鼠骨組織miR-21、Smad7 mRNA表達及骨密度變化Tab.1 Expression levels of miR-21 and Smad7 mRNA and change in bone mineral density in the bone tissue of osteoporotic mice at different time points after OVX
3 討論
微小RNA ( microRNAs,miRNAs) 在骨形成的構成中發揮重要作用,miR-29家族是調控骨重建代表性的miRNA[13]。miR-214升高的水平與年齡相關的骨折標本中骨形成較低有關,miR-214的抑制對骨的形成有著至關重要的作用[14]。miR-218增強了成骨相關轉錄因子的骨特異性活性衰減,干擾了正常骨沉積和重塑[15]。觀察miR-206的轉基因鼠發現,轉基因小鼠的骨小梁間隙較大,骨量較低、骨形成率下降,miR-206是成骨分化的抑制因子[16]。miR-21在破骨細胞分化過程中高度表達,這表明它在破骨發生中起重要作用[17]。在破骨細胞誘導miR-21的拮抗雌激素,能夠抑制骨吸收,通常會降低雌激素在破骨細胞中miR-21的表達。核因子κ B受體活化因子配體 (receptor activator of nuclear factor-κ B ligand,RANKL) 通過誘導miR-21來下調程序性細胞死亡基因4 (programmed cell death gene 4,PDCD4) 蛋白水平,PDCD4表達減弱反過來會刪除c-Fos的壓制,允許破骨發生。隨后確保初始RANKL信號延續c-Fos的依賴性,激活miR-21將減少PDCD4水平[18]。本研究表明,miR-21在骨質疏松鼠骨組織內表達下降,并與小鼠骨密度呈正相關,這與早期的研究[19]結果一致,miR-21在骨質疏松和骨量減少組內表達上升,且髖部和脊柱的骨密度值呈正相關。miR-21可能在絕經后骨質疏松中發揮著抑制骨形成或促進骨吸收的重要作用。
Smad7是TGF-β/Smad蛋白活動信號通路的重要成員,抑制或調節多種細胞過程,如細胞增殖、分化、凋亡、黏附和遷移[20-21],也參與疾病的病理過程[22-24]。本研究顯示,Smad7在骨質疏松鼠骨組織內表達逐漸升高,Smad7可能通過調節成骨與破骨細胞來參與骨重塑,Smad7的本身也可能通過這兩個過程調節絕經后骨質疏松,是治療絕經后骨質疏松的新機制。早期的研究表明,miR-21可通過調節Smad7促進體外成骨細胞分化和礦化,然而,miR-21是否在體內通過調節Smad7在絕經后骨質疏松中發揮作用還沒有文獻報道。本研究結果預示在絕經后骨質疏松骨組織中miR-21可能通過調控Smad7發揮著抑制骨形成或促進骨吸收的作用。
本研究未進行體內轉染或基因敲出,只能說明現象而不能闡明作用機制,miR-21通過調控Smad7在骨質疏松骨形成、骨吸收、骨折愈合以及可能的藥物干預的機制方面還需進一步研究。

