乳酸菌胞外多糖對水稻生長及土壤理化性質的影響
張文平,王 清,黃詩宸,吳佩佳,程 新
(江西農業大學 生物科學與工程學院,江西 南昌 330045)
近年來,為追求高產高效,農業生產上大量使用農藥化肥的生產方式導致土壤生態環境急劇惡化,土壤板結等現象日益嚴重。將微生物及其代謝產物作用于農作物,對于提高農作物的生長特性及改善農業生態環境有重要意義[1]。現有報道表明,分離自土壤、根際、植物內部等來源的功能性微生物不僅有固氮、解磷、改善土壤結構、拮抗植物病原菌等作用,而且菌體分泌的植物激素、多糖等次級代謝產物還能起到促進植物生長的良好效果[2]。
微生物多糖是一種新型植物調節劑,具有促進作物生長和提高植物抗逆性等特性。Sandhya等[3]發現,接種高產胞外多糖的惡臭假單胞菌(PseudomonasputidaGAP-P45)對干旱脅迫條件下向日葵幼苗的存活率、生物量、根冠比等指標均有顯著的提高作用;閆亞南[4]的研究發現,高產胞外多糖的植物促生菌(Rhizobiumsp. W33)對小麥生長有很好的促進作用,且以對根部生長的促進作用尤為明顯,同時,土壤中脲酶及蔗糖酶活性也得到了顯著提高;Xu等[5]研究發現,藍藻多糖可以顯著提高灌木檸條(CaraganakorshinskiiKom)種子的發芽率及幼苗代謝活性,同時通過清除活性氧、提高抗氧化酶活性等方式減少植物的氧化損傷,具有恢復荒漠地區生態系統的潛在能力;馬曉穎等[6]發現,不同來源的微生物多糖均對玉米生長有一定的促生及誘導抗逆性效果,以真菌多糖的效果最好。
綜合近年來的研究結果,微生物多糖對作物生長具有一定的促進效果,這一點與葡萄糖等單糖的作用類似,但關于多糖與單糖在促進作物生長的機理上是否存在差異這一點,在本研究檢索范圍內尚未見報道。本研究以水稻為試驗對象,探討乳酸菌胞外多糖對水稻幼苗生長的影響,并通過土壤農化分析及酶學測定等方式研究微生物多糖與葡萄糖對水稻生長促進作用機理的異同,為微生物多糖應用于農業生產提供理論與實踐依據。
1 材料與方法
1.1 材料
1.1.1 試驗材料
供試菌株為植物乳桿菌(Lactobacillusplantarum),江西農業大學微生物資源開發與利用實驗室保藏。水稻品種為準兩優608。供試土壤為紅壤,取自江西農業大學生物科學與工程學院實訓基地。土壤有機質含量27.31 g·kg-1,堿解氮含量22.81 mg·kg-1,有效磷含量1.63 mg·kg-1,速效鉀含量76.88 mg·kg-1,pH 5.80。
1.1.2 培養基的配制
改良乳酸細菌培養基(MRS):蛋白胨10.0 g、牛肉膏10.0 g、酵母膏5.0 g、蔗糖20.0 g、乙酸鈉5.0 g、檸檬酸氫二銨2.0 g、K2HPO4·3H2O 2.0 g、MgSO4·7H2O 0.2 g、MnSO4·H2O 0.05 g、吐溫-80(聚山梨酯-80) 1 mL,加蒸餾水至1 000 mL,pH 6.8,121 ℃滅菌20 min[7]。
1.1.3 胞外多糖的提取
將活化的植物乳桿菌接種于改良的MRS,37 ℃發酵24 h。參照Rimada等[8]的方法提取胞外多糖。
1.2 試驗設計
試驗于2017年7月10日在江西農業大學生物科學與工程學院實訓基地進行。將不同濃度的多糖溶液施用于裝有2 kg過20目篩菜園土的育秧盤(規格:57.5 cm×27.5 cm×2.5 cm)中,混勻,水稻種子經消毒、浸種、催芽后,挑選大小一致的水稻種子播種于育秧盤,每盤200粒,播種方式為旱育秧。鋪上一層過0.25 mm篩的細土,定期定量澆水,保持土壤濕潤不見明水狀態。設置葡萄糖和蒸餾水作為對照。根據前期試驗基礎,設置多糖濃度為100、1 000 mg·L-1。共設5個處理,分別是施加蒸餾水的空白處理(CK),施加100 mg·L-1胞外多糖的處理(E1),施加1 000 mg·L-1胞外多糖的處理(E2),施加100 mg·L-1葡萄糖的處理(G1),施加1 000 mg·L-1葡萄糖的處理(G2)。每處理設置3次重復。
1.3 測定項目與方法
1.3.1 形態指標
在播種后第15天、第30天時隨機取樣,測定水稻的形態指標,包括株高、葉長、葉鞘、根長、根體積等形態指標:株高為莖基部至第二長葉葉尖的長度;葉長為第二片葉的長度;葉寬為第三片葉的寬度;葉鞘為包圍著莖基部呈鞘狀的長度;根長為主根長度。根體積:取20株洗凈的秧苗根系完全浸入事先裝好3 mL清水的5 mL量筒,上升的刻度數即為20株秧苗根系的總體積。
1.3.2 土壤理化性質
分別于播種后第15、30天取水稻根際土測定土壤理化性質。采用濕篩法測定水穩性土壤團聚體比例[9-10];土壤pH、有機質、堿解氮、有效磷、速效鉀等指標參照鮑士旦主編的《土壤農化分析》[11]測定;土壤脲酶活性采用苯酚-次氯酸鈉比色法測定;蔗糖酶活性采用3,5-二硝基水楊酸比色法測定;酸性磷酸酶活性采用磷酸苯二鈉比色法測定[12];過氧化氫酶活性采用紫外分光光度法測定[13]。
1.4 統計分析
試驗結果采用DPS 7.5進行單因素方差分析,對有顯著(P<0.05)差異的處理采用Duncan法進行多重比較。采用SIMCA-P 13.0軟件進行主成分分析(principle component analysis, PCA)。采用Origin 8.1制圖。
2 結果與分析
2.1 對水稻秧苗生物學性狀的影響
與空白組(CK)相比,在土壤中添加不同濃度的乳酸菌多糖對水稻幼苗生長有顯著(P<0.05)的促進作用(表1)。生長15 d,添加100 mg·L-1乳酸菌多糖的處理組(E1)水稻幼苗的株高、葉長、葉鞘、根長、根體積分別比CK提高了24.77%、15.83%、37.57%、17.76%、31.82%,但其促進效果略遜于同等劑量的葡萄糖處理。當幼苗生長30 d,2個乳酸菌多糖處理(E1、E2)與低濃度葡萄糖處理(G1)對水稻幼苗的促進效果基本相當,而高濃度葡萄糖處理(G2)對水稻幼苗部分指標(株高、葉長等)相較CK反而有一定的抑制效果。
2.2 對土壤結構及理化性質的影響
幼苗生長至15 d時,添加不同濃度的乳酸菌多糖和葡萄糖對土壤pH均無顯著影響,但在30 d時,添加乳酸菌多糖可以顯著(P<0.05)提高土壤的pH,而葡萄糖并無類似效果。添加不同濃度乳酸菌多糖和葡萄糖后,土壤有機質含量均有提高,特別是30 d時低濃度的糖(E1、G1)效果最為明顯。不同濃度的乳酸菌多糖和葡萄糖處理均可以顯著(P<0.05)提高土壤中堿解氮含量,1 000 mg·L-1乳酸菌多糖處理還能顯著(P<0.05)提高土壤速效鉀含量,但各處理對土壤有效磷含量無顯著作用。
土壤團聚體是評價土壤肥力的重要指標。由圖1可知,添加乳酸菌多糖可以提高水穩性土壤團聚體比例,隨著乳酸菌多糖濃度增加,水穩性土壤團聚體的比例亦提高。15 d時,添加1 000 mg·L-1乳酸菌多糖處理(E2)的土壤中水穩性土壤團聚體比例較CK顯著(P<0.05)提高了39.74%,但外源添加葡萄糖處理(G1、G2)對水穩性土壤團聚體作用不顯著。第30天與第15天相比,添加乳酸菌多糖的處理組土壤團聚體比例有所下降,但與空白組相比仍有顯著性差異。
表1不同處理對水稻秧苗生物學性狀的影響
Table1Effect of different treatments on biological traits of rice seedling

t/d處理Treatment株高Plant height/cm葉長Leaf length/cm葉鞘Leaf sheath/cm根長Root length/cm根體積Root volume/mL15CK10.94±1.20 c9.79±1.41 c3.38±0.18 d7.77±1.26 c0.22±0.01 dE113.65±1.15 a11.34±1.28 b4.65±0.28 c9.15±0.59 b0.29±0.02 cE212.61±0.89 b11.08±0.96 b4.55±0.32 c9.07±0.44 b0.41±0.02 aG114.34±1.25 a12.83±1.60 a5.89±0.50 a9.31±0.83 b0.36±0.06 bG212.71±1.76 b10.90±1.83 b5.06±0.29 b11.50±0.37 a0.35±0.05 b30CK16.59±1.09 b11.55±0.77 c5.88±0.49 d10.44±1.27 d0.57±0.03 cE117.62±1.34 a12.87±1.46 b6.14±0.18 bc12.57±0.31 c0.73±0.06 bE218.47±1.03 a12.75±1.38 b6.38±0.35 ab12.87±0.64 bc0.79±0.04 aG118.29±1.64 a14.11±0.83 a6.47±0.35 a13.30±0.57 b0.77±0.04 aG215.10±0.95 c10.94±0.46 c6.10±0.25 cd13.93±0.62 a0.77±0.05 a
同一處理時間內同列數據后無相同字母的表示差異顯著(P<0.05)。下同。
Data marked without the same letters in the same column of the same treatment time indicated significant difference atP<0.05. The same as below.
表2不同處理對土壤理化性質的影響
Table2Effect of different treatments on soil physicochemical properties

t/d處理TreatmentpH有機質Organic matter/(g·kg-1)堿解氮Alkali hydrolysablenitrogen/(mg·kg-1)有效磷Available phosphorus/(mg·kg-1)速效鉀Available potassi-um/(mg·kg-1)15CK5.40±0.02 a26.27±4.15 b15.21±0.18 e2.08±0.13 a52.02±2.07 cE16.08±0.33 a33.06±4.15 ab19.01±0.22 d2.00±0.20 a69.57±2.07 bE26.55±1.29 a35.78±4.15 a22.81±0.26 c2.29±0.35 a84.19±6.20 aG15.86±0.40 a30.35±4.15 ab26.61±0.31 a2.68±0.58 a56.41±4.14 cG26.04±1.07 a34.42±4.15 a23.57±0.27 b2.11±0.52 a53.48±4.14 c30CK5.43±0.23 c20.83±4.15 c15.97±0.18 e1.86±0.09 ab37.40±2.07 bE16.64±0.29 a42.57±4.15 a22.81±0.26 c2.35±0.33 a41.78±4.14 bE26.15±0.30 b28.99±4.15 b26.61±0.31 a2.06±0.59 ab69.57±6.20 aG15.34±0.09 c42.57±4.15 a20.53±0.24 d2.11±0.14 ab40.32±2.07 bG25.52±0.11 c35.78±4.15 ab23.57±0.27 b1.54±0.48 b41.78±4.14 b

同一處理時間內不同處理間沒有相同小寫字母的表示差異顯著(P<0.05)。下同。The bars without the same lowercase letters in the same treatment time indicated significant difference at P<0.05. The same as below.圖1 不同處理對水穩性土壤團聚體的影響Fig.1 Effect of different treatments on proportion of water-stable soil aggregate
2.3 對土壤酶活的影響
添加乳酸菌多糖可以顯著(P<0.05)提高土壤脲酶及土壤酸性磷酸酶活性(圖2),隨著乳酸菌多糖濃度升高,土壤脲酶及酸性磷酸酶活性均呈上升趨勢,與CK相比,添加1 000 mg·L-1乳酸菌多糖的處理組(E2),在第15天和第30天土壤脲酶活性分別提高了23.70%和29.66%,土壤酸性磷酸酶活性分別提高了26.17%和28.10%。添加葡萄糖對土壤脲酶的促進效果不及乳酸菌多糖,但對土壤酸性磷酸酶活性的促進效果更明顯。
處理15 d,與CK相比,除E1外,其余處理的土壤蔗糖酶與CK無顯著差異,但各處理對土壤過氧化氫酶活性均有顯著(P<0.05)促進作用。處理30 d時,添加乳酸菌多糖的處理可以顯著(P<0.05)提高土壤蔗糖酶及過氧化氫酶活性,隨著乳酸菌多糖濃度增加,蔗糖酶及過氧化氫酶活性有所下降。與CK相比,添加100 mg·L-1乳酸菌多糖的處理組(E1)中,土壤蔗糖酶及過氧化氫酶活性分別提高了28.89%、68.19%,添加葡萄糖的處理(E1、E2)對于土壤蔗糖酶活性有一定的促進效果,但對土壤過氧化氫酶活性則表現出抑制作用。
添加乳酸菌多糖和葡萄糖均會對土壤酶活性產生較大影響,但影響效果有異,說明二者的作用機理可能并不相同。
2.4 水稻生理指標與環境因子的相關性分析
由表3可知,水稻株高與葉長、有效磷、脲酶指標存在顯著(P<0.05)相關性,相關系數分別為0.89、0.82和0.85;根長與根體積、酸性磷酸酶有極顯著(P<0.01)相關性,相關系數分別達到0.93和0.95;根體積與堿解氮、酸性磷酸酶的相關系數分別為0.88、0.86,呈顯著(P<0.05)相關性;土壤pH與土壤蔗糖酶、過氧化氫酶顯著(P<0.05)相關,土壤有效磷和脲酶、過氧化氫酶均表現出顯著(P<0.05)相關性。以上結果說明,土壤理化及酶學指標與水稻植株生長間存在緊密的關聯性,需要做更進一步的分析。
2.5 水稻生理指標與環境因子的主成分分析
主成分分析是將多個變量通過線性變換選出較少個數重要變量的一種降維的多元統計分析方法,可以去除不重要的信息,保留所需要的重要信息[14]。對第15天及第30天所測定的試驗指標進行主成分分析,結果如表4和表5所示。
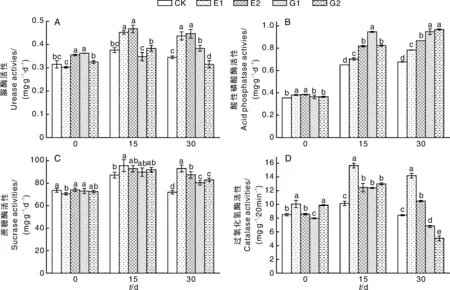
圖2 不同處理對土壤酶活的影響Fig.2 Effect of different treatments on soil enzymes activities
表3各水稻生理指標及土壤環境因子的相關性
Table3Correlation of physiological indexes of rice and soil environmental factors

指標PLLLLSRLRVWSApHOMAhnAphApoUASAApaCAIndexPL1LL0.89*1LS0.690.791RL-0.050.180.651RV0.250.350.810.93**1WSA0.580.300.47-0.120.151pH0.350.160.080.060.25-0.181OM0.210.550.570.710.63-0.460.281Ahn0.220.120.590.730.88*0.210.540.361Aph0.82*0.780.39-0.140.070.050.660.410.111Apo0.490.150.500.220.520.740.40-0.200.760.161UA0.85*0.630.520.010.340.360.780.230.510.86*0.631SA0.310.280.420.550.67-0.210.87*0.620.800.520.420.681Apa-0.060.200.680.95**0.86*0.04-0.240.590.58-0.290.17-0.150.281CA0.530.320-0.28-0.06-0.100.91*0.150.210.84*0.250.82*0.63-0.531
PL,株高;LL,葉長;LS,葉鞘;RL,根長;RV,根體積;WSA,土壤團聚體;OM,有機質;Ahn,堿解氮;Aph,有效磷;Apo,速效鉀;UA,脲酶;SA,蔗糖酶;Apa,酸性磷酸酶;CA,過氧化氫酶。下同。*,**分別表示相關性達顯著(P<0.05)或極顯著(P<0.01)水平。
PL, Plant height; LL, Leaf length; LS, Leaf sheath; RL, Root length; RV, Root volume; WSA, Water-stable soil aggregate; OM, Organic matter; Ahn, Alkali hydrolysable nitrogen; Aph, Available phosphorus; Apo, Available potassium; UA, Urease activities; SA, Sucrase activities; Apa, Acid phosphatase activities; CA, Catalase activities. The same as below. *, ** represented significant correlation atP<0.05 orP<0.01, respectively.
當水稻生長至15 d時:決定第一主成分(PC1)的主要有株高、葉鞘、根體積、堿解氮等指標,反映了原始數據48.45%的信息;決定第二主成分(PC2)的主要有脲酶、蔗糖酶、有效磷、速效鉀等指標,前2個主成分的累計貢獻率為78.27%;決定第三主成分(PC3)的主要有水穩性土壤團聚體比例、根長和過氧化氫酶等指標,前3個主成分的累計貢獻率為91.67%。當水稻幼苗生長至30 d時:決定第一主成分的主要有脲酶、蔗糖酶、葉鞘等指標,反映了原始數據44.31%的信息;決定第二主成分的主要有酸性磷酸酶、過氧化氫酶、根長,前2個主成分的累計貢獻率為70.96%;決定第三主成分的指標為水穩性土壤團聚體比例,前3個主成分的累計貢獻率為87.26%。
表4各指標主成分分析
Table4Principal component analysis of each index

項目Item第15天 15th dayPC1PC2PC3第30天 30th dayPC1PC2PC3特征值Eigen value7.274.472.016.654.002.44方差Variance/%48.4529.8213.3944.3126.6616.29累計貢獻率Cumulative/%48.4578.2791.6744.3170.9687.26
表5各指標主成分分析旋轉后的成分載荷矩陣
Table5Rotated component matrix of principal component analysis of each index

指標Index第15天 15th dayPC1PC2PC3第30天 30th dayPC1PC2PC3PL0.310.130.130.28-0.22-0.28LL0.290.23-0.040.27-0.09-0.16LS0.310.250.110.370.17-0.24RL0.200.090.450.210.410.12RV0.34-0.01-0.170.300.310.00WSA0.16-0.27-0.490.10-0.05-0.60pH0.30-0.24-0.080.25-0.240.31OM0.30-0.210.130.230.180.32Ahn0.320.23-0.040.300.180.03Aph0.190.32-0.370.26-0.320.08Apo0.20-0.35-0.280.24-0.02-0.32UA0.10-0.45-0.050.33-0.26-0.05SA0.23-0.310.270.320.000.38Apa0.290.28-0.130.150.46-0.03CA0.21-0.190.410.20-0.390.22
從圖3能夠直觀地看出,當水稻幼苗生長至15 d時,CK落在第三區間,E1、E2都落在第一區間,G1、G2落在第四區間,與E1、E2差異明顯。當培養至30 d時,葡萄糖處理(G1、G2)有明顯向左移動的趨勢,G2處理組已移至第三區間,而E1、E2仍落在第一區間,與單糖處理的差異更加明顯。上述結果說明,葡萄糖和多糖均影響水稻的生長及土壤性質,但其作用方式有較大區別。
3 討論
添加外源糖類物質已成為促進作物生長、提高作物品質的有效途徑[15]。據現有文獻報道,多糖和單糖的添加對作物生長均具有較好的促進作用[16-20],但關于多糖與單糖促進作物生長機理的差異研究則鮮見報道。根據現有報道,單糖對水稻的促進效果更多地表現為作為營養物質被植物直接吸收利用或者加速土壤微生物的生長,進而促進植物的快速生長[21],這在某種程度上也解釋了本研究中葡萄糖的促進效果作用時間較短,且短期內葡萄糖的促進效果略微好于多糖這一現象。多糖對植物生長促進作用的機理研究目前尚不多見,從本研究結果可以看出,盡管短期內多糖對作物生長的促進效果較葡萄糖略差,但隨著生長時間延長,兩者之間的差異逐漸縮小,表明乳酸菌多糖的添加可以持續性地促進水稻生長,同時對土壤團聚體、pH等土壤理化性質亦有極大影響,這與艾雪[22]的研究結果一致。添加相同濃度的葡萄糖處理對前述指標作用并不明顯,說明兩者的作用機理并不相同,后續的PCA分析結果也證明了這一點。

圖3 第15天(A)和第30天(B)5個處理的主成分分析得分圖Fig.3 Principal component analysis score chart for 5 treatments on 15th day (A) and 30th day
土壤是作物生長的環境基礎,對作物生長起著至關重要的作用。水稻是喜微酸的作物,但土壤的過度酸化對其種子萌發及幼苗生長均會產生不利的效果[23-24],這一點在南方紅壤地區表現得更加明顯。本研究表明,添加乳酸菌多糖可以有效提高土壤pH。隨著乳酸菌多糖濃度的增加,其土壤pH有逐步升高的趨勢,而且隨著時間延長,乳酸菌多糖對提升土壤pH的效果更加明顯。然而,添加葡萄糖對土壤pH并無顯著影響。這與崔文明[25]的試驗結果并不一致,說明不同類型的土壤可能會對試驗結果有較大影響。土壤酶活是土壤生物學活性的重要組成部分,也是反映土壤生物化學動向和強度的重要指標[26-27]。本研究發現,添加乳酸菌多糖可以提高土壤脲酶、蔗糖酶、酸性磷酸酶、過氧化氫酶等酶活,與孫姍姍[28]利用3種外源糖處理玉米種子顯著提高根際土壤酶活、改善土壤環境、促進作物生長的研究結果類似。然而添加葡萄糖對脲酶、蔗糖酶活性均無顯著效果,對過氧化氫酶活性甚至還有一定的抑制作用。綜合上述結果,在本試驗條件下,微生物多糖對土壤理化性質的改善效果更明顯。
綜合本研究結果,在土壤中添加一定濃度的乳酸菌胞外多糖可以有效促進水稻幼苗的生長,改善土壤結構,提高土壤酶活。但微生物多糖與葡萄糖對作物生長和土壤特性的影響效果并不一致,說明兩者之間的作用機理可能存在較大差異,需要進一步分析。

