急性主動脈夾層患者中性粒細胞/淋巴細胞比值與院內死亡的相關性研究
嚴賴莎 趙順英 胡曉燕
隨著臨床診斷水平的提高,急性主動脈夾層(acute aortic dissection,AAD)已變得越來越常見,流行病學調查顯示其年發病率為3~4/10萬[1]。AAD起病急驟,變化兇險,致死率高[2],因此需要一個快速準確的死亡風險評價指標,用于對AAD患者的預后進行估測,從而作出分層處理,以降低病死率。中性粒細胞/淋巴細胞比值(neutrophil/lymphocyte ratio,NLR)作為一個新的炎癥標志物,與心血管疾病的發生、發展密切相關,檢測快速,價格低廉。筆者探討了AAD患者NLR與院內死亡的相關性作了探討,以期為臨床診治AAD提供參考,現將結果報道如下。
1 資料和方法
1.1 一般資料 2015年3月至2017年8月收住我院胸外監護病房,由CT血管造影確診的AAD患者220例,男 170例,女 50例,平均年齡(57.27±11.23)歲。排除標準:年齡<18歲;入院前有急/慢性感染證據;無血常規資料;有血液系統疾病;近期服用過激素或免疫抑制劑。所有患者均簽署醫學研究知情同意書。
1.2 方法 收集并整理患者的臨床資料,記錄年齡、性別、糖尿病、高血壓、冠心病病史,入院時收縮壓及心率、AAD類型。所有患者入院時即時采血10ml,進行D-二聚體、C 反應蛋白(CRP)、中性粒細胞計數(NE)、淋巴細胞計數(LY)檢測,計算NLR。患者住院期間主要終點事件為死亡,記錄發病到死亡時間、死亡原因。
1.3 統計學處理 采用SPSS 24.0統計軟件。正態分布的計量資料以表示,兩組間比較采用兩獨立樣本t檢驗,多組間比較采用方差分析,兩兩比較采用LSD-t檢驗;計數資料組間比較采用χ2檢驗;相關性分析采用Spearman相關;危險因素分析采用單因素與多因素logistic回歸。P<0.05為差異有統計學意義。
2 結果
2.1 一般資料 220例患者中DebakeyⅠ型102例,DebakeyⅡ型12例,DebakeyⅢ型106例。實施手術治療104例(47.3%),其中A型39例,手術方式包括升主動脈置換、全弓或半弓、降主動脈者可行象鼻手術,累及主動脈瓣者同時行主動脈置換術,B型65例,擇期行支架植入術。死亡40例(18.2%),其中入院48h內死亡28例(70.0%),48h以上死亡 12例(30.0%);因夾層引發的多臟器功能衰竭2例(5.0%),夾層破裂38例(95.0%)。2.2 不同NLR水平AAD患者臨床特征的比較 220例患者按照NLR水平分為4組,分別為第1組四分位數NLR<3.07,第2組四分位數NLR 3.07~5.11,第3組四分位數NRL 5.12~7.04,第4組四分位數NLR>7.04,每組55例。各組間CRP、D-二聚體水平差異有統計學意義(P<0.05),以上參數隨NLR水平的增長呈上升趨勢,而性別、年齡、高血壓、糖尿病、冠心病病史、收縮壓、心率組間比較均無統計學差異(均P>0.05),見表1。
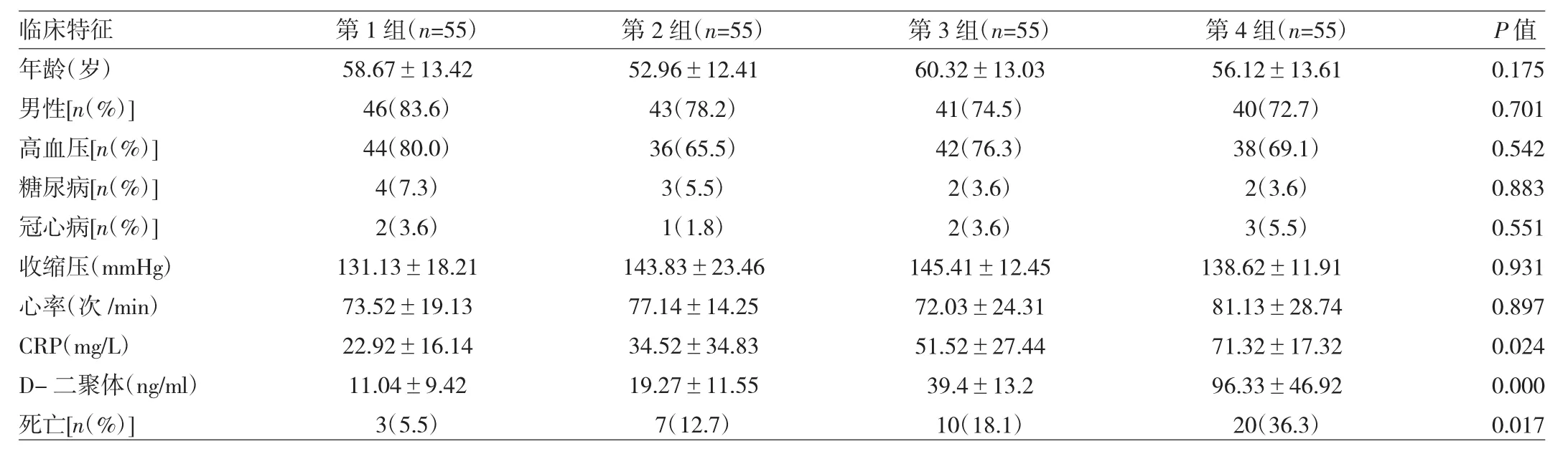
表1 不同NLR水平組患者臨床資料比較
NLR與住院病死率行Spearman相關性分析,結果發現呈正相關(r=0.397,P=0.002)。隨著NLR水平的升高,病死率明顯上升,組間比較差異有統計學意義,且第4組四分位數的病死率高于其他組,差異有統計學意義。2.3 影響AAD住院期間死亡的單因素及多因素相關分析 將所有患者分為死亡組和存活組,首先應用單因素回歸分析性別、年齡、高血壓、糖尿病、冠心病、D-二聚體等危險因素,分析結果顯示兩組之間有統計學差異的因素有NLR、CRP、D-二聚體(表2)。以篩選出的上述因素作為自變量,患者住院期間是否死亡作為因變量行logistic多因素回歸分析,結果顯示AAD患者住院期間死亡危險因素為NLR、CRP、D-二聚體(表3)。
3 討論
AAD是由于主動脈內膜撕裂后,血液進入主動脈的中層導致。夾層沿著長軸迅速擴展,常累及分支血管和主動脈瓣,出現重要臟器缺血、主動脈瓣關閉不全等多種并發癥,甚至夾層破裂導致死亡,是致命的心血管疾病之一。近17年來,隨著外科手術及圍術期管理的改進,A型AAD住院病死率較前有所下降,但仍有22%的患者在住院期間死亡,B型AAD住院病死率也可達12%~14%[3]。早期評估AAD患者的預后情況,對降低其病死率有重要臨床意義。
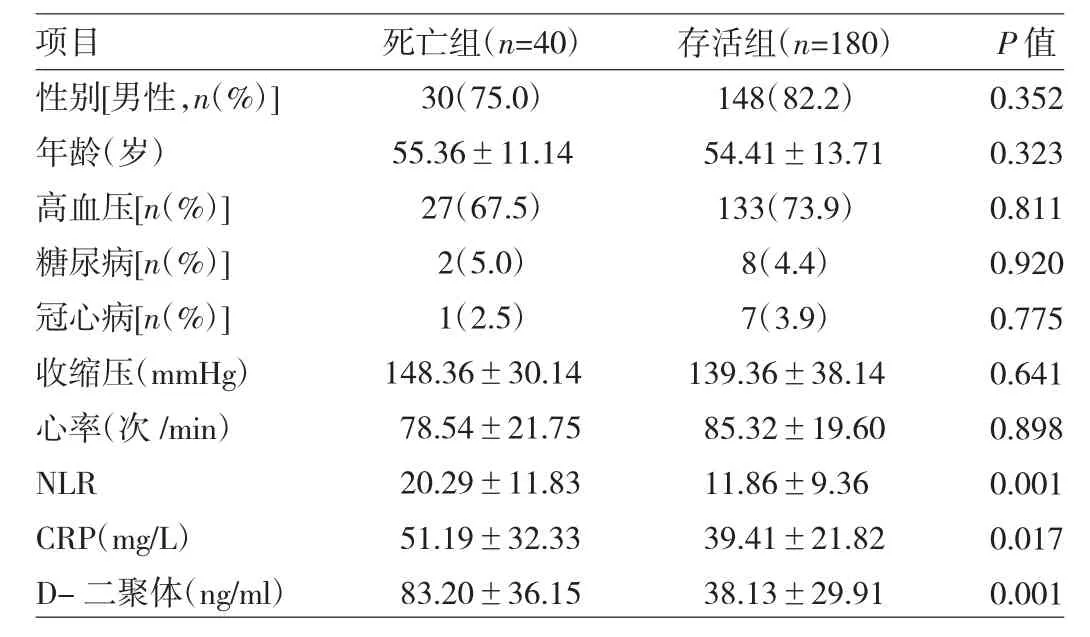
表2 影響死亡的危險因素單因素分析
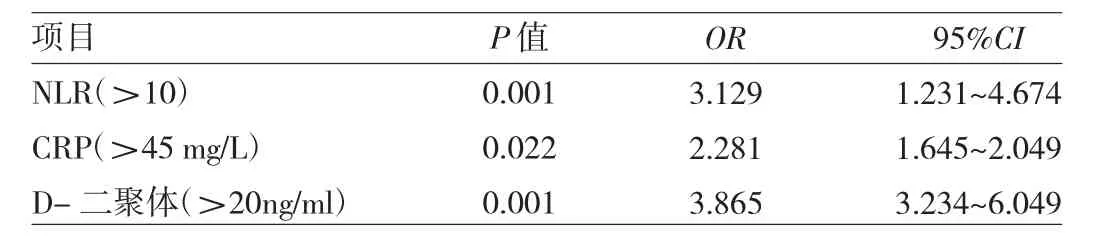
表3 logistic多因素回歸分析結果
諸多文獻表明,炎癥反應參與了血管重構,在AAD的發生、發展中起到了重要作用[4-5]。對AAD小鼠模型的觀察發現,機械損傷及假瘤形成的牽拉誘導了中性粒細胞趨化因子和粒細胞集落刺激因子表達,使大量中性粒細胞聚集在AAD血管壁中[5]。AAD患者的主動脈標本中也發現大量的巨噬細胞及T淋巴細胞浸潤,其組織中CRP、IL-6、IL-8、IL-10、TNF-α、單核細胞趨化蛋白-1水平也有顯著上升[6-7]。炎癥細胞釋放金屬蛋白酶(MMPs)和促炎性細胞因子,進而引起細胞外基質降解,誘導主動脈壁平滑肌細胞凋亡,促進動脈粥樣硬化形成,最終導致主動脈擴張和破裂[8],其浸潤程度和主動脈壁損傷嚴重程度密切相關[9],且炎癥標志物的變化與AAD的急性期反應和并發癥有關[10]。
CRP、WBC是臨床常用的炎癥指標。CRP水平高的主動脈夾層患者氧合受損、胸腔積液等并發癥發生率及病死率明顯升高[11]。Fan等[12]對570例患者進行隨訪,結果顯示CRP和WBC是AAD患者30d病死率的獨立預測因素。在A型主動脈夾層患者中,WBC升高的短期預后風險增加甚至不受外科干預的影響。但WBC受其他因素影響較大,與其相比,NLR整合了2個白細胞亞型,在心血管疾病中具有更好的風險預測價值[13]。其原因有以下兩點:首先在脫水狀況或體外的血液標本,可能會影響到白細胞各亞型的絕對值,但對NLR影響較小;其次NLR是兩個相反的免疫途徑相互平衡的結果[14]。NLR具有價格低廉,簡便易得的特點,目前多用于冠心病、惡性腫瘤的預后評估[15-16]。AAD發展過程中,WBC升高,其中NE升高,介導多種反應,可釋放氧化劑和蛋白酶,參與平滑肌細胞的凋亡;同時應激導致的內源性糖皮質激素釋放,引起淋巴細胞減少[17],表現為免疫抑制的狀態,NLR因而顯著增加。目前國內外對NLR在AAD患者預后評估中的報道不多,Karakoyun等[18]對35例AAD患者進行回顧性分析,結果顯示NLR對AAD病死率預測的靈敏度為77%,特異度為74%。而另一項研究顯示在接受外科手術的AAD患者中,高NLR組大出血的頻率、醫院相關感染、住院多器官功能障礙發生率和病死率均高于低NLR組[19]。在本研究中,AAD患者的住院病死率隨著CRP、NLR的升高而顯著升高,CRP及NLR為AAD住院期間死亡的獨立危險因素,與其他研究結果相似。急性期升高的NLR反映了主動脈壁的急性炎癥過程、主動脈損傷的嚴重程度以及AAD合并癥和并發癥的存在,因而與住院病死率密切相關。
早期已有研究表明,D-二聚體在AAD的住院死亡預測中具有重大價值,這一點在本研究中也得到證實。其原因可能因為D-二聚體與AAD患者血栓大小及血栓與血液接觸面積相關,其水平反映了主動脈夾層的累及范圍,與疾病嚴重程度相關[20]。同時,炎癥和凝血系統之間具有協同作用,炎癥激活凝血,凝血也調節炎癥。D-二聚體可通過增強中性粒細胞和單核細胞介導的炎癥級聯反應,誘導炎癥細胞因子分泌(包括IL-1和IL-6),促進炎性蛋白例如CRP的肝臟合成,可能對患者的預后產生負面影響[21]。
綜上所述,NLR對AAD患者住院期間預后的評估有重要指導價值,可結合CRP、D-二聚體等指標,提高對AAD患者預后判斷的準確性,但其機制等仍有待進一步研究。

