茯磚茶中金花菌菌落計數(shù)方法的優(yōu)化
劉凱利,黃亞亞,萬斌,梁艷,胡歆,*,紀(jì)曉明
(1.咸陽涇渭茯茶有限公司,陜西咸陽712044;2.陜西蒼山秦茶集團有限公司,陜西西安710003)
茯磚茶內(nèi)部或表面存在大量金黃色顆粒狀物質(zhì),俗稱“金花”;其數(shù)量的多少是判斷茯磚茶品質(zhì)好壞的重要指標(biāo)[1]。由于地域的差異性,金花菌具有多樣性[2-4],但大都以冠突散囊菌為主,還包括謝瓦式散囊菌、阿姆斯特丹散囊菌、間型散囊菌及肋狀散囊菌等。其子囊果均為閉囊殼型[5],他們的共同特征是[6]:培養(yǎng)前期(5 d~6 d),菌落質(zhì)地緊密,中心顏色為黃色或棕褐色,周邊為淺黃色。目前,對金花菌的檢測一般均采用GB/T 4789.15-2016《食品安全國家標(biāo)準(zhǔn)食品微生物學(xué)檢驗霉菌和酵母計數(shù)》,該方法針對的是食品中霉菌和酵母菌的計數(shù),而金花菌閉囊殼很難破裂[7-9],形成的菌落可能是2個~3個或更多個孢子生長發(fā)育而成,因此采用國標(biāo)方法并不能準(zhǔn)確地反映茯磚茶中金花菌的數(shù)量。本試驗通過響應(yīng)面法建立多元二次回歸方程來擬合因素與響應(yīng)值之間的函數(shù)關(guān)系,充分考慮各因素之間的影響,通過前處理條件使金花菌閉囊殼充分破裂釋放子囊孢子,從而得到金花菌菌落總數(shù)計數(shù)的優(yōu)化條件,為以后建立茯磚茶中金花菌標(biāo)準(zhǔn)計數(shù)方法提供試驗依據(jù)。
1 材料與方法
1.1 材料與設(shè)備
原料:茯磚茶,由咸陽涇渭茯茶有限公司提供。
FW100高速萬能粉碎機:天津泰斯特儀器有限公司;LDZX-50KBS立式壓力蒸氣滅菌鍋:上海申安醫(yī)療器械有限公司;SW-CJ-ID單人單面凈化工作臺:上海樹立儀器儀表有限公司;GHP-90隔水式恒溫培養(yǎng)箱:上海一恒科技有限公司;HZQ-C雙層空氣浴振蕩器:哈爾濱東聯(lián)電子技術(shù)開發(fā)有限公司。
培養(yǎng)基:孟加拉紅培養(yǎng)基,按GB/T 4789.15-2016配制。
1.2 方法
1.2.1 樣品的準(zhǔn)備
采用GB/T 8302-2013《茶取樣》方法取樣。將整塊茶磚撬碎混勻,取部分混勻茶樣粉碎后備用,部分不粉碎茶樣作為對照樣品。
1.2.2 菌落計數(shù)方法
采用GB/T 4789.15-2016方法。取已準(zhǔn)備好的茶樣25.00 g于裝有無菌稀釋液的三角瓶中(內(nèi)含200顆玻璃珠[10]),經(jīng)振搖后進行梯度稀釋,孟加拉紅培養(yǎng)基傾注平板,平板于(28±1)℃恒溫培養(yǎng)箱培養(yǎng),第5天計數(shù)并拍照記錄。
1.2.3 單因素試驗
1.2.3.1 篩子目數(shù)對金花菌菌落總數(shù)的影響
茶樣粉碎,分別過篩 40、50、60、70、80、90 目,分別稱取過篩后的茶樣25.00 g于無菌蒸餾水中,振搖30 min(200 r/min)后進行梯度稀釋,孟加拉紅培養(yǎng)基傾注平板,(28±1)℃恒溫培養(yǎng)箱培養(yǎng),第5天計數(shù)。
1.2.3.2 無菌稀釋液濃度對金花菌菌落總數(shù)的影響
稱取過篩60目的茶樣25.00 g,分別加入無菌的蒸餾水、0.45%NaCl、0.85%NaCl、1.25%NaCl、1.65%NaCl、磷酸緩沖溶液中稀釋,振搖 30 min(200 r/min)后進行梯度稀釋,孟加拉紅培養(yǎng)基傾注平板,(28±1)℃恒溫培養(yǎng)箱培養(yǎng),第5天計數(shù)。
1.2.3.3 振搖時間對金花菌菌落總數(shù)的影響
稱取過篩60目的茶樣25.00 g于無菌蒸餾水中,在轉(zhuǎn)速為 200 r/min 條件下,分別振搖 20、30、40、50、60、70 min后,進行梯度稀釋,孟加拉紅培養(yǎng)基傾注平板,(28±1)℃恒溫培養(yǎng)箱培養(yǎng),第5天計數(shù)。
1.2.4 響應(yīng)面試驗
在單因素試驗基礎(chǔ)上,以篩子目數(shù)、NaCl濃度、振搖時間為自變量,以金花菌菌落總數(shù)為響應(yīng)值進行響應(yīng)面試驗,中心試驗重復(fù)5次,共17個試驗點,試驗設(shè)計如表1所示。
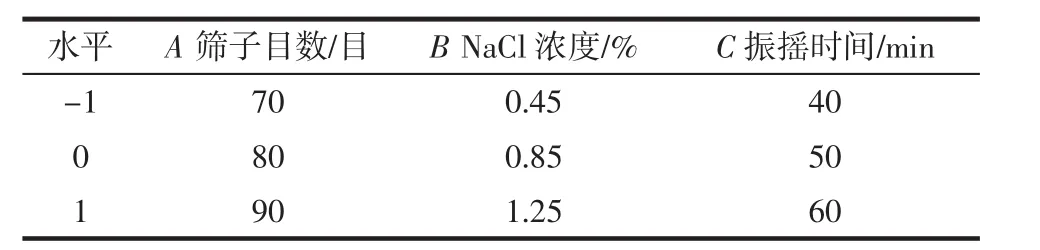
表1 因素水平表Table 1 Factor level table
2 結(jié)果與分析
2.1 單因素試驗結(jié)果
2.1.1 篩子目數(shù)對金花菌菌落總數(shù)的影響
篩子目數(shù)對金花菌菌落總數(shù)的影響見圖1。
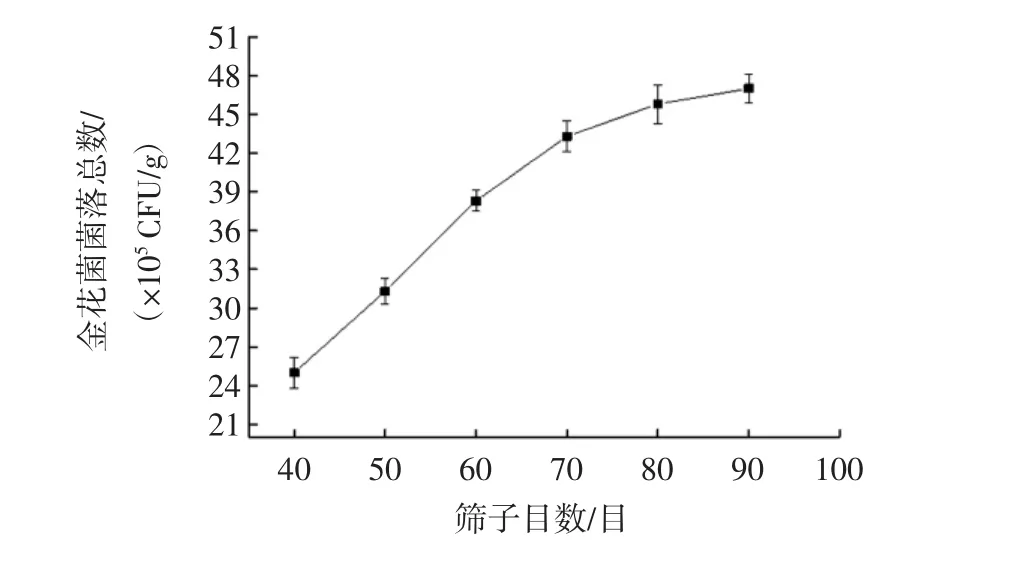
圖1 篩子目數(shù)對金花菌菌落總數(shù)的影響Fig.1 Influence of mesh size on the total number of Jinhua fungus
由圖1可知,篩子目數(shù)對金花菌菌落總數(shù)影響顯著。隨著篩子目數(shù)的減小,金花菌菌落總數(shù)呈增長趨勢,篩子目數(shù)從40目至80目,金花菌菌落總數(shù)呈直線增長,篩子目數(shù)為80目時,其菌落總數(shù)為(45.8±1.5)×105CFU/g;80目至90目,金花菌菌落總數(shù)趨于平緩,原因可能是高速粉碎機在粉碎過程中高速撞擊并產(chǎn)生熱量,當(dāng)粉碎時間過長時容易導(dǎo)致金花菌孢子結(jié)構(gòu)被破壞而失活。因此,篩子目數(shù)選用80目。
2.1.2 無菌稀釋液濃度對金花菌菌落總數(shù)的影響
無菌稀釋液濃度對金花菌菌落總數(shù)的影響見圖2。
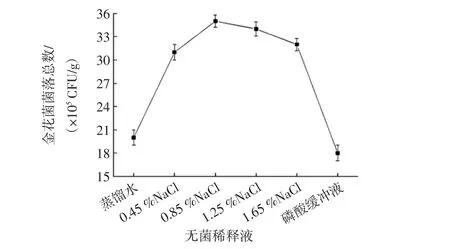
圖2 無菌稀釋液對金花菌菌落總數(shù)的影響Fig.2 Influence of sterile diluent on the total number of Jinhua fungus
由圖2可知,磷酸緩沖溶液對金花菌孢子釋放作用不明顯,數(shù)量僅為(18.0±1.0)×105CFU/g。當(dāng)稀釋液中NaCl濃度為0.85%時,金花菌菌落總數(shù)最多,為(35.0±0.8)×105CFU/g。當(dāng)滲透壓過低時,過多的水分進入孢子,會使孢子膨脹或破裂而失活;當(dāng)滲透壓過高時,孢子失水收縮,細(xì)胞結(jié)構(gòu)容易被破壞而失活。因此,無菌稀釋液以0.85%NaCl溶液為宜。
2.1.3 振搖時間對金花菌菌落總數(shù)的影響
振搖時間對金花菌菌落總數(shù)的影響見圖3。
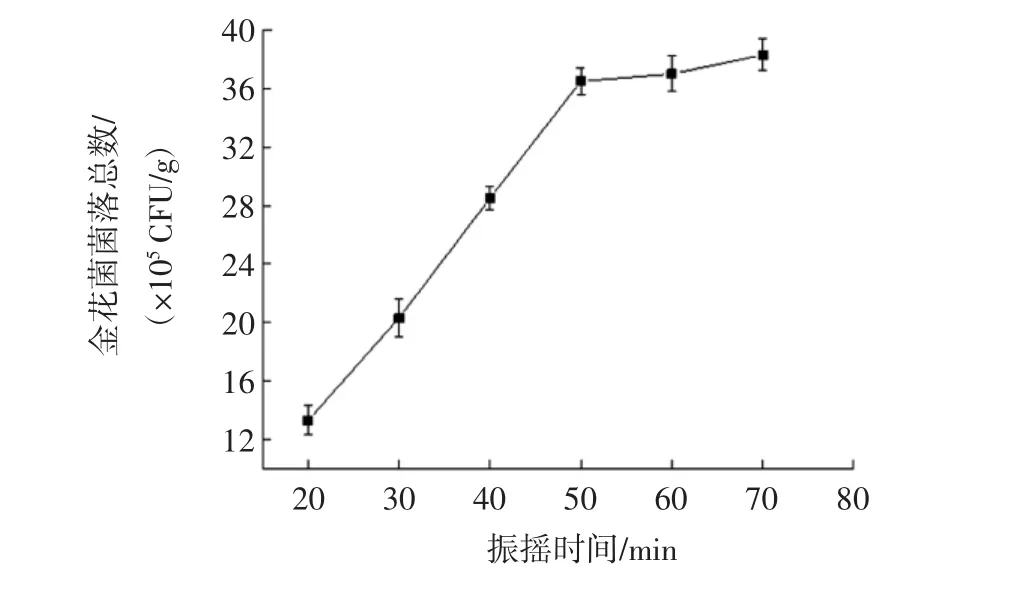
圖3 振搖時間對金花菌菌落總數(shù)的影響Fig.3 Influence of the shaking time on the total number of Jinhua fungus
金花菌菌落總數(shù)隨振搖時間的延長而增加,表明物理振搖對金花菌子囊果破壁也有一定影響。當(dāng)振搖時間為50 min時,金花菌菌落總數(shù)為(36.9±0.8)×105CFU/g;振搖50 min后金花菌菌落總數(shù)趨于平緩,因此振搖時間選擇50 min。
2.2 響應(yīng)面結(jié)果與分析
2.2.1 響應(yīng)面試驗設(shè)計及結(jié)果
以篩子目數(shù)、無菌稀釋液濃度、振搖時間為自變量,以金花菌菌落總數(shù)為響應(yīng)值,試驗設(shè)計與結(jié)果見表2。零點為區(qū)域的中心點,零點試驗重復(fù)5次,用以估計試驗誤差[11]。
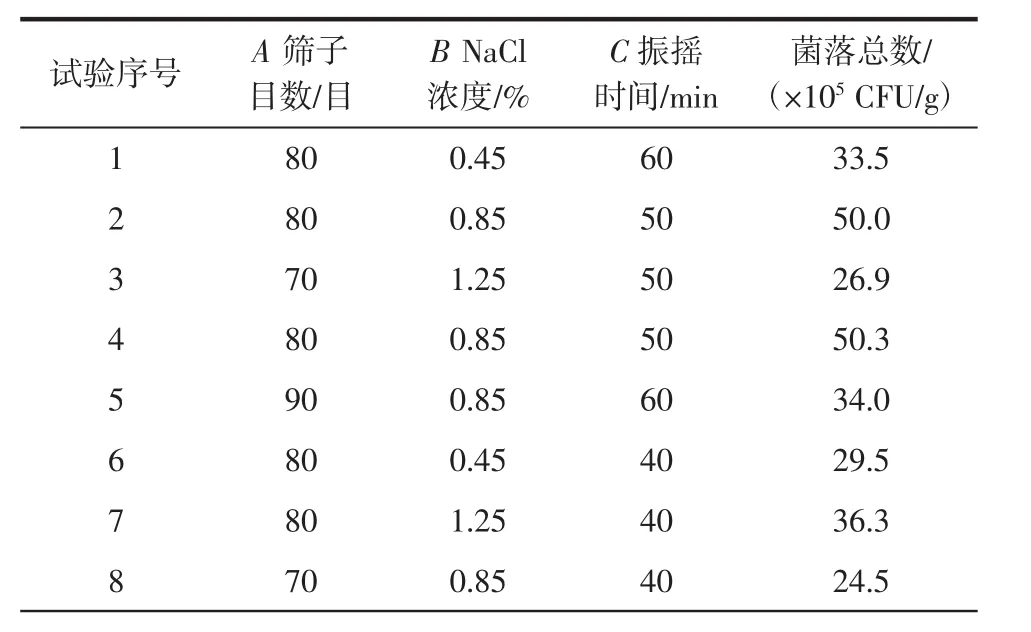
表2 響應(yīng)面設(shè)計方案及試驗結(jié)果Table 2 Experimental design and results of response surface
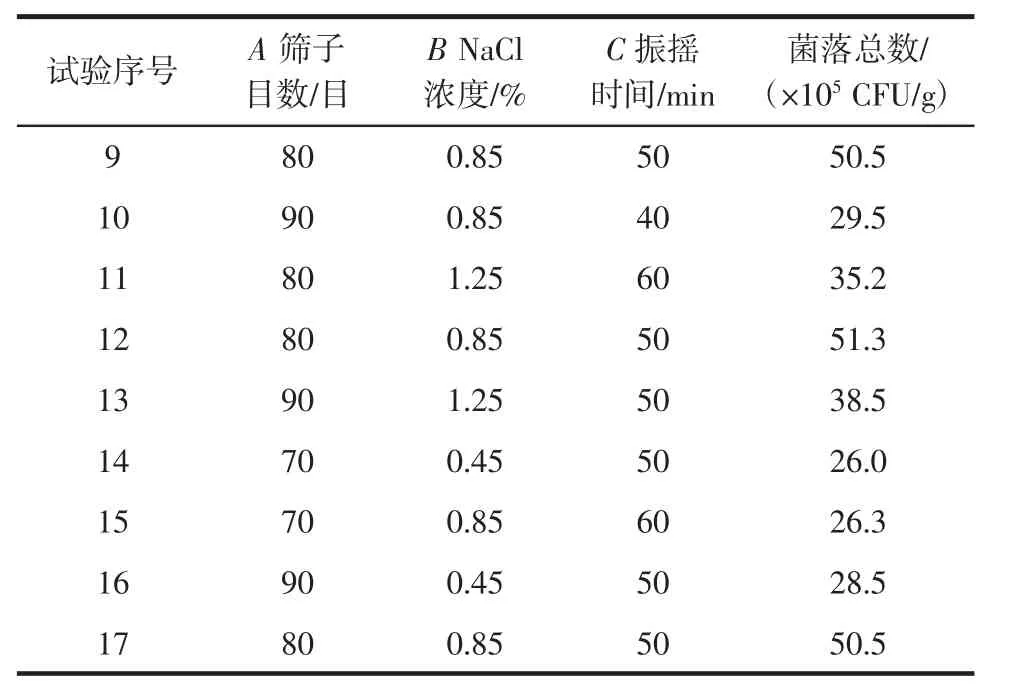
續(xù)表2 響應(yīng)面設(shè)計方案及試驗結(jié)果Continue table 2 Experimental design and results of response surface
2.2.2 模型建立與回歸方程分析
采用Design-Expert.V8.0.6對試驗數(shù)據(jù)進行多元線性擬合,得到以金花菌菌落總數(shù)為響應(yīng)值的二次多項回歸模型方程:Y=50.42-046A+0.54B+1.78C+0.65AB-0.075AC+2.63BC-8.94A2-10.88B2-14.41C2。對模型方程進行顯著性檢驗,方差分析結(jié)果見表3。
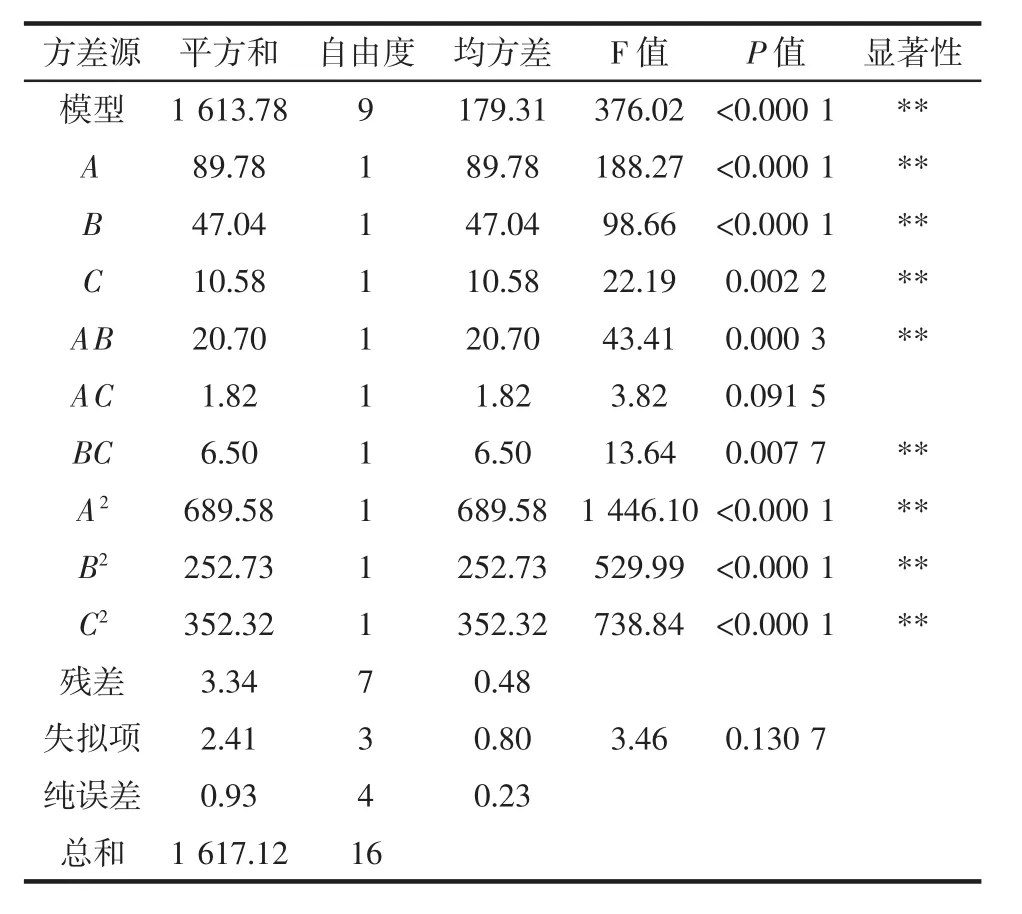
表3 平板計數(shù)法回歸方程方差分析表Table 3 Analysis of variance of the regression equation of plate counting method
由表 3可知,模型差異性極顯著(P<0.000 1),說明方程與實際情況擬合較好,能夠反映金花菌菌落總數(shù)與各因素之間的關(guān)系;失擬項差異不顯著(P>0.05),說明其他因素對試驗影響很小,適用于茯磚茶中金花菌菌落計數(shù)方法的優(yōu)化。
表3中F值的大小可以判斷各因素對金花菌菌落總數(shù)影響的強弱。各個因素對金花菌菌落總數(shù)影響的程度大小的次序為篩子目數(shù)>NaCl濃度>振搖時間,數(shù)學(xué)模型的結(jié)果表明 A、B、C、AB、BC、A2、B2及 C2差異性達到極顯著水平(P<0.01),表明各考察因素對金花菌菌落總數(shù)的影響具有交互作用,而不是簡單的線性關(guān)系。可用該回歸方程代替試驗真實點對試驗結(jié)果進行分析和預(yù)測。其相關(guān)系數(shù)R2=0.997 9,表明試驗所選擇的3個變量對響應(yīng)值的影響已達99.79%,表示該模型條件能夠很好地反映實際值。其他影響因素對菌落總數(shù)的影響可忽略不計。響應(yīng)面試驗得到的最優(yōu)處理條件為:篩子目數(shù)79.74目、NaCl濃度0.86%、振蕩時間50.49 min,模型預(yù)測的最佳菌落數(shù)為50.49×105CFU/g。
2.2.3 各因素之間的響應(yīng)面結(jié)果分析
各因素交互作用對金花菌菌落總數(shù)影響的響應(yīng)面和等高線圖見圖4。
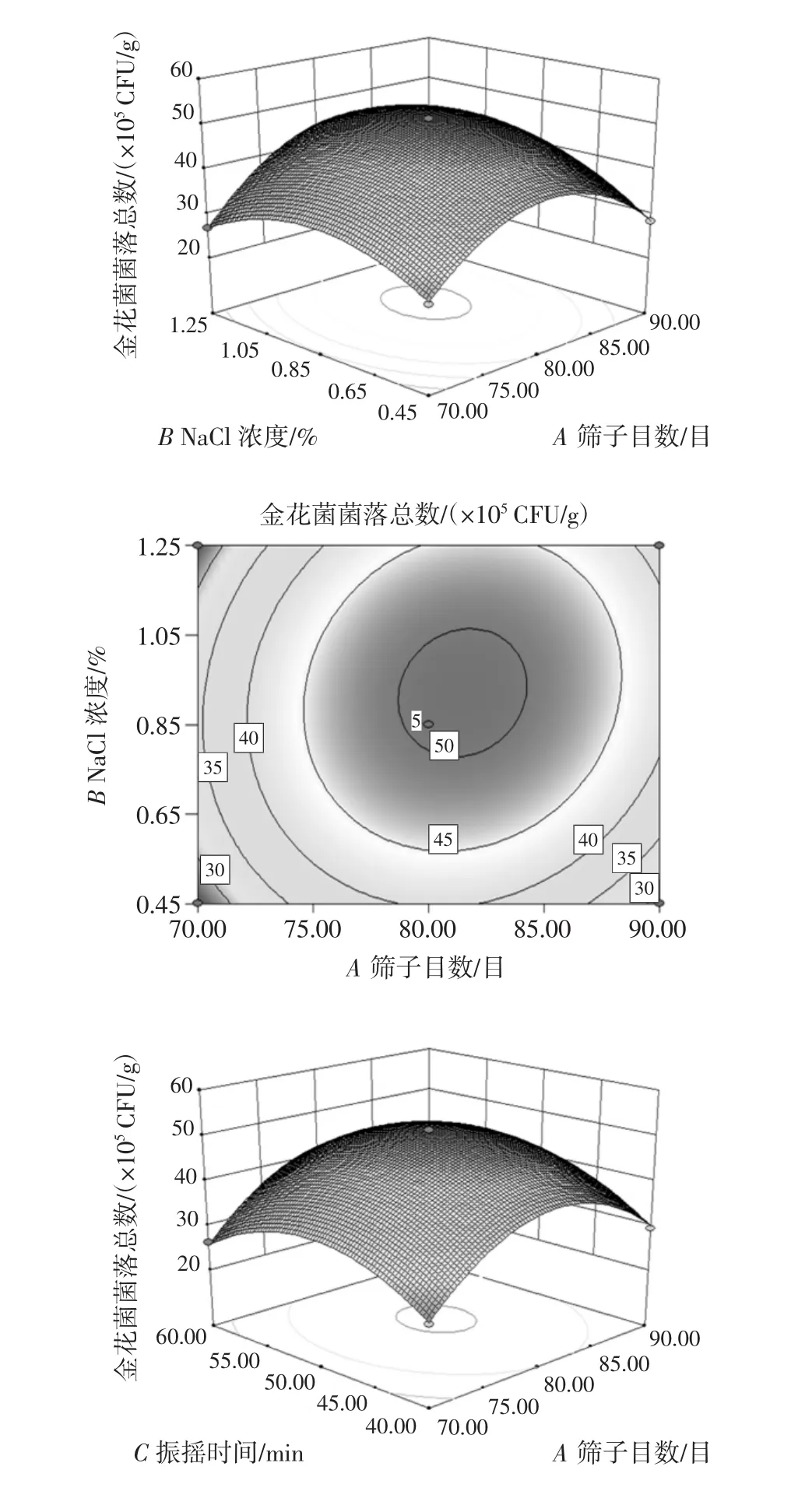
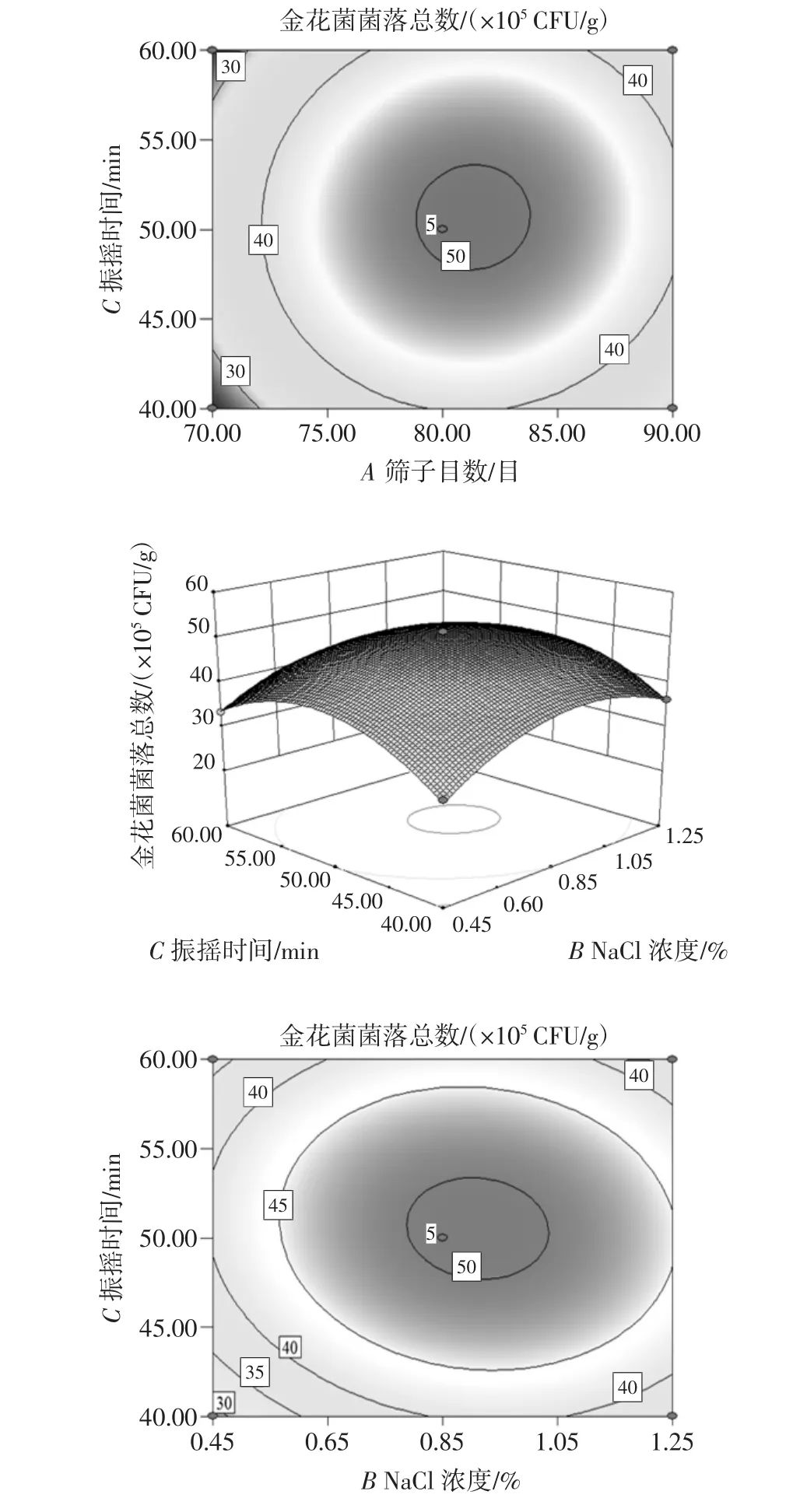
圖4 各因素交互作用對金花菌菌落總數(shù)影響的響應(yīng)面和等高線圖Fig.4 Response surface and contour map of the interaction of various factors on the total number of Jinhua fungus
響應(yīng)面三維圖中曲面的陡峭程度可以表明自變量對金花菌菌落總數(shù)的影響程度,曲面較陡表明影響較大,反之則較小;而等高線圖反映了因素間交互作用的強弱大小,橢圓形表示交互作用顯著,圓形表示交互作用不顯著[12]。結(jié)合本研究中的二次回歸方程及表3可知,二次項AB、BC具有極顯著的交互作用(P<0.01),即篩子目數(shù)與NaCl濃度、NaCl濃度與振搖時間每兩個因素間均具有顯著的交互作用。由圖4可知篩子目數(shù)與NaCl濃度、NaCl濃度與振搖時間、篩子目數(shù)與振搖時間對菌落總數(shù)的影響先升高后降低,響應(yīng)值呈拋物線形趨勢,因此回歸方程有極大值。
2.2.4 模型的驗證試驗結(jié)果
為了檢驗響應(yīng)面方法的可靠性,本研究按照模型得到的金花菌菌落總數(shù)最佳計數(shù)條件進行試驗操作驗證,結(jié)合試驗的可行性,得到最終優(yōu)化條件為篩子目數(shù)80目、稀釋液為0.85%NaCl溶液、振搖時間50 min,平行6次試驗,得到金花菌菌落總數(shù)為(50.75±1.1)×105CFU/g,與模型預(yù)測的數(shù)值進行比較分析,菌落數(shù)的RSD值為1.1%,其RSD值遠遠小于3%,因此,可以選擇以上條件作為茯磚茶中金花菌菌落總數(shù)的最佳優(yōu)化參數(shù)。
2.3 方法驗證
采用上述優(yōu)化方法與國標(biāo)方法進行金花菌菌落總數(shù)的對比,結(jié)果見表4。

表4 國標(biāo)方法和優(yōu)化方法對不同茯磚茶的計數(shù)結(jié)果Table 4 Counting results of different Fu brick tea by GB method and optimization method
結(jié)果顯示,優(yōu)化方法得到的金花菌菌落總數(shù)是國標(biāo)方法的5倍左右。
3 結(jié)論
目前關(guān)于金花菌菌落計數(shù)方法及破壁方法的研究較少,本研究在國標(biāo)方法的基礎(chǔ)上對樣品前處理條件進行優(yōu)化,取樣時將整塊茶磚撬碎混勻,茶樣粉碎過篩80目、稀釋液為0.85%NaCl溶液,振搖時間50min(轉(zhuǎn)速為200 r/min),該條件下,優(yōu)化方法得到的金花菌菌落總數(shù)均在107CFU/g以上,相比國標(biāo)方法提高了5倍左右,優(yōu)化效果明顯,為確定金花菌標(biāo)準(zhǔn)計數(shù)方法提供了試驗依據(jù)。

