回醫烙灸對兔膝骨性關節炎基質金屬蛋白酶及其抑制劑表達影響的研究*
林瑞珠,陳美華,馬 川,王 月,許建峰△
(1.寧夏醫科大學總醫院,寧夏 銀川 750004; 2.寧夏醫科大學回醫藥現代化教育部重點實驗室,寧夏 銀川 750004)
膝關節是人類負重主要關節之一,一些危險因素[1]包括年齡、超重、股四頭肌薄弱、性別、家族史、過度運動等使膝骨性關節炎(Knee osteoarthirtis,KOA)的發病率居高不下,據最新的KOA流行病學調查[2],我國KOA的患病率為8.1%,提示KOA患者約有1.1億。其軟骨和骨的病理改變引起關節疼痛、僵硬和不同程度的功能障礙是其主要臨床表現,針對KOA的發病機制目前尚不完全清晰[3],但越來越多的證據表明,軟骨細胞外基質過度降解在KOA的發病中扮演重要角色,最終可導致軟骨損傷、破壞[4-5]。軟骨細胞外基質(extracellular matrix,ECM)主要成分為膠原和蛋白多糖,二者相互作用,膠原質纖維提供軟骨張力能力及抗壓力作用,結合蛋白多糖的吸水性維持軟骨彈性[6]。基質金屬蛋白酶可降解細胞外基質,破壞膠原纖維網結構,膠原纖維溶解使軟骨細胞失去保護,且附著其結構網上的蛋白聚糖滲透性增加導致組織腫脹壓力增高,綜合因素導致軟骨病理損害的惡性循環促進KOA進展[7]。而基質金屬蛋白酶抑制因子能抑制膠原降解,維持膠原纖維網結構穩定,提高軟骨保護作用[8]。有研究表明,基質金屬蛋白酶在KOA表達異常,打破與蛋白酶組抑制劑平衡從而導致ECM過度降解,引起軟骨退變[9]。
烙灸療法是具有鮮明地方特色的治療方法,是傳統醫學的一部分,具有“補腎通絡、強筋健骨”的作用[10],團隊前期研究發現烙灸療法可減少KOA軟骨細胞凋亡、延緩KOA進展[11],本研究在此基礎上進一步探討烙灸對兔KOA模型軟骨細胞外基質MMP2、MMP3、和TIMP-1表達的影響。
1 實驗材料
1.1 實驗動物
30只成年健康新西蘭兔由寧夏醫科大學動物實驗中心提供,雌雄不限,體質量2.5~3.0 kg,維持飼養環境一定的溫度和濕度,單籠飼養,12 h晝夜循環,不中斷水和食物供應,適應性飼養5天后,第6天開始造模。
1.2 主要儀器、試劑和藥品
顯微鏡、凝膠成像系統、ABI7900 Q-PCR儀器(由寧夏醫科大學基礎醫學實驗室提供);石蠟切片機(德國徠卡RM2245)。MMP2、MMP3和TIMP1鼠抗兔多克隆抗體(Orb gen公司,AOK12761-1),生物素-鏈霉卵白素兔免疫組化試劑盒(北京中衫金橋公司,生成批號:K142415E),寡核苷酸引物oligo、逆轉錄酶RTase、4%多聚甲醛固定液、青霉素鈉粉針劑(80萬U/支)(銀川市偉博鑫生物科技有限公司)。烙灸所用艾絨(寧夏醫藥公司)。
2 實驗方法
2.1 模型制備
使用Hulth法制備KOA模型[12]。實驗動物適應性飼養5天后,模型對照組和烙灸干預組的所有動物進行KOA造模。3%苯巴比妥鈉溶液(1 mL/kg)兔耳緣靜脈注射,麻醉滿意狀態下將實驗兔左后肢膝關節固定,做好局部脫毛、備皮、消毒工作,沿兔膝關節內側縱向切開皮膚4 cm,暴露關節腔,探査關節腔內有無原發病灶,切除內側半月板,切斷前交叉韌帶,動作輕柔謹慎不傷及關節軟骨。止血,生理鹽水沖洗關節腔后縫合關節囊及皮膚切口,最后碘伏棉球擦洗局部傷口,包扎敷貼,每只造模兔單籠內自由活動。為預防傷口感染術后常規肌注青霉素鈉40萬U/只,連續3天;術后1周,每天驅趕強迫造模兔籠內跑動15 min,2次/天,4周后可獲得穩定的KOA模型[13]。
2.2 治療方法
造模4周后開始干預,烙灸干預組實驗兔固定在兔臺上,左膝關節局部剃毛并脫毛,將烙灸灸具放置在關節局部[14],點燃灸槽內艾絨3 g,烙灸灸具直接接觸兔左膝關節局部,烙灸灸具可使兔左膝關節局部皮膚發紅,每天1次,每次20 min,治療4周后進行取材。模型對照組不予烙灸干預治療,只進行兔臺固定步驟,20 min/天,4周后取材。空白對照組同樣4周后取材,不予任何干預措施。
2.3 軟骨取材及SP免疫組化方法檢測
采取空氣栓塞法處死所有試驗動物,立即切開左膝關節腔,迅速切取、剝離脛骨平臺和股骨內側髁的軟骨,一分為二:取一份立即放入液氮保存備用;第二份冰上切成約0.5 cm×0.5 cm×0.5 cm大小組織塊,4%多聚甲醛液固定、10%乙烯二胺四乙酸脫鈣,常規脫水、透明、浸蠟、包埋、切片,一份進行常規HE染色,其余采用SP免疫組化方法檢測MMP2、MMP3和TIMP-1的表達。SP免疫組化切片采用Image-ProPlus 5.1圖像分析系統分析,隨機選取5個視野計算其平均值,灰度值反映陽性表達率。
2.4 免疫印跡(Western blot,WB)法檢測MMP2、MMP3和TIMP-1蛋白表達
取液氮保存的軟骨約50 mg,研磨至粉末狀,細胞裂解法提取軟骨總蛋白并測濃度,SDS-Page凝膠電泳,剝膠,轉膜,分別加入MMP2、MMP3和TIMP-1(1∶500)一抗,二抗IgG孵育。逐一顯影、定影、洗片、凝膠、成像,采用Image too 3.0影像軟件分析,參照β-actin條帶灰度值分析目標蛋白條帶相對應灰度值。
2.5 半定量RT-PCR檢測
取液氮保存的軟骨約10 mg置于Trizol液勻漿,氯仿混勻,離心后取上清加入等體積異丙醇,再離心,棄上清,完成總RNA提取;分離總RNA之后,經DEPC處理的雙蒸水稀釋,分光光度儀測定含量,分裝,-80℃保存備用。以GAPDH作為內參照,用半定量RT-PCR檢測各組MMP2、MMP3和TIMP-1 mRNA 表達水平。①反轉錄反應:總RNA樣品2 μL,加上MD(寡核苷酸引物),經AMV(家禽成髓細胞性白血病病毒)逆轉錄酶作用下進行逆轉錄合成cDNA。②PCR擴增:擴增條帶,95℃,5 min;95℃變性,1 min后65℃退火,30 s;72℃延伸,60 s,上述條件下進行40個循環擴增。各組引物序列按基因庫設計并合成如下:MMP2上游5′-GTGGATGATGCCTTTGCTCG-3′,下游5′-AGTCCGTCCTTACCGTCAAA-3′,152 bp;MMP3上游5′-CAAGTCCCTCAGGATTCTCGAAC-3′,下游5′-GGTGTGGATGCTTCTTGGGTAA-3′,187 bp;TIMP1上游5′-ATGGCGCCC-TTTGCATCTCT-3′,下游5′-TCAGGCTTCAGCTTTTGCCA-3′,654 bp;GAPDH上游5′-ATGGCCTTCCGTGTTCCTAC-3′,下游5′-TTACTCCTTGGAGGCCATG-T-3′,317 bp。相應的擴增產物經瓊脂凝膠電泳后于成像系統攝片,光密度掃描,相對量分析時以GAPDH作校正。
2.6 觀察指標
①SP免疫組化觀察MMP2、MMP3和TIMP-1表達;②Western blot檢測軟骨細胞外基質MMP2、MMP3和TIMP-1蛋白水平;③半定量RT-PCR檢測軟骨細胞外基質MMP2、MMP3和TIMP-1的mRNA表達。
2.7 統計方法

3 結果
3.1 3組SP免疫組化檢測結果比較
MMP2、MMP3和TIMP-1在軟骨細胞外基質的陽性表達呈黃色或棕黃色顆粒,均分布于細胞質。烙灸干預組軟骨細胞外基質中MMP2、MMP3的表達增多,高于空白對照組,但明顯低于模型對照組(P<0.05);烙灸干預組軟骨細胞外基質中的TIMP-1的表達減少,低于空白對照組,但明顯高于模型對照組(P<0.05)。見表1、圖1。
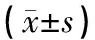
表1 3組軟骨細胞外基質中MMP2、MMP3和TIMP-1灰度值比較
注:與空白對照組比較,*P<0.01;與模型對照比較,#P<0.05。

圖1 3組實驗兔軟骨組織病理切片圖(100×)
3.2 3組Western blot檢測結果比較
烙灸干預組軟骨細胞外基質中的MMP2、MMP3蛋白表達量增多,高于空白對照組,相對于模型對照組明顯減低(P<0.05);烙灸干預組軟骨細胞外基質中的TIMP-1蛋白表達較模型對照組明顯增高(P<0.05)。見圖2、3。

圖2 3組軟骨細胞外基質MMP2、MMP3和TIMP-1蛋白相對表達水平

注:與空白對照組相比,*P<0.01;與模型對照組相比,#P<0.05。圖3 3組軟骨細胞外基質MMP2、MMP3和TIMP-1蛋白相對表達量
3.3 3組RT-PCR檢測結果比較
烙灸干預組軟骨細胞外基質中的MMP2、MMP3 mRNA表達量增多,高于空白對照組,相對于模型對照組明顯降低(P<0.05);烙灸干預組軟骨細胞外基質中的TIMP-1 mRNA表達較模型對照組明顯增高(P<0.05)。見圖4。

注:與空白對照組相比,*P<0.01;與模型對照組相比,#P<0.05。圖4 半定量RT-PCR檢測軟骨外基質MMP2、MMP3和TIMP-1 mRNA的表達
4 討論
膝骨性關節炎在傳統醫學中屬“痹證”范疇,屬于“骨痹”,發病主要與風寒濕邪、勞損、氣血不足、肝腎虧虛等因素相關[15],與現代醫學的流行病學因素相符合;病機為風寒濕侵入機體,痹阻關節筋絡,導致腎虛骨痹,其治則為驅邪扶正,驅除風寒濕瘀之邪,溫腎壯骨以扶正。依據《回回藥方·針灸門》“是凡一體內,多有惡潤凝聚以致本體,……必以火灸之,則本體病根盡去”[16]中所闡述的回醫烙灸療法,是中醫化膿灸的發展與深化,具有刺激面積大、施灸量可控及鐵制灸具傳遞熱量迅速和均勻等優點,具有濃郁的民族特色。通過局部的溫熱作用祛除“骨痹”局部污血、惡潤、凝聚等病理產物,是具有地方民族特色的治療方法,起到“溫腎散寒、強筋壯骨”的作用,符合“膝痹”的傳統醫學治療原則。
軟骨外基質的主要成分涉及膠原和蛋白聚糖,而基質金屬蛋白酶(MMPs)的主要作用是通過水解酶類作用對細胞基質分解代謝起催化作用,過度降解ECM成分,破壞關節軟骨纖維和膠原網結構,使彈性喪失,對軟骨保護作用降低,加強軟骨代謝,最終導致關節炎[17];根據底物特異性和結構分為5種不同亞型,MMP2、MMP3分屬明膠酶和間質溶酶素。MMP2屬于明膠酶A,可直接參與ECM的降解[18],主要降解各型明膠、多糖、IV、V、VII、X型膠原等;MMP3可特異性降解蛋白多糖、層粘連蛋白及纖維粘連蛋白等,屬于間質溶素;在正常的ECM中也有表達,但如果過度表達時,可激活MMPs的其他亞型,加速膠原的病理降解[19]。金屬蛋白酶抑制劑(tissue inhibitor of matrix metalloproteinase,TIMPs)屬于MMPs生理性抑制劑,其中,TIMP-1是TIMPs抑制MMPs活性最強的酶[20],通過與MMPs不可逆的結合,抑制MMPs對ECM的降解,防止膠原、蛋白聚糖過度降解[21]。TIMPs與MMPs二者的平衡可以保持ECM合成和降解的平衡,如果二者動態失衡將導致軟骨ECM的過度降解而致軟骨細胞過度凋亡,促進關節炎的進展。
本實驗通過烙灸治療兔KOA模型,觀察到烙灸可以顯著抑制兔膝關節軟骨細胞外基質MMP2、MMP3的蛋白、mRNA表達,而上調TIMP1的蛋白、mRNA表達,究其原因,可能與烙灸治療過程中,艾絨燃燒時發生熱的傳遞與滲透,熱能到達病變局部,調節了細胞外基質金屬蛋白酶及其抑制劑的合成代謝,有效降低細胞外基質的過度降解,維護細胞外基質環境的穩定。同時,前期研究發現烙灸可以減輕兔膝關節軟骨細胞的凋亡[11],結合本次實驗發現烙灸可以改善細胞外基質的合成代謝,驗證了KOA發病發展過程中軟骨細胞與細胞外基質二者可以相互影響的關系。
烙灸可以降低軟骨細胞外基質MMP2、MMP3表達,提高TIMP1的表達,同樣的結果在其他研究學者的實驗上也得到證實,闞衛兵等學者[22]應用基因芯片測定家兔KOA模型滑膜組織MMP2、MMP3,發現二者表達均增高。另有學者研究發現,KOA軟骨細胞MMP2、MMP3表達經針灸干預后顯著下調,而TIMP-1表達上調,達到糾正二者失衡、抑制ECM的過度降解、保護關節軟骨的作用[23-25]。綜上所述,烙灸療法對膝骨性關節炎的保護可能是通過烙灸下調關節軟骨細胞外基質的基質金屬蛋白酶、上調其蛋白酶抑制劑而起作用。

