SPE凈化-同位素稀釋質譜法測定乳與乳制品中生物素的含量
◎ 陶大利,白 鶴,李 琴
(農業部乳品質量監督檢驗測試中心(哈爾濱),黑龍江 哈爾濱 150090)
生物素(Biotin)又稱維生素H、維生素B7、輔酶R等,是一種水溶性B族維生素。生物素是構成羧化酶的重要輔酶[1],參與人體內脂肪、糖類和氨基酸的代謝[2],對于維持機體正常生理功能有重要的作用,已廣泛的應用于醫藥、維生素制劑、飼料添加劑、運動飲料、嬰幼兒配方食品等方面,同時在生物學、醫學臨床和發酵工業中,也等到了廣泛的應用[3]。
目前有關生物素的檢測很多,有文獻報道的方法有微生物法[4-6]、液相色譜法[7-9]、酶聯免疫法[10]、熒光免疫層析法[11]、液質聯用法[12-14]。其中,液相色譜串聯質譜技術已得到廣泛應用,對低含量生物素樣品的定量測定起到了很大的推動作用。本研究采用液相色譜串聯質譜法,同時采用內標法定量,針對乳制品研究了前處理方法,適用于乳與乳制品中生物素的測定。
1 實驗部分
1.1 儀器與試劑
超高效液相串聯質譜儀(waters,TQ)、精密電子天平(梅特勒托利多,ML204)、渦旋混合器(IKA,MS3)、高速冷凍離心機(SIGMA,3-30K)、自動固相萃取儀(吉爾森,GX274)、氮吹儀(Thermo,T18010)、超純水系統(Thermo)、HLB固相萃取柱(60 mg/3 mL)。
甲醇(色譜純)、乙腈(色譜純)、正己烷(色譜純)、甲酸(色譜純)、冰乙酸(優級純)、生物素標準品、生物素D4標準品,所使用實驗用水均為一級水。
1.2 樣品前處理
1.2.1 提取
稱取5 g奶粉或20 g液態乳于50 mL容量瓶中,奶粉用40 ℃水充分溶解,加入20%醋酸1 mL,混勻超聲5 min,放置至室溫后定容過濾,取20 mL左右濾液于50 mL離心管中,加入20 mL水飽和的正己烷,充分振蕩,放入離心機5 000 r·min-1離心5 min,取10 mL下層清液,上自動固相萃取儀凈化。
1.2.2 凈化
分別用3 mL甲醇、3 mL一級水活化HLB固相萃取柱,取10 mL提取液上樣,3 mL一級水淋洗,吹干,用3 mL甲醇洗脫,全部收集洗脫液,整個過程控制流速在 1 mL·min-1以內,加入 2 μg·mL-1生物素 D4內標溶液100 μL,45 ℃氮吹至近干,用10%乙腈水溶液10 mL溶解,如做生鮮乳可適當調整溶解液的體積,過0.22 μm濾膜,使用液質聯用儀測試。
1.2.3 標準曲線配制
分別移取生物素標準溶液(500 ng·mL-1)0.1、0.2、0.4、0.6、0.8 mL和1.0 mL于10 mL容量瓶中,分別加入2 μg·mL-1生物素D4溶液100 μL,用10%乙腈水溶液定容至刻度混勻,濃度分別為5、10、20、30、40 ng·mL-1和 50 ng·mL-1;生物素 D4內標濃度與樣品相同。
1.3 儀器條件
色譜柱:BEH C1850 mm×2.1 mm,1.7 μm;流動相:0.1%甲酸水與乙腈梯度洗脫,洗脫程序見表1。毛細管電壓:3.3 kV;錐孔電壓:24 kV;脫溶劑氣溫度:450 ℃;脫溶劑氣流量:650 L·h-1;離子源溫度:150 ℃;生物素:245>97(定性),碰撞能量27 V,245>227(定量),碰撞能量27 V;生物素D4:249>231,碰撞能量17 V。生物素及生物素內標選擇離子譜圖見圖1、圖2。
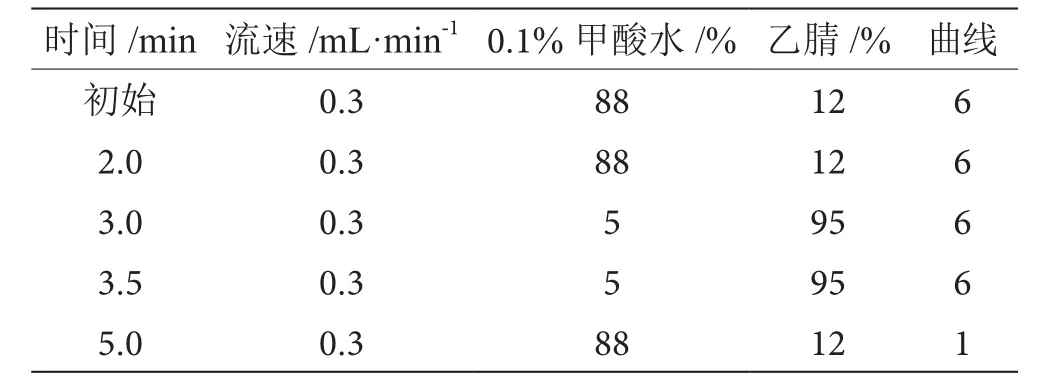
表1 梯度洗脫程序表
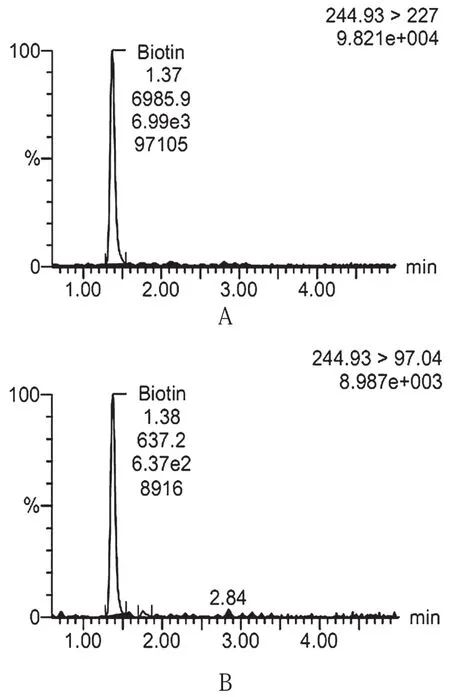
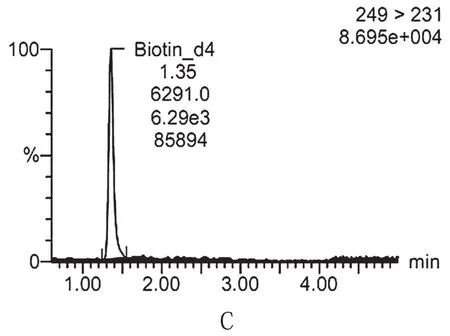
圖1 生物素和生物素內標選擇離子譜圖
圖A、B為生物素兩對選擇離子譜圖,圖C為生物素內標選擇離子譜圖
2 結果與分析
2.1 樣品提取的選擇
生物素是一種水溶性維生素,而乳制品中含有一定量的蛋白質、脂肪,所以在提取目標物的同時樣品需去除蛋白質獲得澄清溶液才能進行測定操作。參考國家標準GB 5009.259-2016《食品安全國家標準 食品中生物素的測定》,乳類、嬰兒配方食品使用檸檬酸緩沖液或3%硫酸溶液,經121 ℃高壓水解15 min提取,調酸沉淀蛋白質的方法。李菁菁[12]采用水提取,采用三氯甲烷沉淀蛋白質;王鳳玲[13]采用水提取,采用鹽酸調pH值沉淀蛋白質。三氯甲烷沉淀樣品測試波動大重現性差,使用國標方法提取沉淀與醋酸、高氯酸、鹽酸沉淀測試結果沒有明顯差異,而且操作繁瑣,在3種酸的比較中,醋酸為弱酸,具有一定緩沖能力,不用調節pH值,只需加入固定量即可實現蛋白質沉淀,操作最為簡便。最終確定以水提取,使用20%醋酸1 mL沉淀蛋白。
2.2 樣品的凈化
在測定乳制品中生物素,很多文獻均采用沉淀蛋白質后直接上機測試,但超高效液相色譜柱填料顆粒僅有1.7μm左右,樣品不凈化容易造成色譜柱的污染和阻塞,影響色譜柱的壽命同時也容易造成離子源的污染增加儀器維護保養成本。本研究發現,HLB固相萃取柱對生物素有較強保留,可以有效的凈化樣品,測試了60、200、500 mg這3個規格的SPE柱,上樣量10 mL時在60 mg SPE柱也不會過載造成損失,考慮檢測成本的問題選擇60 mg/3 mL的HLB固相萃取柱即可實現凈化。
2.3 儀器條件的選擇
液相條件下在流動相的選擇上,梁慧敏[14]采用乙腈-0.1%甲酸10 mmol·L-1乙酸銨;但也有采用乙腈-0.1%甲酸水溶液[15],表明流動相中添加乙酸胺對色譜峰峰形及靈敏度沒有促進作用,同時通過實驗證明乙腈-0.1%甲酸水比甲醇-0.1%甲酸水靈敏度更高。
質譜條件下,生物素采用電噴霧源正離子檢測方式,配制1.0 μg·mL-1的生物素標準溶液,調節毛細管電壓和錐孔電壓得到響應較強的質量數245作為母離子。然后對母離子進行子離子掃描,調節碰撞能量,選擇響應較高的2個子離子作為定性定量離子。其中響應高質量數227的作為定量離子,另質量數97作為定性離子。優化確定適合本研究的質譜條件。
2.4 基質效應的考察
在液相色譜串聯質譜的應用中基質干擾效應最為常見,且干擾程度不盡相同,在生物素的測定當中盡管對樣品進行的凈化,通過測試基質效應(ME)仍小于70%,基質干擾不能被忽略。消除基質效應的方法主要有對樣品稀釋、使用基質標、使用內標,樣品稀釋過多影響方法靈敏度,而生物素普遍存在于乳中,乳制品沒有絕對的空白樣品,無法使用基質標的方法定量。內標法一直被認為是液相色譜串聯質譜技術中消除基質干擾、提高定量準確度最有效的方法,因此本方法采用基質標的方法來消除基質干擾實現準確定量。
2.5 方法的驗證
2.5.1 準確度評價
用本方法參加中國檢科院組織的嬰幼兒配方奶粉中生物素的能力驗證能,兩個樣品結果分別為24.5 μg/100 g和39.4 μg/100 g,Z= +0.4和+0.7,Z<2為滿意結果。用本方法測定了生鮮乳中生物素含量,結果在1.51~2.74 μg/100 g,與劉志楠[16]測定牛奶本地中生物素含量的研究結果接近。證明該方法可以準確測定乳制品中生物素的含量。
2.5.2 回收率、精密度評價
選擇已知含量樣品(24.0 μg/100 g)做空白樣品,分別添加3個不同濃度梯度(表2)標準溶液進行測定,每個梯度做6個平行測試,3個濃度生物素平均回收率分別為93.7%、97.2%、94.7%,RSD分別為2.04%、1.91%、2.68%。表明本法精密度較好,適合乳制品中生物素的定量分析。
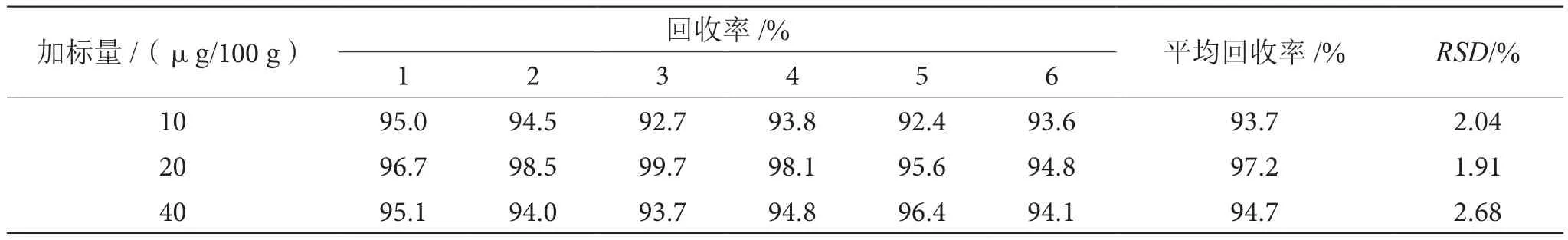
表2 加標回收率表
2.5.3 檢出限、定量限評價
定量離子3倍信噪比(S/N)評價方法檢出限,根據1.2方法處理計算得到檢出限為0.3μg/100g;以10倍信噪比(S/N)得到方法定量限1.0μg/100g;檢出限、定量限均低于國家標準GB 5009.259-2016。可用于含量較低的樣品中生物素定量分析。
3 結論
乳制品中基質復雜,通過SPE凈化有效去除樣品中雜質,加入同位素內標可消除基質效應的影響同時利用質譜的高選擇性,獲得了穩定良好的測定結果。本實驗建立了一種可以檢測乳制品中生物素含量的方法,操作過程簡單靈敏度高、重復性好,適合乳制品中生物素含量的測定。

